蛋黄果多酚的提取工艺及其抗氧化活性
2021-07-21马金爽韦少睁王潇哲陈园园刘红
马金爽,韦少睁,王潇哲,陈园园,刘红*
(1.海南师范大学化学与化工学院,海南海口571158;2.海口市热带特色药食同源植物研究与开发重点实验室,海南海口571158)
蛋黄果为山榄科植物,原产于美洲,广泛分布于南美洲和亚热带,中国海南、广东、广西均有种植[1-2]。蛋黄果果实近圆形,有一至四粒坚硬的种子[3]。果肉呈黄色,可以鲜食,也可用于制作冰淇淋、蛋羹、奶昔和果酱[4]。蛋黄果含有丰富的维生素C、蛋白质、淀粉、酚类物质,具有重要的生物活性[5-6]。植物多酚能够有效地清除自由基,可以减少冠心病、癌症的发生,是一种天然的抗氧化剂[7]。蛋黄果是一种优质的热带水果,关于蛋黄果的研究多集中于栽培及营养成分、抗氧化等方面[8-9],关于果肉和种子多酚提取工艺与抗氧化比较的研究还尚未见报道。
植物多酚的提取率与温度、时间和溶剂等多因素有关。本文首先利用超声波法辅助提取蛋黄果的果肉和种子多酚,然后采用单因素试验方法,考察提取时间、提取温度、料液比和提取剂浓度对果肉和种子多酚提取率的影响,最后再采用响应曲面法对果肉和种子多酚的提取工艺进行优化,以获得最佳提取条件[10-11]。本研究通过响应面法优化超声波辅助提取蛋黄果的果肉和种子多酚的工艺条件,评价果肉和种子多酚的抗氧化活性,为蛋黄果的营养保健加工提供理论参考。
1 材料与方法
1.1 材料与仪器
蛋黄果:市售;福林酚试剂、DPPH:美国Sigma公司;抗坏血酸、石油醚、水杨酸、邻苯三酚(均为分析纯):国药集团化学试剂有限公司。
DHG-9070A恒温鼓风干燥箱:上海申贤恒温设备厂;LGJ-10冷冻干燥箱:北京四环科学仪器厂有限公司;RE-52AA旋转蒸发仪:上海亚荣生化仪器;XO-5200DTS超声波清洗仪:南京先欧仪器制造有限公司;722可见分光光度计:上海菁华科技仪器有限公司;H50循环水冷却恒温器:北京莱伯泰科技仪器有限公司。
1.2 方法
1.2.1 样品制备
优选成熟的蛋黄果,用手剥离果肉和种子。将果肉打浆、冷冻干燥后粉碎,过60目筛;将种子置于50℃的烘干箱中烘干,粉碎,过60目筛。使用石油醚脱去上述两种粉中脂肪,再置于40℃烘箱中干燥,储存备用。
1.2.2 多酚标准曲线的建立
配制浓度为0.1 mg/mL的没食子酸标准溶液,准确量取 0.00、0.05、0.1、0.2、0.4、0.6、0.8、1 mL 于 7 个25 mL容量瓶,分别加2mL蒸馏水摇匀,分别加2mol/L福林酚试剂1.0mL,静置8 min,加入10%的无水碳酸钠溶液3 mL,定容,避光水浴(25℃)2 h,在765 nm处测定吸光度,绘制没食子酸标准曲线[12]。回归方程为Y=84.6785X-0.00161,R2=0.998 7。
1.2.3 多酚的提取与测定
以一定浓度的乙醇为提取剂,分别称量1.0 g果肉和种子粉末于锥形瓶中,在超声功率200 W、提取时间100 min、提取温度 50 ℃、料液比 1∶20(g/mL)的条件下对多酚进行提取,过滤,定容于50 mL容量瓶,取样品液1 mL按照上述操作测定吸光度,计算多酚提取率。计算公式如下。
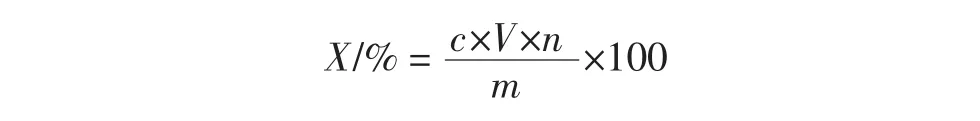
式中:X为多酚提取率,%;m为样品质量,g;c为提取液多酚的质量浓度,mg/mL;V为提取液体积,mL;n为稀释倍数。
1.2.4 单因素试验
以蛋黄果果肉和种子多酚提取率为指标,考察并分析提取剂(乙醇)浓度(30%、40%、50%、60%、70%)、提取时间 (40、60、80、100、120、140 min)、 提取温度(30、40、50、60、70、80 ℃)以及料液比[1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)]等单一因素对多酚提取率的影响。
1.2.5 响应面试验设计
根据单因素提取试验结果,选择多酚提取时间、提取温度、乙醇浓度作为自变量,蛋黄果的果肉和种子多酚提取率作为响应值,设计三因素三水平的响应面试验,经拟合二次多项回归方程最终确定最佳多酚提取工艺。
1.2.6 多酚的抗氧化活性研究
1.2.6.1 多酚的提取制备
按照响应面法优化的最佳条件提取蛋黄果的果肉和种子多酚,分别配制不同浓度的样品液(0.2、0.4、0.6、0.8、1.0 mg/mL)进行抗氧化活性试验。
1.2.6.2 抗氧化性测定
DPPH自由基清除率的测定:参照Brand-Williams等[13]方法稍作修改,准确量取2 mL的样品液和2 mL 1 mmol/L DPPH溶液,摇匀并于25℃避光反应30 min,测定517 nm处的吸光度,计算清除率。
·OH清除率的测定:根据RE等[14]方法稍作修改,加入各2 mL的6 mmol/LFeSO4、水杨酸和H2O2溶液,避光水浴(37℃)反应1 h。测定520 nm处的吸光度,计算清除率。
O2-自由基清除率的测定:参照王宗君等[15]方法稍作修改。取2 mL样品,依次加入5 mL的0.05 mol/L Tris-HCl缓冲溶液、1 mL 0.05 mol/L邻苯三酚溶液和0.2mL的0.05mol/LHCl溶液,反应10min,记录325nm处的吸光度,计算清除率。
1.3 统计分析
所有试验数据重复3次。响应面设计利用Design-Expert 8.0软件进行处理,其余均采用Origin 8.5软件作图分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇浓度对果肉和种子多酚提取率的影响
乙醇浓度对多酚提取率的影响见图1。

图1 乙醇浓度对多酚提取率的影响Fig.1 Effect of ethanol concentration on extraction of polyphenols
影响多酚提取效果的一项重要因素是乙醇溶液浓度[16],随着乙醇浓度的增加,多酚提取率呈先升后降的趋势。乙醇浓度在30%~40%,种子多酚提取率明显上升,在40%之后逐渐下降。果肉多酚提取率在乙醇浓度30%~50%呈直线上升,而后缓慢下降。因为植物体内的水溶性多酚分布在细胞的液泡中,而非水溶性的多酚物质存在于细胞壁上,且多与蛋白质或多糖类物质以氢键结合。低体积分数的乙醇溶液可以进入细胞内部,而高体积分数的乙醇会引起蛋白质变性,阻止多酚类物质的传质过程,从而降低多酚的提取率。因此,选择50%和40%的乙醇溶液分别作为果肉和种子多酚的提取溶剂。
2.1.2 提取时间对果肉和种子多酚提取率的影响
提取时间对多酚提取率的影响见图2。
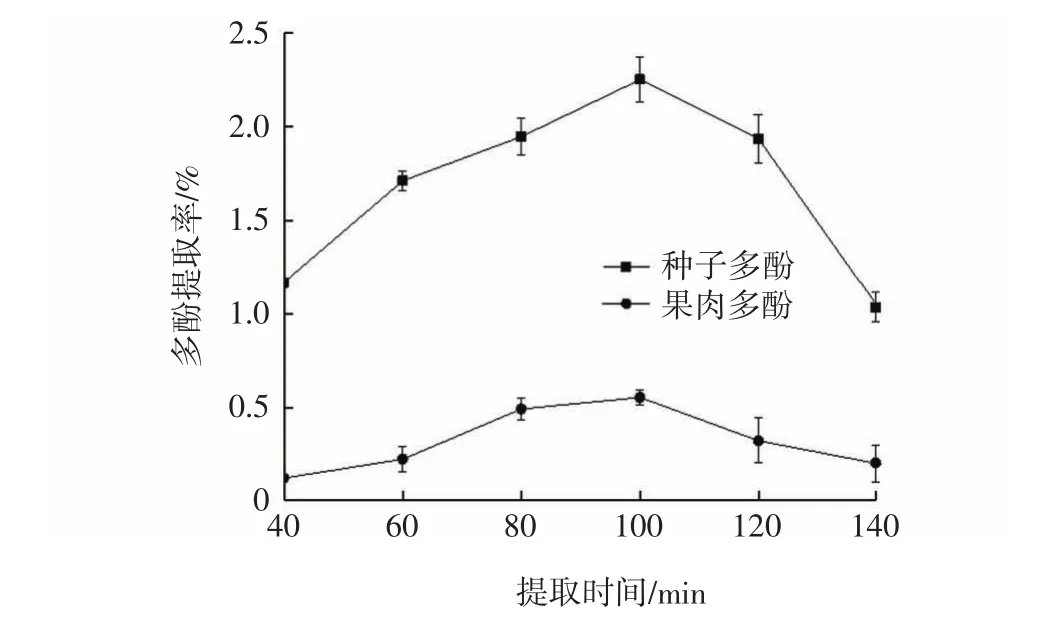
图2 提取时间对多酚提取率的影响Fig.2 Effect of extraction time on extraction of polyphenols
为了研究提取时间对果肉和种子多酚提取率的影响,设置提取时间为40 min~140 min。 提取时间的延长,有利于果肉和种子多酚的提取率的提高,而提取时间超过100 min,果肉和种子多酚提取率随之下降。超声辅助提取植物多酚时可加速植物多酚从细胞壁中释放从而影响多酚提取率,植物多酚的结构受提取时间过长影响而遭到破坏,引起植物多酚提取率显现明显下降的趋势[17]。因此,果肉和种子多酚的最佳提取时间为100 min。
2.1.3 提取温度对果肉和种子多酚提取率的影响
提取温度对多酚提取率的影响见图3。

图3 提取温度对多酚提取率的影响Fig.3 Effect of extraction temperature on extraction of polyphenols
提取温度高低直接影响多酚提取率,由图3可知,温度在30℃~60℃,果肉和种子多酚提取率呈上升趋势,当温度达到60℃时,果肉和种子多酚提取率达到最大值。温度影响分子运动速度,升高温度加快多酚提取率的提高。当提取温度高于60℃时,种子和果肉多酚提取率均有下降。多酚在较高温度可能发生氧化或者降解[18],因此,果肉和种子多酚的最佳提取温度为60℃。
2.1.4 料液比对果肉和种子多酚提取率的影响
料液比对果肉和种子多酚提取率如图4所示。
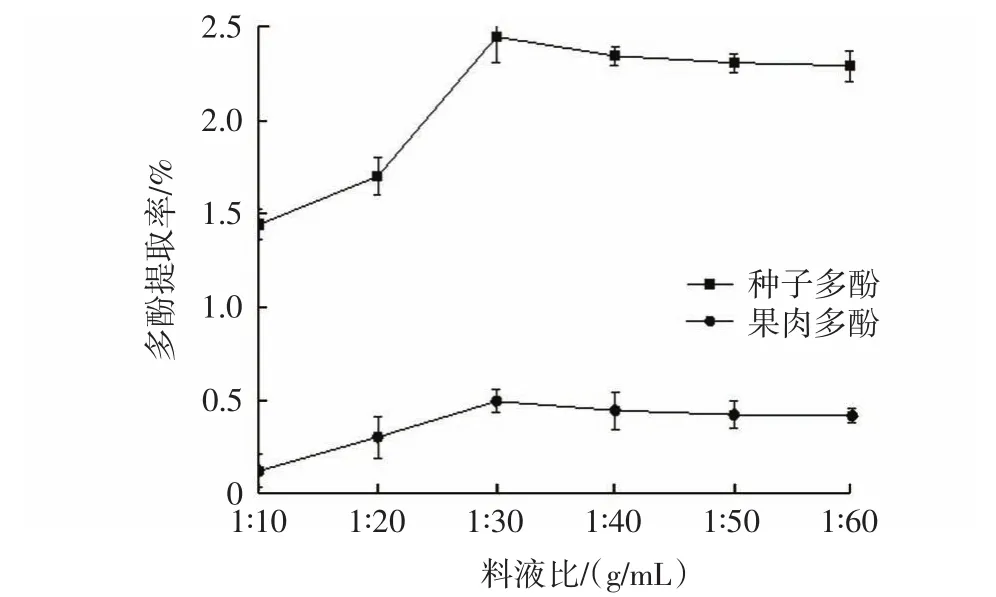
图4 料液比对多酚提取率的影响Fig.4 Effect of ratio of material to water on extraction of polyphenols
料液比在 1∶10(g/mL)~1∶30(g/mL)时,果肉和种子多酚提取率呈上升趋势,这是由于随着溶剂量的增加,多酚易于扩散、溶解。当料液比为 1∶30(g/mL)时,果肉和种子多酚的提取率最大,继续增加溶剂量,果肉和种子多酚的提取率稍有下降,较为平缓,这可能是提取过程中有一些多糖等杂质干扰[19]。因此,选择料液比1∶30(g/mL)作为果肉和种子多酚的提取条件。
2.2 响应面法优化多酚的提取工艺
2.2.1 模型拟合和统计分析
根据单因素试验结果,多酚提取率与三因素(乙醇浓度、提取时间、提取温度)有关,因此,响应面法优化超声波辅助提取蛋黄果的果肉和种子多酚的自变量设为乙醇浓度、提取时间、提取温度,三因素三水平试验设计以及试验结果(种子/果肉)见表1。

表1 Box-benkhen试验设计和多酚提取率Table 1 Box-benkhen design and extraction yield of polyphenols
得到的二次多项式回归模型方程为:Y种子=2.60+0.012A+0.012B+0.01C+0.013AB-0.002 5AC+0.023BC-0.22A2-0.15B2-0.13C2;Y果肉=0.69+0.043A+0.013B+0.020C-0.030AB+0.065AC+0.005BC-0.13A2-0.082B2-0.13C2。
果肉多酚提取工艺回归模型的方差结果见表2。
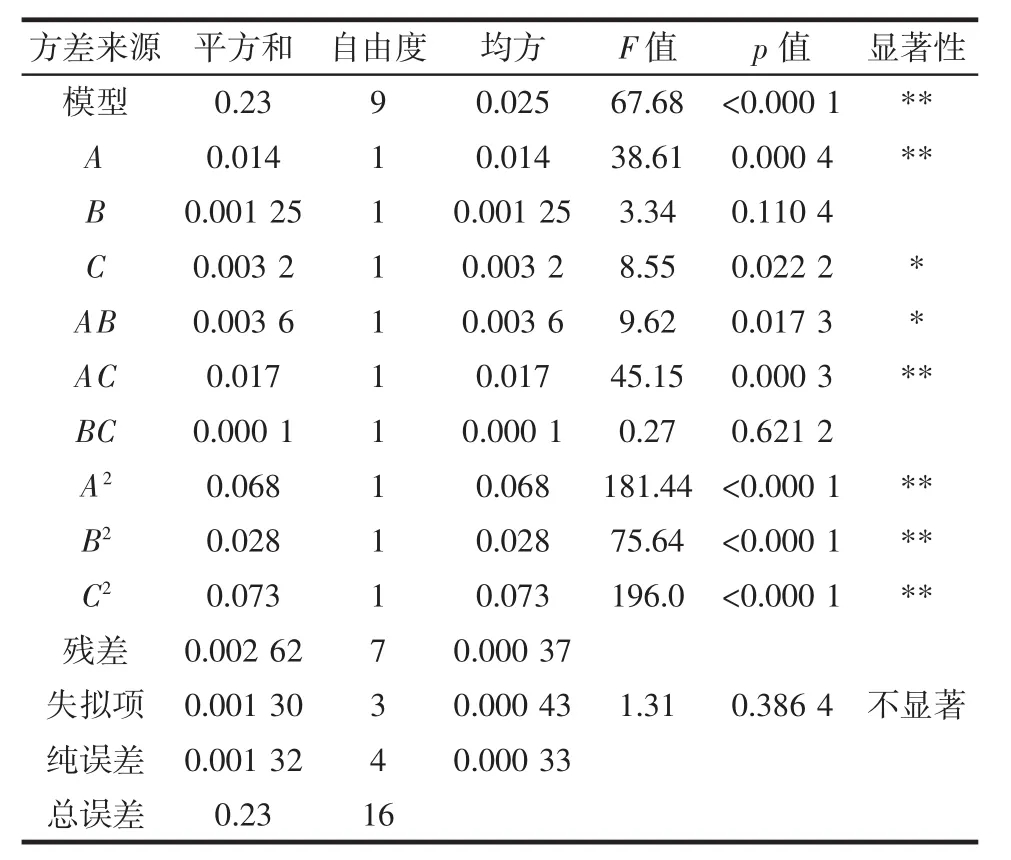
表2 果肉回归模型方差分析Table 2 Analysis of variance of the pulp regression model
模型的显著性与F值和p值有关[20]。果肉多酚提取模型的 F 值=67.68,p<0.000 1,R2=0.988 6,R2adj=0.974 0,显示模型显著且拟合程度较好;果肉多酚模型的C.V.%为3.63%,表明试验值的精确性和可靠性较好。果肉回归模型中一次项 A,二次项 A2、B2、C2,交互项 AC 为极显著性差异(p<0.01);一次项C、交互项AB表现为显著性差异(p<0.05),而一次项B、交互项BC为不显著(p>0.05),表明乙醇浓度对果肉多酚提取率影响较小,结合F值可知各因素的影响大小为提取温度(A)>提取时间(C)>乙醇浓度(B)。
种子多酚回归模型的方差结果见表3。
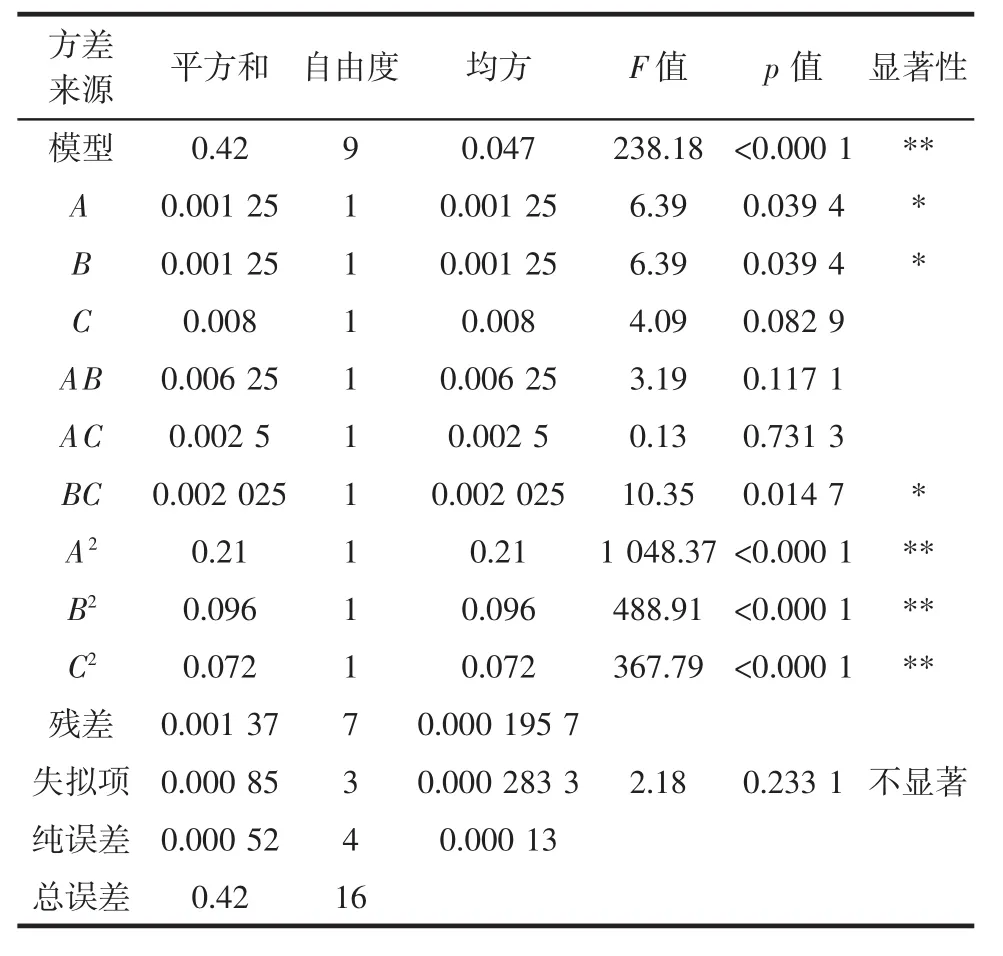
表3 种子回归模型方差分析Table 3 Analysis of variance of the seed regression model
种子多酚提取模型的F值为238.18,p<0.000 1,模型极显著。种子多酚模型的R2为0.996 7,R2adj为0.992 6,显示模型拟合程度较好,试验值和预测值接近;并且种子多酚模型的C.V.%为0.59%,表明试验值的精确性和可靠性强。种子回归模型中一次项A、B,交互项 BC 为显著性差异(p<0.05), 二次项 A2、B2、C2为极显著性差异(p<0.01),一次项 C、交互项AB、AC为不显著(p>0.05),说明提取时间对种子多酚提取率影响较小,结合F值可知提取温度(A)和乙醇浓度(B)对种子多酚提取率的影响大小一致,均大于提取时间(C)。综上分析,蛋黄果种子多酚所建立的提取模型可信度较高,可用于预测种子多酚的提取量。
2.2.2 响应曲面图分析
两因素交互作用的响应面等高线图见图5~图6。
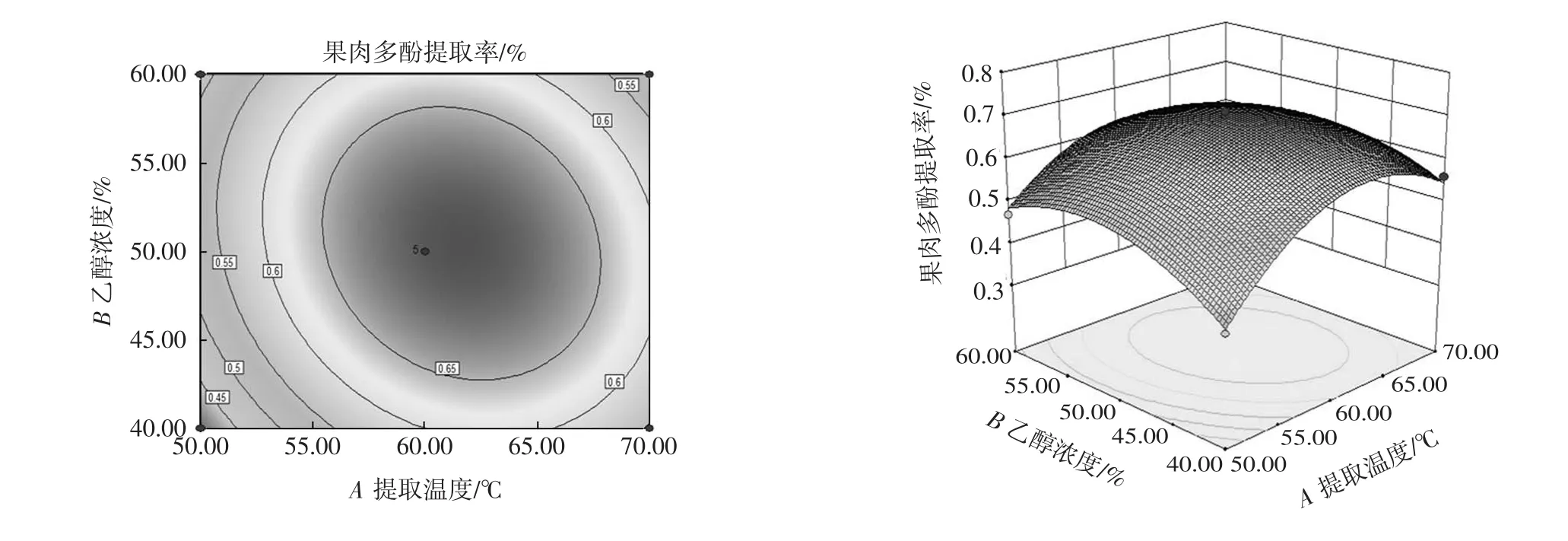
图5 乙醇浓度和提取温度交互作用对果肉多酚提取率影响的等高线图和响应曲面图Fig.5 Contour and response surface plot for the interactive effect of ethanol concentration and extraction temperature on the yield of polyphenols from pulp

图6 提取时间和乙醇浓度交互作用对种子多酚提取率影响的等高线图和响应曲面图Fig.6 Contour and response surface plot for the interactive effect of extraction time and ethanol concentration on the yield of polyphenols from seeds
响应曲面图直观地显示各因素之间交互作用对响应值的影响[21]。由图5可知,提取时间固定在0水平时,随着乙醇浓度和提取温度的增加,果肉多酚提取率呈先增后减趋势,提取温度比乙醇浓度对果肉多酚提取率的曲线较为陡峭,表明提取温度对多酚提取过程影响更大。由等高线椭圆形图可知,乙醇浓度和提取温度2种因素的交互作用对果肉多酚提取率有显著的影响。
由图6可知,提取温度在0水平时,当增加乙醇浓度和提取时间时,种子多酚提取率呈先增后减趋势且下降趋势非常明显,其中乙醇浓度和提取时间对种子多酚提取率的曲线陡峭程度相似,说明两因素对种子多酚提取率的影响程度相近。由等高线椭圆形图可以看出,乙醇浓度和提取时间的交互作用对种子多酚提取率比果肉多酚提取率影响大。
2.2.3 最佳条件的确定与模拟的验证
经过试验数据分析得出果肉和种子多酚的最佳提取温度分别为61.94、60.29℃,最佳乙醇浓度分别为50.44%和40.46%,提取时间分别为102.49、100.84 min,预测值分别为0.71%和2.69%;显然,果肉多酚和种子多酚最佳提取时间和提取温度的工艺条件接近。根据实际情况对参数进行修正,修正后果肉和种子多酚的最佳工艺分别为提取温度62℃和60℃,乙醇浓度50%和40%,提取时间102 min和101 min;按最佳工艺条件重复试验3次,得到果肉和种子多酚实际提取率分别为0.74%和2.65%,试验值接近于预测值,模型可行。
2.3 多酚的抗氧化活性
2.3.1 DPPH自由基清除能力
多酚对DPPH自由基的清除活性见图7。
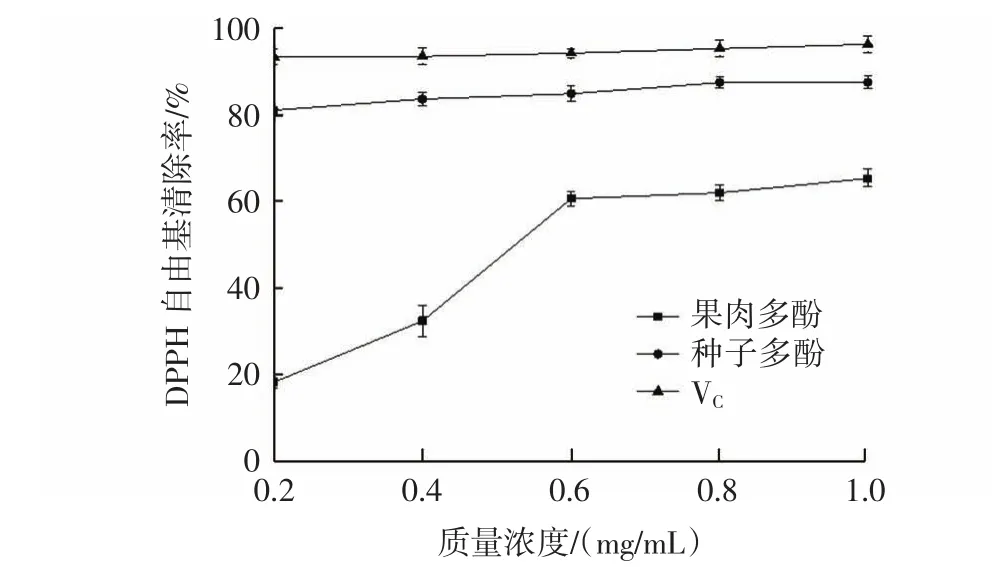
图7 多酚对DPPH自由基的清除活性Fig.7 Scavenging activity of polyphenols on DPPH·
由图7可知,果肉多酚、种子多酚和VC对DPPH自由基的清除能力随着样品质量浓度的增加而增加,其中果肉多酚受浓度影响较大,此结果与文献报道一致[22-25]。同一浓度下,VC的清除效果最好,种子多酚次之,果肉多酚的清除能力最弱。当浓度为1.0 mg/mL时,VC、种子多酚、果肉多酚的清除率分别为96.36%、87.50%、65.31%,由此表明,果肉和种子多酚都具显著的DPPH自由基清除能力,且种子多酚的DPPH自由基清除能力强于果肉。
2.3.2 OH自由基清除能力
多酚对OH自由基的清除能力见图8。

图8 多酚对OH自由基的清除能力Fig.8 Scavenging activity of polyphenols on·OH
由图8可知,果肉多酚、种子多酚和VC对OH自由基的清除能力随着样品质量浓度的增加而增加,其中种子多酚受浓度影响最大。当浓度在0.2 mg/mL~0.4 mg/mL时,果肉和种子多酚的清除能力相差不大,在0.4 mg/mL之后,种子多酚的清除能力远高于果肉,但都弱于VC。当浓度为1.0 mg/mL时,VC、种子多酚、果肉多酚的清除率分别为89.11%、63.11%、22.64%,由此表明,种子多酚具有较强的OH自由基清除能力,高于果肉。
2.3.3 O2-自由基清除能力
多酚对O2-自由基的清除能力见图9。

图9 多酚对O2-自由基的清除能力Fig.9 Scavenging activity of polyphenols on O2-·
由图9可知,果肉多酚、种子多酚和VC对O2-自由基的清除能力随着样品质量浓度的增加而增加,其中果肉多酚和VC受浓度影响较大。当浓度在0.2 mg/mL~0.8 mg/mL时,种子多酚的清除能力要高于果肉多酚,在0.8 mg/mL之后,果肉和种子多酚的清除能力相接近,相比于果肉和种子多酚,VC的清除能力更高。当浓度为1.0 mg/mL时,VC、种子多酚、果肉多酚的清除率分别为96.33%、19.97%、19.92%,由此表明,果肉和种子多酚都具有一定的O2-自由基清除能力[26-27],且相差不大。
3 结论
采用超声波辅助法提取蛋黄果的果肉和种子多酚,并利用响应面法优化果肉和种子多酚的提取条件。果肉多酚最佳工艺条件为提取温度62℃,乙醇浓度 50%,提取时间 102 min,料液比 1∶30(g/mL),提取率为0.74%;种子多酚最佳工艺条件为提取温度60℃,乙醇浓度 40%,提取时间 101 min,料液比 1∶30(g/mL),提取率为2.65%;此外,通过体外抗氧化活性试验来探究果肉和种子多酚的抗氧化能力。结果表明,果肉和种子多酚对DPPH自由基、OH自由基、O2-自由基均有清除能力,且种子多酚的清除能力较强。蛋黄果种子中多酚的含量要高于果肉,且种子多酚的抗氧化能力也强于果肉。蛋黄果的果肉和种子提取工艺模型可行性高,抗氧化性能优越。
