尾侧外侧入路行腹腔镜右半结肠癌根治术的安全性及可行性临床分析
2021-07-21公丕庆胡志前姚厚山
公丕庆 胡志前 姚厚山
结肠癌是消化道常见恶性肿瘤之一,我国结肠癌的发病率在所有恶性肿瘤中居第3位,死亡率居第5位,2015年统计数据显示,新发病例约37.6万例,死亡约19.1万例[1]。目前结肠癌的治疗方法主要以手术根治为主。自1991年Jacobs等[2]完成世界上第1例腹腔镜结肠癌手术以来,结肠癌手术进入微创时代。研究显示腹腔镜与传统开腹手术相比,除了具有恢复快、创伤小、美容效果好等独特优势外,在术后无瘤生存率、长期生存率等方面也毫不逊色[3-8]。2009年,德国学者Hohenberger等[9]提出的完整结肠系膜切除(complete mesocolicexcision,CME)更是成为目前结肠癌手术的“金标准”。右半结肠因其解剖学变异大,血管位置关系相对复杂,部分患者腹部脂肪组织多,部分手术解剖标志辨认难度大,使得腹腔镜下右半结肠癌根治术成为结直肠外科手术讨论的焦点。其手术入路争论不断,目前仍没有统一标准。本研究回顾性分析长征医院肛肠外科2019年1月至2019年12月实施的尾侧外侧入路法CME腹腔镜下右半结肠癌根治术21例患者临床资料,探讨其在临床上的可行性、安全性及其效果,现报道如下。
资料与方法
一、临床资料
将2019年1月至2019年12月长征医院肛肠外科完成的21例尾侧外侧入路法CME腹腔镜下右半结肠癌根治术病例纳入观察。记录患者性别、年龄、BMI、肿瘤部位、术前肠镜检查结果,术前胸、腹部增强CT结果、ASA评分、术前合并症。本组21例患者中,男性19例,女性2例,平均年龄(56.8±14.5)岁,BMI(23.4±3.4)kg/m2;肿瘤部位:结肠肝曲16例,升结肠2例,回盲部3例,术前肠镜活检病理结果明确为腺癌,术前常规胸腹部增强CT排除远处转移,ASA评分为Ⅰ~Ⅲ级,经评估患者均能耐受腹腔镜手术。术前合并高血压病史5例,糖尿病史2例,房颤史2例,恶性肿瘤史1例。
二、手术方法
本组术者均为高年资、副主任医师以上职称,临床手术经验丰富。
1.术前准备
术前1天流质饮食,清洁肠道,术前半小时预防性使用抗生素。
2.手术步骤
(1)气管插管全身麻醉,患者取仰卧位,呈“大”字形,均采用5孔法,气腹压力维持在12 mmHg~15 mmHg(1 mmHg=0.133 kPa)。脐下3 cm~4 cm观察孔,左侧锁骨中线肋下缘1 cm为主操作孔(Trocar 10 mm),左下腹脐旁3 cm,脐下2 cm,为副操作孔(Trocar 5 mm),助手操作孔为右下腹脐旁3 cm,脐下2 cm、右侧锁骨中线肋下缘1 cm(Trocar 5 mm)。(2)常规探查腹腔,排查腹膜、网膜和脏器表面有无转移病灶,最后探査原发病灶,了解肿瘤位置和大小,明确手术范围。(3)尾外侧入路路径:将患者置于头低足高15~30度、左侧倾斜20~30度,从末端回肠系膜以及回盲部与后腹膜愈着处的“黄白交界线”切开,尾侧、外侧同步将右半结肠“翻页状”向左上方至后腹膜游离,向内侧解剖到肠系膜上静脉左侧缘,外侧完全游离好结肠肝曲,向头侧分离至十二指肠球部,使右半结肠及其系膜至侧腹膜、后腹膜及十二指肠、胰头完全游离,从后方显露副右结肠血管、Henle干以及两者汇合处,见图1。(4)完成右结肠分离后,翻转至右结肠系膜前方,同中央入路完成右半结肠血管离断及D3淋巴结清扫,见图2。(5)将视野转向横结肠上区,于胃大弯血管弓外(扩大右半结肠切除术时于弓内)离断胃结肠韧带,进入小网膜囊,在胰腺下缘切开横结肠系膜前叶,将迅速与后方和外侧完成会师见图3。完成末端回肠、盲肠、升结肠、结肠肝曲及横结肠近端游离。

图1 尾外侧游离边界。1A:尾外侧同步打开,内上方游离至十二指肠球部;1B:内下方游离至副右结肠静脉汇入Henles干

图2 淋巴结清扫。2A:根部分离、结扎、离断回结肠静脉;2B:根部分离、结扎、离断结肠中动脉;2C:结扎、离断副右结肠静脉和胃网膜右静脉;2D:根部分离、结扎、离断结肠中静脉;2E:弓内离断胃结肠韧带;2F:根部分离、结扎、离断回结肠动脉
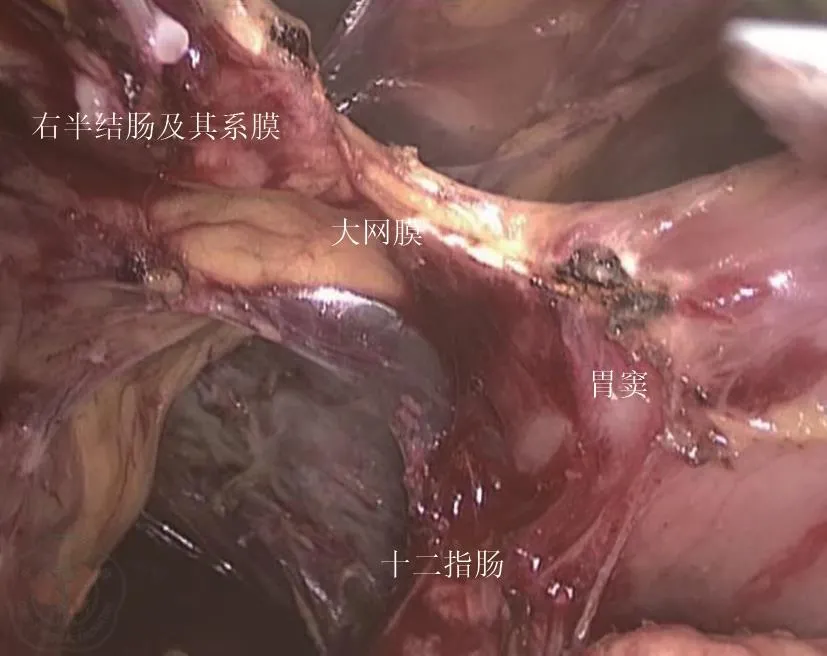
图3 头侧与尾侧汇合,完成右侧结肠游离
三、疗效评价
包括手术时间、术中清扫淋巴结数目、术中失血量、术后排气时间、术后恢复流质饮食时间、术后拔除尿管时间、术后住院时间、术后并发症、术后肿瘤性质及分期等。
四、手术清扫质量评估
评估指标包括:淋巴结清扫数目、手术标本质量评估、环周切缘。
手术标本质量评估分为3级,包括:(1)差:固有肌层面仅切除少量结肠系膜,并且轴向最近切缘达到肠壁固有肌层;(2)良:结肠系膜内层面不规则,仅切除了部分结肠系膜,并且轴向最近切缘超过肠壁固有肌层;(3)优:结肠系膜层面完整切除结肠系膜,并且腹膜壁层切面平滑,联合结肠血管高位结扎。
五、统计学方法
应用SPSS 20.0软件进行描述性统计分析,计数资料用均数±标准差(±s)表示,计量资料用率表示。
结 果
一、围手术期指标
本组21例患者均在腔镜下顺利完成手术,无中转开腹者。手术平均时间(150.4±28.1)min,术中平均出血量(78.57±190.76)mL,术后平均排气时间(3.0±0.6)d,术后平均恢复饮食时间(3.5±2.6)d,术后平均拔除尿管时间(4.0±0.9)d,术后平均住院时间(7.2±2.5)d,术后并发症发生率14.28%,吻合口出血1例,肺部感染合并肠梗阻1例,腹泻1例。CME质控分级:Ⅱ级(良)2例,Ⅲ级(优)19例。环周切缘21例均为阴性。
二、术后病理结果
肿瘤性质:腺癌10例,黏液腺癌1例,管状腺癌7例,腺癌合并黏液腺癌3例,淋巴结清扫数目(18.5±5.4)枚,肿瘤分期:Ⅰ期1例,ⅡA期8例,ⅢA期1例,ⅢB期11例。
讨 论
腹腔镜右半结肠癌根治术的手术入路由早期的外侧入路,发展到中间入路、头侧入路和尾侧入路等。其中以回结肠血管或肠系膜上静脉为腹腔镜下解剖标志的完全中间入路是目前应用最普遍的手术路径,但其作为标准手术入路仍存在争议。首先,对于部分肥胖患者或者结肠系膜较厚、充血水肿甚至是肠系膜上静脉变异的患者,解剖标志识别难度大;其次,中间入路法是由浅入深切开结肠系膜进入结肠系膜后叶与肾前筋膜的融合筋膜间隙,在解剖过程中无法预知深部结构,容易造成副损伤,对外科医师手术技巧及经验要求高,初学者容易进入错误的解剖间隙,深则可能误伤输尿管等腹膜后器官,浅则可能在结肠系膜内分离,容易出血和破坏系膜完整性。背侧入路或称尾侧入路因其通过回肠系膜根部的黄白交界线这一显著解剖标志,打开系膜,并可直接进结肠,在层面的寻找和维持上具有较传统中间入路更大的优势,因而成为近年来广受关注的一个入路选项。但同时,经过实践和总结亦发现,完全尾侧背侧入路进入到胰腺十二指肠前间隙时,由于此时外侧的侧腹膜和内侧的血管根部处系膜均未打开,在处理Henle's干的分支时,一旦出血,在几乎密闭的空间内,使用吸引器时这一右半结肠系膜后方的空间极易塌陷,很难维持一个良好的操作空间进行止血。考虑到尾侧或背侧入路和传统中间入路各自的优势和不足,近期有学者选择将两种入路加以混合杂交,采用尾侧-中间联合入路的方式,的确可体现两者的优势,但是手术过程中频繁切换场景,手术步骤较为繁琐,对助手的要求也比较高。
在前期入路的基础上,本中心开展了尾侧-外侧入路腹腔镜右半结肠癌根治术。将整个手术过程,简化为三步:(1)尾侧、外侧同步在Toldt's间隙以及横结肠后间隙内翻页状游离右半结肠及其系膜内侧至十二指肠球部、Henle's干以及SMV右侧,外侧完全游离好结肠肝曲;(2)D3淋巴结清扫,返回到腹侧走中间入路,在回结肠血管下缘切开系膜,即可与尾侧入路时分离的右结肠后间隙贯通会师,再顺着肠系膜上静脉进行解剖至Henle's干及其分支,途中离断回结肠、右结肠血管、结肠中血管主干或其右侧支,游离横结肠系膜至胰腺体部表面;(3)头侧弓内或弓外离断胃结肠韧带,分离融合筋膜间隙,与外侧、尾侧和内侧会师。与中央入路和尾侧中央联合入路相比其优点在于:(1)尾侧、外侧同步进行切开、游离,容易维持神圣平面,保护好十二指肠、肾脂肪囊、肾前筋膜的完整性;(2)尾侧外侧分离时,助手容易暴露,视野开阔,不易造成副损伤和血管出血;(3)手术步骤分为三步,由尾外侧→中央→头侧,尾侧外侧、中央血管解剖好后,头侧处理非常简便,迅速可完成会师,整个手术流程简便,不需要反复牵拉肠管;(4)先游离肿瘤周围,后离断血管,避免血管离断后,肿瘤局部浸润十二指肠等情况造成被动局面。(5)尾外侧入路能够更准确进入手术区域,解剖标识更易识别,特别是手术区域相关血管的辨识,减少术中出血发生,缩短手术时间,对于降低初学者学习曲线具有一定优势。
尾侧-外侧入路与前期开展的中央入路,尾侧-腹侧联合入路的区别主要在于,手术过程中先游离肿瘤,而后再处理血管,并未遵循no-touch技术,这也是学者们不做外侧入路的主要原因。no-touch技术在1967年由Turnbull等[10]提出,他的核心在于在离断肿瘤周围韧带之前先结扎离断其区域血管和淋巴管,目的是防止在移动肿瘤过程中肿瘤细胞脱落进入血管、淋巴管导致的术后复发转移率的增加。然后,从我们目前对肿瘤复发转移机制的研究来看,肿瘤细胞从脱离肿瘤到进入血管、淋巴管再到其他远隔器官是一个非常复杂的过程,而这一过程在根治性手术之前就已经发生而非发生在手术过程中,只不过形成的是微转移,没有表现出临床可见的病灶而已。因此,从现在的理论再来看no-touch技术就显得并非那么重要。虽然Turnbull等[10]在回顾性研究中得出采用no-touch技术能够改善结直肠癌根治术后的5年生存率,我们分析他们的数据可以发现,传统手术组早期患者(Stage A,8%vs.15.3%)占比明显低于no-touch技术组,晚期患者(Stage C+D,60.7%vs.54%)占比明显高于no-touch技术组,这有可能导致结果的偏移。随后,Wiggers等[11]在1988年进行的前瞻性随机对照研究并未显示出no-touch技术能改善结肠癌远期疗效,包括5年无疾病生存率和总生存率。Slanetz等[12]在1998年进行的回顾性研究发现在移动肿瘤之前结扎肠系膜血管,并不能影响结直肠癌根治术后生存情况,反而会显著增加术后远处转移和局部吻合口复发的发生率。随后,García-Olmo等[13]通过检测结直肠癌患者术前、术后外周血和主要肿瘤引流区域静脉血的CEA基因,也并未发现不遵循"no-touch"分离技术会引起手术过程中肿瘤细胞离开原位的证据。因此,no-touch在结直肠癌手术中的应用并未得到循证医学证据的支持[14],也并未被列入现行指南中。为了进一步寻找循证医学证据的支持,2014年日本启动了JCOG1006研究以评估no-touch技术(先游离肿瘤周围韧带后离断血管组和先离断中央血管后游离肿瘤周围韧带组)对结直肠癌根治术后远期疗效的影响[15],拟入组850例,目前研究结果尚未对外公布。
综上所述,尾侧外侧入路暴露充分,更易快速进入正确外科平面,血管显露更清晰,减少出血,实现CME和D3清扫,同时助手操作也更加轻松,降低了手术风险,易于掌握学习。当然本研究也有一定局限性,单中心回顾性研究,样本量少,缺乏与其他传统手术入路的比较,缺乏术后长期肿瘤学随访等工作,下一步我们将完善相关研究计划及数据。
表1 患者临床资料(±s)
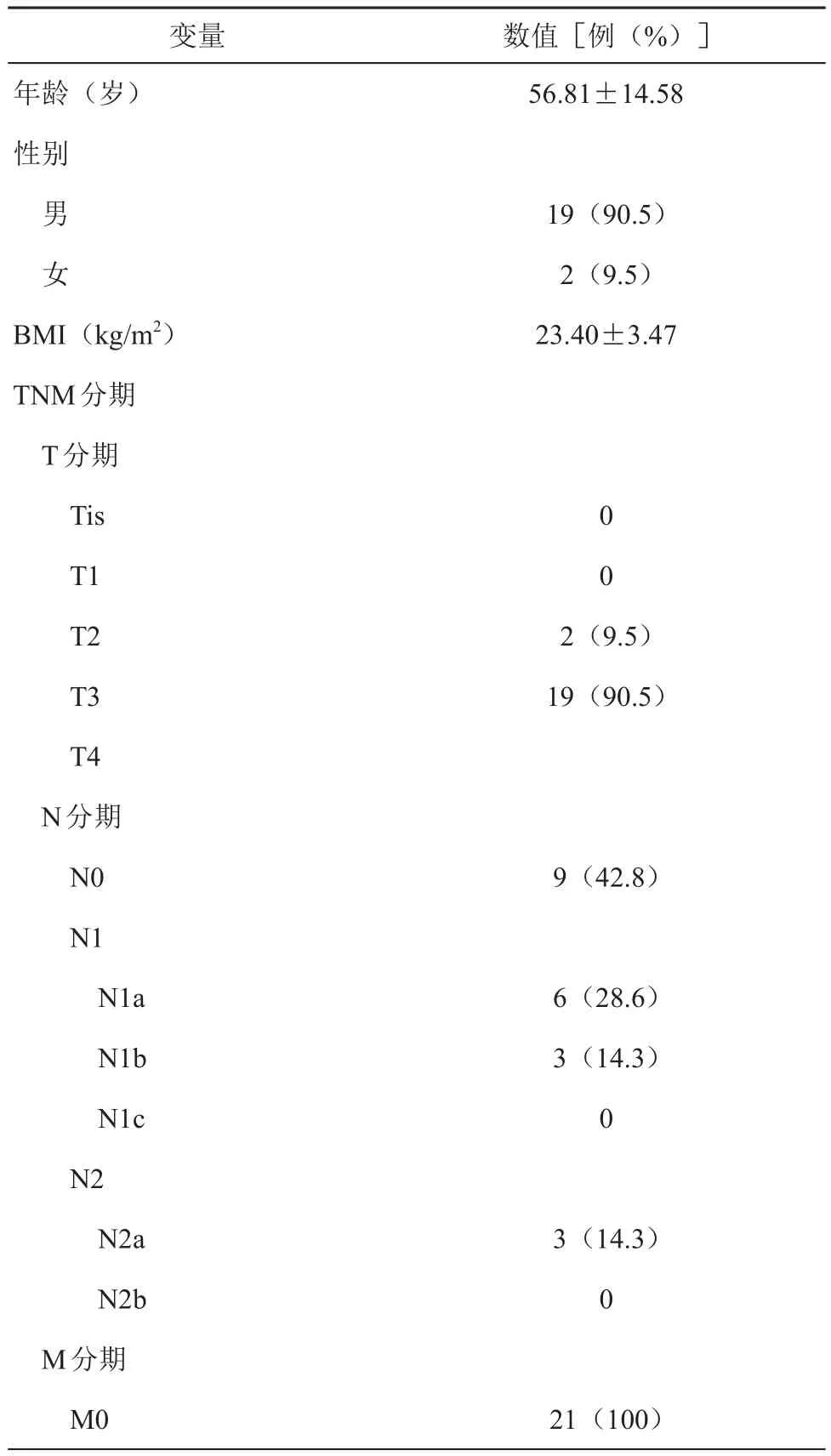
表1 患者临床资料(±s)
年龄(岁)性别男 女BMI(kg/m2)TNM分期T分期Tis T1 T2 T3 T4 N分期N0 N1 N1a N1b N1c N2 N2a N2b M分期M0 56.81±14.58 19(90.5)2(9.5)23.40±3.47 0 0 2(9.5)19(90.5)9(42.8)6(28.6)3(14.3)0 3(14.3)0 21(100)变量 数值[例(%)]

续表
