人工智能在结直肠癌方面的应用
2021-07-21吴志杰袁紫旭蔡建王辉
吴志杰 袁紫旭 蔡建 王辉
2019年全球结直肠癌新发病例约185万例,位居恶性肿瘤发病谱的第3位;每年有近90万人死亡,位居恶性肿瘤死亡谱的第2位。除了饮食习惯外,肥胖、缺乏体育锻炼和吸烟等是结直肠癌发病的高危因素[1]。预计到2035年大肠癌的全球新发病例将增加到250万例[2]。大肠癌的经典发病模式是起源于息肉,发展为腺瘤,最终演变为结直肠癌。这个过程主要是由基因突变和表观遗传改变积累所驱动,需要10到15年时间[3]。结直肠癌早期病变位于黏膜层及黏膜下层,早期无明显症状,直至中晚期才会出现明显临床症状。据报道,Ⅰ、Ⅱ期结直肠癌患者接受治疗,5年存活率(OS)可达75%~90%,Ⅲ期患者OS为40%~55%,Ⅳ期肠癌OS则不到20%[4]。由于结直肠癌早期症状隐匿,诊断非常困难,部分患者初诊时就已经处于结直肠癌晚期,治疗效果很差。
一、结直肠癌/息肉的诊断现状
结肠镜检查是诊断结直肠癌的金标准和首选筛查方式。结肠镜具有很好的直观性,可以评估息肉/肿瘤的位置、大小、数量等。更重要的是,对可疑病变进行病理活检鉴别良恶性。Nishihara等[5]在22年间对88 902名参与者随访发现:进行结肠镜检查后,近端结肠癌的死亡率明显降低(OR∶0.47)。
增强CT扫描是结肠镜检查的潜在替代方法,但是增强CT扫描无法进行活检和息肉切除术,如果发现可疑病变,患者仍需返回结肠镜检查。MRI扫描是直肠癌术前检查手段之一,但因扫描成本较高一般不作为结直肠癌检查的首选方式。
循环肿瘤DNA(ctDNA)是一种液体活检技术,具有操作简便、侵害性小、重复性高、易于动态监测肿瘤状态等优势,研究发现ctDNA可以和CEA进行联合检测,反映体内的肿瘤负荷水平同时作为早期结肠癌筛查标志物[6-7]。然而,不同的ctDNA检测方法有着不同的标准,适用的人群也不一样。ctDNA在结直肠癌方面的应用价值仍需进一步验证。
在结直肠癌早期筛查及诊断方面还有很多探索,例如肠道菌群的检测,胶囊内镜等。但是,目前临床上结肠镜因其简单便捷、诊断率及敏感性高,可以对发现的息肉直接病理活检,使结肠镜成为肠癌筛查的金标准。在病理活检的过程中,由于细胞异质性的存在,如何区分癌组织和正常组织,对病理图像中细胞核进行鉴定和分类,不同的病理医师对同一标本组织可能有不同的判断结果[8]。如何避免主观因素带来的影响,使肠癌的早期诊断更加稳定可靠,是目前临床上面临的难题。
二、人工智能在医学上的应用
随着人工智能(artificial intelligence,AI)的发展,尤其是深度学习算法的开发和应用,深度学习已在医学图像分析领域中开展了无数的应用,在肿瘤学、放射学、病理学、皮肤病学和眼科等都取得了飞速发展。例如在眼底照片中检测出糖尿病性视网膜病变[9],从皮肤照片中对皮肤癌进行分类[10],以及检测肿瘤转移的病理图像[11]。2018 年,Sun等[12]构建了特异性识别肿瘤浸润细胞CD8的影像组学-肿瘤标记物的AI模型,该模型实现了对肿瘤的免疫分型、对PD-1抑制剂疗效的精准预测。2020年,我们团队袁紫旭等[13]在Ann Surg上报道了结直肠癌腹膜转移的AI诊断模型,对腹膜转移诊断率(AUC)高达0.92。深度学习在识别组织病理学图像方面,比有经验的病理学家表现更好。最近研究开发了一种可检测前哨淋巴结中是否存在前列腺癌和乳腺癌转移的CNN方法,诊断的AUC值分别为0.99和0.88[8]。该模型可以成功识别所有乳腺癌和前列腺癌转移灶,具有极高的灵敏度。
三、AI在结直肠癌方面的应用
(一)AI辅助结肠镜诊断结直肠息肉
过去20年来,随着内镜技术的不断发展,结肠镜检查的图像质量和清晰度已得到显著改善,但是在检查过程中息肉/腺瘤仍可能被漏诊。有研究报道,即使有经验的结肠镜医师,在充分准备的肠道环境下,也可能会错过大约15%的<10 mm的结直肠息肉,但是很少会错过≥10 mm的息肉[14]。该研究表明,结肠镜检查对于结肠息肉/癌变的检测是高度依赖操作者经验的。然而即使病变就在内镜的视野内,内镜医师检查时仍可能会漏掉部分息肉[15-16]。可能原因包括:(1)内镜医师技术水平的差异;(2)“注意力不集中”,内镜医师由于疲劳或情绪因素分心,无法同时处理屏幕上的图像;(3)在眼球运动期间的“改变失明”时,即在视觉扫描时错过了息肉检出。另外,内镜医师在面对多个息肉时,无法对全部息肉病理活检,有经验的内镜医师往往只将怀疑癌变的息肉取活检,对年轻内镜医师提出了挑战,因此对结直肠息肉/腺瘤的检出率造成严重影响。随着深度学习的快速发展,对于结直肠癌的早期诊断帮助越来越大。AI的辅助应用可以提高肠镜的息肉检出率,以及对息肉特征辨认的准确性[17]。
美国胃肠内窥镜学会提出允许内镜医师采取光学方式(包括AI)来替代息肉组织的病理学评估[18]。例如增生性息肉检测阴性时,允许开展“诊断-离开”策略[19]。因此,研究人员开发了计算机辅助(CADx)系统,CADx能将腺瘤与增生性息肉区分开,该AI模型通过对息肉表面的血管图案进行识别和分析,判断出其良恶性,对息肉诊断的敏感性和特异性均>90%[20]。Kominami等[21]在一项前瞻性研究中构建了AI模型,提取训练图像上的相应特征并量化每个图像,诊断准确度极高,敏感性为93.0%,特异性为93.3%,阳性预测值(PPV)为93.0%,阴性预测值(NPV)为93.3%。因此,CADx可以提高结直肠息肉的光学诊断率,减少临床上非肿瘤性病变的切除概率,大大降低了医疗成本。
近年来,基于深度学习算法的AI模型发展迅速,Wang等[22]纳入1 290例患者的肠镜图像,利用深度学习开发了AI模型,可以实时、高灵敏性、高特异性地检测出息肉。在被检出>1个息肉的1 138例患者中,采集了27 113例患者的结肠镜图像进行验证,每幅图像的敏感性为94.38%,特异性为95.92%。在没有息肉的情况下,54例结肠镜录像中每个图像特异性为95.40%,该算法帮助内镜医生明显提高了息肉的检出率(ARD)。Wang等[23]在纳入的1 058例患者中,标准结肠镜检查组患者536例,计算机辅助结肠镜检查组患者522例,结果显示AI辅助系统(图1)显著提高了ADR(AI辅助组29.1%vs.标准组20.3%,P<0.001),并增加了每位患者的平均腺瘤数量(AI辅助组0.53vs.标准组0.31,P<0.001)。因此,深度学习在图像分析处理方面表现出色,可以极大地提高结直肠息肉的检出率,这种检出率是稳定可靠的,不会受内镜医师的工作经验高低等影响。
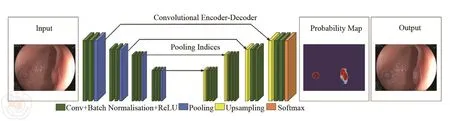
图1 AI辅助系统诊断息肉的流程图(基于SegNet架构的检测算法,将结肠镜图像按顺序扭曲为二值图像,1表示息肉像素,0表示无息肉的概率,然后输出显示出来)
(二)结直肠癌影像学与AI发展
1.基于CT图像的AI模型
2012年,Lambin等[24]首次提出“影像组学(radiomics)”的概念。影像组学中的纹理技术能够提供肉眼无法辨识的图像信息,可定量评估肿瘤病变特征,协助临床医师进行肿瘤分期、术前诊断、预后判断以及预测肿瘤复发[25]。影像组学是影像技术与AI相融合的交叉技术,在获取了大量标准化的医学图像数据后,借助图像分割软件,对肿瘤进行分割,提取强度、形态学和纹理特征,最后运用如logistic回归模型、支持向量机(SVM)、人工神经网络(ANN)等,建立影像组学预测和分类模型[26]。Liang等[27]纳入296例结直肠癌患者的CT图像作为训练集,通过自动提取最优特征,利用logistic回归建立了预测模型,ROC曲线验证该模型的分级性能,该模型的AUC为0.792,灵敏度和精确度分别为62.9%和87.4%[27]。但是,影像组学需要影像科医生提取图像,进行定义,需要消耗大量人力资源,难以在临床推广应用。
传统观念认为腹膜转移已是恶性肿瘤的终末期,多推荐全身化疗、姑息治疗等保守疗法。近年来随着对腹膜转移的研究深入,认为腹膜转移是一种局部区域性病变,提倡采用肿瘤细胞减灭术(CRS)联合腹腔热灌注化疗(HIPEC)的积极治疗策略。2020年,我们团队袁紫旭等[13,28]提取了19 814张结直肠癌患者静脉期CT图像作为训练集,勾画肿瘤原发病灶,通过深度学习算法建立了残差神经网络(ResNet模型)和神经网络注意力模型,构建ResNet3D的AI训练模型,再利用7 837张CT图像测试ResNet3D模型,为提高诊断率,进一步提取腹膜转移特征构建了联合ResNet3D模型的ResNet3D+矢量向量分类器(SVM),该模型诊断腹膜转移的AUC高达0.92,敏感度、特异度分别为94%,已经超过了影像专家对腹膜转移的诊断率(AUC∶0.721)[13]。2019年,北京大学肿瘤医院季加孚教授团队对胃癌CT图像的原发肿瘤和临近腹膜区域进行勾画并提取特征,构建了三个影像组学诺模图(radiomics nomogram),对腹膜转移的诊断AUC分别高达0.958,0.941,0.928[29]。该诺模图能够极好地预测隐匿性腹膜转移,对早期诊断具有重要的临床意义。这表明基于CT图像的影像组学技术,可作为判断肿瘤临床分期和晚期转移的辅助手段。如今AI技术与CT图像的融合,在结直肠癌的运用主要集中在临床分期、转移和预后预测等方面,在早期筛查方面还有待进一步研究。
2.基于MRI图像的AI模型
MRI扫描是直肠癌术前检查手段之一,在对肿瘤的位置、浸润深度、淋巴结转移、周围血管组织是否受侵犯等方面具有明显优势,但是MRI结果解读极大程度地受到医生临床经验、专业水平和工作强度的影响[30]。Trebeschi等[31]通过深度学习算法开发了一种自动分割程序,利用140例直肠癌患者的MRI图像建立训练集,对MRI成像进行直肠癌的准确定位和细分,该自动分割程序具有良好的诊断性能,其细分效果与专家手动勾画的细分水平相当(DSC为0.70)。同时,在分类方面该自动程序能够正确分类肿瘤体素(AUC=0.99)。2018年,青岛大学附属医院卢云团队利用AI开发了Faster R-CNN架构,纳入28 080张直肠癌淋巴结转移的MRI图像,建立了AI学习训练的影像数据库并进行验证,对每例患者MRI图像的诊断时间仅为20 s,是影像科医师诊断时间的1/30,诊断的AUC高达0.912,具有良好的临床可行性[32]。该Faster R系统是对高分辨率MRI图像的淋巴结转移进行识别和诊断,一定程度上减轻了影像科医师的工作量,并降低影像学专家的诊断水平差异带来的判断误差。
(三)结直肠癌病理图像与AI
病理诊断是疾病的金标准诊断,病理结果可能会受到切片厚度、均匀度、染色程度等图像质量影响,导致不同经验的病理医师得出不同结论。20世纪60年代,Prewitt等[33]将普通血液涂片的显微镜视野扫描成简单图像,然后将光学数据转换为光密度值矩阵,以进行计算机图像分析,这被认为是数字病理学的开端。数字化病理的核心技术是全玻片数字扫描与病理图像分析的算法,全玻片数字扫描技术(whole slide imaging,WSI)是一种现代数字系统与光学设备有机结合的技术,它通过高分辨显微镜扫描采集到的数字图像,再利用计算机对图像自动进行分割并拼接处理,量化病理图像的纹理、形状、大小、矩阵密度值和颜色等信息,最后得到数字病理切片。基于深度学习算法的CNN在近年来取得飞速进步,为数字病理学的发展提供了基础。
AI在病理图像处理领域的应用,简单说是对拍摄和扫描的图像进行预处理、分割、特征提取和分类以获取数字信息。数字化病理通过CNN可以对采取到的结直肠腺瘤进行分析。通过计算机软件来量化细胞形态、细胞核与细胞质面积、核浆比、细胞核的核分裂像,血管壁厚度、血管密度及腔体面积等一系列的量化标准,来判断组织学分型和预测患者的生存和预后。Kainz等[34]使用两个不同的CNN分类器对苏木精-伊红染色图像进行像素级分类,当第一个分类器将腺体与背景分离时,第二个分类器则将腺体结构识别出来。对病理图像进行分割识别并生成最终结果,辨别良恶性肠道肿瘤的准确率达到了95%~98%。Awan等[35]使用一种称为最佳比对度量(BAM)的新颖度量来测量腺体的形状,使用支持向量机(SVM)分类器从BAM得到的形状特征进行训练,交叉验证后可以区分正常组织和结直肠癌组织的准确率达到了97%。
AI有助于克服病理学家的主观视觉评估的局限性,提高病理医师诊断的准确性和客观性。有研究报道,在4 600例宫颈细胞学筛查中,数字化阅片数每小时约为单纯人工阅片的2倍,异常细胞检出率比单纯人工阅片的检出率增加了33.40%[36]。基于ANN的CellaVision DM96自动化数字图像分析系统通过定位红细胞、分割细胞图像、提取细胞特征进行外周血涂片分析,DM96对细胞分类结果的准确性>80%[37]。因此,AI可以辅助病理医生的诊断,初步处理海量的简单病理图像和提供初步病理诊断,将大大减少病理医生的工作量。
四、AI在医学应用上的不足
目前,AI在许多方面都不同于人类的智慧,例如AI仅仅针对一项具体任务进行训练并建立神经网络,只有极少数的人类智能[38],不能狭义地认为有AI领域就有最先进的技术。AI这种进步是用自下而上的方式来解释它所感知到的信息和简单任务,但它们缺乏高层次的、自上而下的系统知识,并且无法像人脑那样建立关联和自我分析判断,因此AI仍处于起步阶段。
首先,数据仍然是深度学习的最核心部分。研究指出,深度学习是基于输入的数据或图像(“喂数据”),然后自我学习并建立神经网络的算法模型。数据对于以深度学习为代表的学习模型至关重要[38]。其次,目前构建的AI模型只适用于特定临床范围,一旦超出该范围就会毫无作用。例如,根据主要来自黄种人的数据训练出的AI模型,对于白种族或少数族裔可能效果不佳,在美国训练的AI模型在亚洲可能效果不佳[39]。这种局限性很难让某一种AI模型普遍适用于全球范围内。深度学习模型通常看起来更像是“黑匣子”,是端到端的学习设计,吸收数据并生成及输出结论,并不能明确解释其输出结论的原理及过程。临床医生判断息肉是否癌变时,常常根据结肠镜检查、病理检查等一系列主要和次要标准。但是,AI仅仅给出一个结果,这不禁让我们质疑结论是否准确[40]。
五、AI技术在医学中的展望
AI作为一门新兴技术,在结直肠癌诊断方面取得了令人惊喜的结果。虽然各国在数据方面都保持着比较谨慎的态度,但是可以料想在全球化进程的发展,未来全球数据共享时,深度学习算法将可以运用全球数据进行训练学习,构建出一种适用于全球患者的AI疾病预测模型。或者未来AI能够直接突破目前AI模型的“模型偏差”的局限性,通过对最本质的、最根本的特征构建模型,并且对特征进行定量化,解释如何通过这个AI模型得出结果,解决目前“黑匣子”的困扰[28]。在AI技术不断进步的同时,我们应该时刻谨记:AI仅仅只是一个工具,AI永远也不可能取代人类。AI作为一个工具只会与人类的联系越来越紧密,在临床实践中,临床医师可以更好的使用AI这个工具,进行疾病辅助诊断、制定治疗方案及疗效预测等,从繁忙的工作中将临床医师解放出来,更好的为患者服务。
