MicroRNAs调控结直肠癌干细胞的研究进展
2021-07-21欧苏文罗康佳管子龙黄睿
欧苏文 罗康佳 管子龙 黄睿
结直肠癌(colorectal cancer,CRC)在2018年全球癌症统计中发病率位于第三位,在癌症相关死亡原因中排第二位[1]。然而,这种疾病发生与发展的确切机制仍有待发掘。肿瘤干细胞(cancer stem cells,CSCs)是癌细胞的一个小亚群,被认为是肿瘤生长、复发、转移和治疗耐药的驱动力[2]。癌细胞的生物学行为受遗传、环境等多种因素影响,而这些最终都作用在基因的表达调控上。MicroRNAs是一类参与转录后调控的小分子非编码RNA。在肿瘤细胞中,通常会出现一些基因和信号通路的异常激活或失活。而MicroRNAs在这些异常通路中发挥着重要作用。已有大量的研究发现MicroRNAs在结直肠癌干细胞(colorectal cancer stem cells,CCSCs)自我更新、增殖、分化、耐药等多种生物学过程中发挥着重要的调控作用。因此我们总结了MicroRNAs调控结直肠癌干细胞特性的各种机制(尤其是作用于多种信号通路)以及MicroRNAs在结直肠癌诊治中的应用前景。进一步阐明MicroRNAs在结直肠癌干细胞中的分子机制,有助于更好地理解CCSCs的生物学行为,并在结直肠癌的临床治疗中启发新的思考。
一、肿瘤干细胞学说的发展
一段时间以来,人们广泛地认为所有肿瘤细胞都具有无限增殖的能力。但随着研究的深入,人们发现肿瘤内拥有致瘤能力的细胞仅局限于肿瘤细胞的一个亚群。在20世纪中下叶,一些研究者提出了CSCs概念,认为CSCs是肿瘤自我更新的来源,也是肿瘤转移扩散的种子[3]。随后有研究者提出了一种肿瘤生长的干细胞模型,认为肿瘤细胞群体是异质性的,并预测了三种肿瘤细胞亚群:包括干细胞、增殖能力有限的中间细胞和终末细胞。该模型对肿瘤细胞进行等级分层,从干细胞到终末细胞的分化转变中,肿瘤细胞的自我更新和增殖潜能逐渐下降[4]。1997年,Bonnet等[5]发现只有少数表型为CD34+CD38-的白血病细胞能在免疫缺陷小鼠体内引发白血病,首次证实了白血病干细胞的存在。此后,研究者相继在乳腺癌、肝癌、胰腺癌、肺癌、卵巢癌等各种实体瘤中证实了CSCs的存在。这些研究共同支持基于以下四个特性的CSCs模型:(1)肿瘤中观察到细胞异质性是由其等级结构分层造成的;(2)肿瘤的分级是由少数具有自我更新能力的CSCs推动的,而瘤体大部分是由非CSCs构成,它们只能短暂增殖而对长期生长没有贡献;(3)CSCs的身份是比较固定的,非CSCs在异种移植试验中很少引发肿瘤,肿瘤结构分层的可塑性是有限的;(4)CSCs对化疗和放疗有抵抗力,这一现象解释了常规放化疗之后肿瘤的复发[2]。
二、结直肠癌干细胞
2007年,O'Brien等[6]首次在结直肠癌细胞中鉴定出CD133+这一亚群,它们比其他肿瘤细胞拥有更强的自我更新、增殖和致瘤能力,并且能重建肿瘤的异质性。这一发现证实了CCSCs的存在。根据CSCs理论,将CCSCs特性归纳为:(1)无限的自我更新能力;(2)无限的增殖潜能;(3)多向分化的潜能;(4)启始肿瘤形成和重建肿瘤异质性的能力;(5)抵抗放化疗的能力。这些特性是CSCs驱动肿瘤生长、侵袭、转移、抵抗治疗和复发的根本原因。目前,还没有特别理想的CCSCs标志物,但研究者已发现了一些分子可以用来较好地富集CCSCs,包括CD133、CD44、CD44v6、CD24、CD29、ALDH1、Lgr-5、EpCAM(ESA)、CD166、CD26、EphB2、DCLK1、Nanog、Oct-4、SOX-2等[7-8]。ALDH1作为CCSCs的表面标志比CD133和CD44有更好的特异性,在免疫缺陷小鼠中形成肿瘤只需要25个ALDH1+的结肠癌细胞[9]。DCLK1的表达被认为可以特异性地标记CCSCs,而不是正常的肠道干细胞[8]。这些标志物联合运用筛选出的细胞亚群干性往往比单个标志物更强。
三、MicroRNAs调控CCSCs相关特性
MicroRNAs(miRNAs)是一类长度为22个左右核苷酸的内源性的小分子非编码RNA,成熟的miRNAs以RNA诱导沉默复合体的形式,通过其5'端的种子序列与位于靶mRNA 3'非翻译区的序列互补结合,导致靶mRNA的降解或翻译的抑制[10]。人类大多数编码蛋白质的mRNA都含有进化上保守的miRNAs结合位点,因此miRNAs对基因表达的影响是非常广泛的。在结直肠癌中,miRNAs通过调控Wnt/β -catenin、 Notch、 PI3K/AKT、 JAK/STAT、 TGF-β/Smad等信号通路(见图1)、干细胞转录因子以及与CCSCs生物学行为相关的其他基因的表达在CSCs的干性调控中发挥着重要作用。

图1 miRNAs调控信号通路
1.miRNAs调控CCSCs的Wnt/β-catenin信号通路
Wnt/β-catenin信号的异常激活是大多数结直肠癌发生的启动因素[11]。过度激活的Wnt信号对于维持CSCs的致瘤潜能和干性至关重要。在结直肠癌中,一些miRNAs通过激活Wnt/β-catenin信号促进CCSCs的干性。TGFβ/TGFβR2信号在细胞的很多生物过程中发挥着重要作用。miR-21通过靶向TGFβR2的mRNA来激活Wnt/β-catenin-TCF/LEF信号,增强了结直肠癌细胞的体外成球能力和在免疫缺陷小鼠体内的致瘤能力[12]。F框/WD-40域蛋白7(F-box and WD repeat domain containing 7,FBXW7)可以通过促进细胞核内的β-catenin泛素化降解来抑制β-catenin信号。外泌体来源的miR-92a-3p通过抑制F框/WD-40域蛋白7表达来激活Wnt/β-catenin信号,从而促进结直肠癌细胞的干性、转移和氟尿嘧啶/奥沙利铂的耐药等能力[13]。轴抑制因子2(axis inhibitor 2,Axin2)是Wnt诱导的负反馈调节因子,用以及时控制Wnt介导的转录反应的终止。miR-103/107通过直接下调轴抑制因子2的表达,来延长Wnt/β-catenin信号的持续时间,促进了Wnt信号下游靶基因的表达,最终提高了结直肠癌细胞的干细胞样特性,比如提高了CD44和DCLK1的表达水平,以及结直肠癌细胞的成球能力[14]。miR-146a通过靶向NUMB内吞衔接蛋白(Numb)使β-catenin蛋白保持稳定,提高了Wnt信号的活性,从而增加了CCSCs的对称分裂,扩大了CSCs池、增加了CCSCs的致瘤能力和耐药性[15]。
一些miRNAs通过抑制Wnt/β-catenin信号通路的激活负调控结直肠癌细胞的干性。在Wnt 3'非翻译区有miR-34a的潜在结合位点,miR-34a可能通过降低Wnt/β-catenin信号来抑制氟尿嘧啶耐药的结肠癌细胞的成球能力[16]。有研究发现catenin δ-1是细胞内β-catenin转位调节剂P21活化激酶4(p21 activated kinase 4,PAK4)的结合伙伴,PAK4的核积累可以促进β-catenin的核输入和β-catenin/TCF介导的基因转录[17]。miR-145通过直接靶向 catenin δ-1阻断了Wnt/β-catenin信号激活,导致其转录靶基因c-Myc和CyclinD1的下调,最终抑制了结直肠癌细胞的增殖活性。miR-145还通过下调catenin δ-1和肌成束蛋白1(fascin actin-bundling protein 1,Fascin-1)减弱了结直肠癌细胞的迁移和侵袭活性[18]。有研究表明,泛素特异性肽酶22(ubiquitin specific peptidase 22,USP22)有促进β‐catenin核转位的作用[19]。miR-30-5p 通过靶向USP22,下调 Wnt/β‐catenin信号,抑制结直肠癌细胞的干性和化疗耐药[20]。在结肠癌细胞中过表达miR-451会导致结直肠癌细胞的干细胞标记物(SOX-2和OCT-4)和上皮间质转化(epithelialmesenchymal transition,EMT)标记物Snail的表达以及肿瘤细胞的成球能力下降[21]。COX-2可通过抑制β-catenin的降解来激活Wnt信号[22]。在结肠癌干细胞球体中miR-451通过抑制巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)间接调控COX-2,进而影响βcatenin水平,从而抑制CCSCs,导致结肠癌干细胞的自我更新能力、致瘤性和对伊立替康的化疗耐药性下降[23]。此外,miR-200家族成员miR-141通过下调β-catenin的表达来抑制Wnt/β-catenin信号,降低了结直肠癌细胞的成球能力和化疗耐药[24]。
2.miRNAs调控CCSCs的Notch信号通路
Notch信号在肠道干细胞的自我更新和谱系分化的选择方面发挥重要作用[25-26]。与肠道干细胞一样,CCSCs也需要Notch信号进行自我更新。miR-34a调控Notch1的表达,使其在结肠癌干细胞分裂产生的子细胞中呈两种区别明显的表达水平,以此决定子细胞的命运:如果Notch的活性水平低于阈值,子细胞将分化为非CSCs,否则将仍为CSCs。并且高水平的miR-34a通过抑制Notch信号减少了结肠癌干细胞对称分裂的比例,促进其分化,抑制其自我更新的能力[27]。免疫球蛋白kappa J区重组信号结合蛋白(recombination signal binding protein for immunoglobulin kappa J region,RBPJ)是一种能在Notch信号通路中介导转录调节的蛋白。在依赖RBPJ的Notch信号中,RBPJ可以结合Notch胞内域来激活下游基因的转录,从而调节细胞命运和凋亡等过程。miR-195-5p通过抑制Notch2和RBPJ来抑制结直肠癌细胞的干性[28]。TRF/miR-1280是一个既来自亮氨酸tRNA(tRNALeu)又来自miRNA前体(PremiRNA)的17bp片段,通过直接靶向经典的锯齿状Notch配体2(jagged canonical Notch ligand 2,JAG2)来抑制Notch信号的活性,降低结直肠癌细胞中干细胞的比例,成球、致瘤能力以及EMT。
3.miRNAs调控CCSCs的JAK/STAT信号通路
JAK/STAT信号通路在肿瘤的增殖、化疗耐药和转移中都发挥着关键作用[29-30]。在JAK/STAT信号通路中,与白细胞介素-6/10、干扰素(IFN)等多种配体结合后,JAK被激活;活化的JAK与细胞因子受体结合,使受体上的酪氨酸残基磷酸化,进而将STAT重新招募到细胞因子受体上,使STAT被JAK磷酸化;磷酸化的STAT从受体中释放出来,形成同源或异源二聚体,并转移到细胞核中调控靶基因的转录[31]。JAK/STAT的激活受到细胞因子信号转导抑制因子(suppressor of cytokine signaling,SOCS)等负调控因子的严格调控。miR-196b-5p通过靶向SOCS1和SOCS3,引起STAT3信号通路的激活,从而促进结直肠癌细胞的干性,例如增加结直肠癌细胞球体形成能力、SP细胞比例、干细胞因子表达以及对氟尿嘧啶的耐受[32]。
4.miRNAs调控CCSCs的PI3K/AKT信号通路
磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)是PI3K/AKT信号通路的负调控因子,通过诱导细胞周期停滞和细胞凋亡,参与细胞对电离辐射的复杂反应[33],也与肿瘤的耐药相关[34]。有研究表明,PTEN是miR-106b作用的直接靶点。miR-106b通过直接下调PTEN,激活了PTEN下游的PI3K/AKT通路,从而促进了结直肠癌细胞对电离辐射的抗性,提高了肿瘤细胞的克隆成球能力和CD133、Sox2的表达,增加了结直肠癌细胞的干性[35]。此外,miR-21也可以通过抑制PTEN的表达来激活AKT信号,来提高结直肠癌细胞的耐药等特性[36]。
5.miRNAs调控CCSCs的TGF-β/Smad通路
TGF-β信号在CSCs生物学行为调控中发挥重要作用。在CD133+CCSCs中TGFBR1和TGFBR3的表达较高,CD133+CCSCs对TGF-β的敏感性增强[37]。TGF-β通路的激活参与调控CSCs的EMT[38]。miR-4666-3p可以靶向TGF-βR1,阻断TGF-β1/Smad1通路的激活,从而抑制结肠癌干细胞的干性,比如致瘤能力和干性基因的表达下降。此外,TGF-β1是miR-329的靶基因,miR-329和miR-4666-3p一起协同阻断TGF-β1/Smad通路的激活,来抑制结肠癌干细胞的干性[39]。
6.miRNAs调控CCSCs转录因子和其他基因的表达
miRNAs通过调控一些关键转录因子和基因调控CCSCs的干细胞样特性(见图2)。婆罗双树样基因4(spalt like transcription factor 4,SALL4)是SALL基因家族的成员之一,参与维持胚胎干细胞的多能性[40]。miR-3622a-3p通过靶向SALL4降低了Wnt/β-catenin信号活性,抑制了结直肠癌细胞的干性、EMT和体内的转移[41]。GATA结合蛋白6(GATA binding protein 6,GATA6)是一种在结肠干细胞扩增以及调节人结直肠癌细胞的干性方面发挥重要作用的转录因子[42]。miR‐203通过直接抑制GATA6的表达来抑制人结肠癌细胞自我更新等干细胞特性[43]。Kruppel样因子5(Kruppel like factor 5,KLF5)是一种转录因子,可以通过促进β-catenin核定位来增强Wnt/β-catenin通路的活性[44]。miR-4711-5p通过靶向KLF5抑制结直肠癌细胞的增殖、成球能力以及干细胞标志物的表达[45]。八聚体结合转录因子4(Octamer-binding transcription factor 4,Oct-4)是POU转录因子家族中的一员,miR-20b-5p通过靶向Oct-4降低了结直肠癌细胞中CD133+CD44+干细胞亚群的比例,抑制了结直肠癌细胞的致瘤能力[46]。B细胞特异性小鼠白血病病毒插入位点1(B-cell-specific moloney murine leukemia virus insection site 1,Bmi-1)是一种参与CSCs相关特性维持的干细胞因子[47]。在结直肠癌中,miR-215、miR-200c都可以通过下调BMI1的表达,促进结肠癌干细胞的分化,抑制其干性[48-49]。转录因子SOX2(sex determining region Y-box 2)是最初用于诱导成纤维细胞成为多能干细胞的关键转录因子之一。SOX2在肿瘤发生和干细胞维持中扮演多种角色[50]。miR-200c通过靶向SOX2抑制结直肠癌细胞CD133和CD44的表达、体内的致瘤和转移[51]。miR-371-5p和miR-450b-5p也通过下调SOX2抑制CCSCs的干性[52-53]。细胞周期蛋白D2(cyclin D2)被认为是人类胚胎干细胞自我更新的重要调节因子[54]。miR-141通过靶向参与细胞周期调控的cyclin D2来抑制大肠癌细胞的增殖,提高了化疗的敏感性,并促进CSCs的分化[55]。miR-451通过靶向ATP结合盒B亚家族成员1(ATP binding cassette subfamily B member 1,ABCB1)降低CCSCs对伊立替康的抗性[23]。ATP结合盒跨膜转运蛋白G超家族成员2(ATP binding cassette subfamily G member 2,ABCG2)作为一种外源性转运蛋白,可能在多药耐药中发挥重要作用;基质金属蛋白酶16(MMP16)可以降解Ⅲ型胶原、明胶、纤维连接蛋白和层粘连蛋白-1[56]。miR-328过表达通过直接靶向ABCG2和MMP16,降低了结直肠癌细胞中SP细胞的比例,以及耐药和侵袭能力[57]。ALDH1是一种解毒酶,保护CSCs免受各种有害醛和活性氧的伤害,也是肿瘤干细胞的生物标志物[58]。miR-125a/b可抑制ALDH1A3的表达,进而增加结直肠肿瘤干细胞的凋亡,逆转紫杉醇耐药细胞系对紫杉醇的耐受,抑制其致瘤能力[59]。表1列出了miRNAs通过抑制其他与肿瘤干细胞生物学行为相关基因的表达来调控CCSCs的干性,在此不作赘述。

图2 miRNAs调控干性
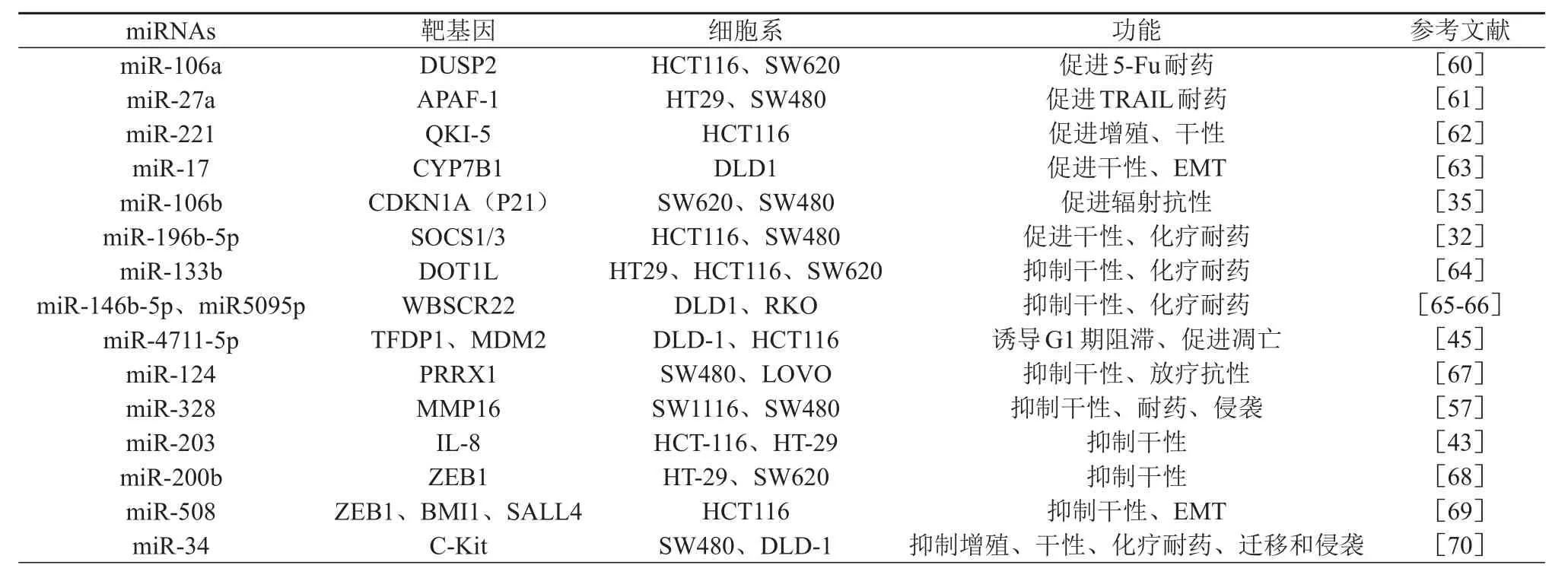
表1 miRNAs调控干性
四、miRNAs在结直肠癌诊治中的应用前景
miRNAs可以作为结直肠癌患者诊断、判断预后和治疗反应的生物标志物。结直肠癌的早期诊断可以增加早期干预的机会,提高总体生存率。肿瘤细胞将胞内miRNAs释放到血液中,称为循环miRNAs。这些分子可以通过与特定的蛋白复合物和囊泡结合来保护其免受不利理化因素的影响。通过血液检测循环中miRNA可用于结直肠癌的早期筛查[71]。近年来,研究者发现一些miRNAs与结直肠癌的化疗耐药和复发密切相关[72-73]。因此,可以将miRNAs作为预测治疗反应和复发的生物标志物。针对miRNAs调控CSCs的干性这一特点,将miRNAs或miRNAs抑制剂导入CSCs内靶向杀灭CSCs可干扰肿瘤的生长、复发和耐药,改善转移性结直肠癌患者治疗效果。但局限的是一些CSCs标志物,如CD44和CD133,也在正常的干细胞和祖细胞中表达[74]。开发针对CCSCs上特定抗原的抗体,将抗体连接到携带各种治疗分子(miRNAs或miRNAs抑制剂)的脂质体上,可能是靶向CCSCs的一种潜在手段[75],这样可以避免对正常干细胞的误伤。纳米颗粒与特异性抗体的组合可能会成为一种新的靶向治疗方式。
综上所述,miRNAs在CCSCs的生物学行为中发挥着重要的调控作用。miRNAs通过调控各个信号通路的相关分子、多能干细胞因子或其他与CCSCs生物学特性和行为相关的基因的表达,来影响CCSCs的自我更新、增殖、分化、转移和对放化疗的抗性等生物学行为。miRNAs拥有广阔的临床应用前景,不仅可以作为结直肠癌患者诊断、判断预后和治疗反应以及复发的生物标志物,还可能成为肿瘤精准治疗的靶点,为靶向杀灭CSCs提供了新的可能。进一部挖掘与CCSCs特性相关的关键miRNAs及其调控机制,将为未来肿瘤的靶向治疗提供更多的借鉴和参考。
