不同品系昆虫病原线虫对蜂巢小甲虫的致病力研究
2021-07-20韩文素王泽如刘宇高景林赵冬香钟义海赵珊
韩文素 王泽如 刘宇 高景林 赵冬香 钟义海 赵珊

摘 要:为明确市售昆虫病原线虫制剂对蜂巢小甲虫(Aethina tumida)幼虫和蛹的致病力,为该害虫的防治提供新的技术措施,室内采用浸渍法、土壤法测定了5种不同品系昆虫病原线虫对蜂巢小甲虫末龄老熟幼虫和蛹的致病力,采用土壤法测定了小卷蛾斯氏线虫(Steinernema carpocapsae All)不同施用时间、不同施用剂量对蜂巢小甲虫幼虫致病力的影响。浸渍法生物测定结果表明,5種不同品系昆虫病原线虫对蜂巢小甲虫幼虫的致病力差异很大,其中小卷蛾斯氏线虫All侵染4 d、12 d后,蜂巢小甲虫幼虫的校正死亡率分别为67.50%±0.05%和72.36%±3.14%,均显著高于其他品系。土壤法生物测定结果表明,昆虫病原线虫对蜂巢小甲虫幼虫具有明显的致死作用,其中小卷蛾斯氏线虫All对蜂巢小甲虫幼虫的侵染效果达100%,显著高于其他线虫品系。蜂巢小甲虫幼虫入土后,按不同时间顺序施用小卷蛾斯氏线虫All,结果表明14 d前施用均能取得良好的防治效果。侵染期线虫小卷蛾斯氏线虫All与蜂巢小甲虫幼虫数量之比大于213∶1时,防治效果最佳。因此小卷蛾斯氏线虫All具有防治蜂巢小甲虫的潜力,可在发生蜂巢小甲虫危害的蜂场推荐使用。
关键词:昆虫病原线虫;小卷蛾斯氏线虫;蜂巢小甲虫;致病力;生物测定
中图分类号:S476.15;S895 文献标识码:A
Abstract: This study aims to evaluate the pathogenicity of commercially available entomopathogenic nematodes against Aethina tumida larvae and pupa, thus develop a new agricultural method to control A. tumida beetle. The pathogenicity of 5 strains of entomopathogenic nematodes (EPNs) against wandering larvae and pupae of A. tumida were determined by the dipping and sand bioassays in the laboratory, respectively. In addition, the influence of different application time and dosage on the virulence of Steinernema carpocapsae All to A. tumida larvae was tested by sand bioassays under laboratory condition. The dipping bioassay results showed that the pathogenicity of 5 EPNs strains against A. tumida larvae was different under laboratory condition. The infection incubation of S. carpocapsae All against A. tumida larvae was the highest. The corrected mortality rate of A. tumida larvae infected by S. carpocapsae All were 67.50%±0.05% and 2.36%±3.14% after 4 d and 12 d, respectively, which was higher than that of other EPNs. The sand bioassay result demonstrated a significant treatment effect on A. tumida mortality when compared to the control. The S. carpocapsae All provided excellent control with 100% mortality of A. tumida larvae being obtained, which showed significantly higher mortality than A. tumida larvae exposed to any other nematode strains. Sequential applications of the nematodes following larvae entering sand also provided excellent control before 14 d application. The optimal control effect would be achieved when the ratio of S. carpocapsae All to A. tumida was more than 213∶1. So entomopathogenic nematodes S. carpocapsae All has a potential to control A. tumida larvae and pupae, it could be recommended for use in apiary where A. tumida occurred.
Keywords: entomopathogenic nematodes; Steinernema carpocapsae; Aethina tumida; pathogenicity; bioassay
DOI: 10.3969/j.issn.1000-2561.2021.05.028
蜂巢小甲虫(Aethina tumida Murray)属鞘翅目露尾甲科,也译为蜂箱小甲虫,是源于撒哈拉以南非洲地区土著蜜蜂和其他社会性蜂群的一种寄生虫和食腐动物[1]。在当地,它们危害性极小。但是蜂巢小甲虫入侵美国和澳大利亚后,给当地养蜂业造成了巨大的经济损失[1-3],被认为是造成蜂群崩溃失调病(colony collapse disorder)的因素之一[4]。当前蜂巢小甲虫分布于除南极洲以外的所有大陆[5-8]。据报道,2017年我国广东省汕尾新田镇蜂群首次发现蜂巢小甲虫的危害[9],2018年在海南省昌江县、白沙县、琼中县蜂场发现危害,造成当地蜂群损毁[10],因此对于蜂巢小甲虫的防治刻不容缓。
蜂巢小甲虫成虫在蜂巢内产卵,卵孵化为幼虫后取食蜂箱内的蜂蜜、花粉、蜜蜂幼虫,常常破坏掉整个蜂巢,发育到老熟阶段(wandering larvae),便离开蜂巢到附近的土壤里化蛹[8]。蛹期的发育时间可根据外界的环境温度而发生变化,如在温度为20~30 ℃的范围内,蜂巢小甲虫在土壤内的时间为18~84 d[11]。蜂巢小甲虫在低温条件下发育缓慢[12]。老熟幼虫和蛹均藏身于土壤内,此阶段是防治蜂巢小甲虫切断其生活史的最好时机。据报道,国外的蜂农使用杀虫剂如苄氯菊酯(permethrin)控制土壤里蜂巢小甲虫幼虫和蛹[13],但长期使用杀虫剂易使害虫产生抗药性,同时对蜜蜂等昆虫和人类健康会造成危害。因此筛选安全、高效、可持续性的防治方法对蜂巢小甲虫的防控是非常重要的。
昆虫病原线虫(entomopathogenic nematodes, EPNs)是一类专门寄生昆虫的有益线虫,是20世纪初发展起来的很有潜能的生物防治因子,不污染环境,对人畜等脊椎动物安全。用于农林害虫防治的昆虫寄生线虫主要分布于斯氏属(Steinernema)和异小杆属(Heterorhabditis)。侵染期线虫利用昆虫体表的自然开口(肛门、气门)、节间膜或伤口侵入寄主体内,穿过肠壁或气管壁进入寄主血腔,释放携带的共生细菌,共生细菌在害虫的体腔内迅速繁殖,分泌杀虫毒素蛋白抑制寄主免疫反应,从而致使寄主死亡[14-16]。EPNs可以在侵染的寄主体内循环繁殖,直至线虫密度大和营养匮乏时重新回到土壤中寻找新的寄主,因此EPNs可在土壤中存活很长时间[17]。EPNs能主动搜索寄主,对地下害虫特效[18],但昆虫病原线虫对地下害虫的防治效果受线虫种类和品系及害虫种类的影响[19]。国外已有利用昆虫病原线虫防治蜂巢小甲虫的报道[20-21],但不同品系对蜂巢小甲虫的防治效果差异很大。我国昆虫病原线虫资源丰富,有很多品系已经商品化,海南气候独特,非常有必要筛选益于当地使用的线虫品系。因此本研究室内测定了已经商业化生产的小卷蛾斯氏线虫(Steinernema carpocapsae All)等5种不同品系昆虫病原线虫对蜂巢小甲虫的侵染力,以期为制定蜂巢小甲虫有效的防治措施提供科学的理论依据。
1 材料与方法
1.1 材料
蜂巢小甲虫(Aethina tumida):2019年5月23日,在海南省琼中县中华蜜蜂养蜂场中采集的蜂巢小甲虫幼虫,带回中国热带农业科学院环境与植物保护研究所蜜蜂与传粉昆虫实验室的隔离养虫室内饲养。饲养方法参照Neumann等[22]的方法,蜂巢小甲虫成虫用蜂蜜饲喂,幼虫用蜂粮(含蜂蜜、花粉、蛋白质)饲喂。饲养条件为:温度28 ℃,相对湿度80%,未成熟幼虫,黑暗无光照约2周;老熟即将化蛹的幼虫,自然光照14 h,持续1周,以便老熟幼虫离开食物入土化蛹,随后无光持续约20 d;蛹羽化为成虫出土后,取食,交配,产卵,自然光照14 h。选择发育整齐的末龄幼虫(wandering larvae)备用。
供试线虫:小卷蛾斯氏线虫(S. carpocapsae All,简称All)、长尾斯氏线虫(S. Longicaudum X-7,简称X-7)、芫菁夜蛾斯氏线虫(S. Feltiae SF-SN,简称SN)有2种剂型,粉剂由潍坊宏润农业科技有限公司提供;芫菁夜蛾斯氏线虫(S. Feltiae JY-90,简称JY-90)和All、X-7、SN海绵吸附剂型由浙江绿神天敌生物技术有限公司提供。印度异小杆线虫(Heterorhabditis indian LN2,简称LN2)剂型为海绵吸附剂型,由浙江绿神天敌生物技术有限公司提供。试验前将线虫置于8 ℃冰箱冷藏备用。
1.2 方法
1.2.1 不同昆虫病原线虫直接暴露和间接暴露对蜂巢小甲虫的致病力测定 试验1:直接暴露—浸渍法。参照Cuthbertson等[20]的方法,略有改动。具体步骤如下:将粉剂或海绵吸附剂线虫用蒸馏水溶解,并用解剖显微镜评估1 mL线虫悬浮液中存活的线虫数量。然后根据厂家推荐,配置约10 000 IJs/mL的线虫悬浮液(感染期虫态infective juveniles,IJS),将单个蜂巢小甲虫末龄老熟幼虫浸入到含线虫的悬浮液中,轻轻晃动2~3 s,将试虫取出放于含有蒸馏水浸湿的滤纸上,并置于直径6 cm的培养皿中。每个处理设置10次重复,每个重复10头供试幼虫,以不含线虫的蒸馏水设为对照,将各处理放入温度为28 ℃,相对湿度为70%,光照为16L∶8D的暗室中。在处理后4 d、12 d记录幼虫的死亡情况。判断试虫死亡标准:用毛笔尖轻触虫体,5 s内虫体不动即视为死亡。同时将死亡幼虫浸入1%氯化鉀溶液,在超景深三维显微系统(基恩士,KEYENCE)下进行观察并拍照,确认昆虫病原线虫的侵染情况。
试验2:间接暴露—土壤法。将蜂场带回的沙质土壤在烘箱内烘干,装入7 cm×15 cm(直径×高)的塑料杯,每杯装500 g。配置10 000 IJs/mL的各品系线虫悬浮液,将50 mL悬浮液均匀倒进塑料杯的土壤表面(土壤湿度10%),待溶液渗透到土壤中,即放入蜂巢小甲虫末龄老熟幼虫10头。待幼虫完全钻入土壤,用封口膜(扎孔)封住塑料杯,放于试验1相同的环境中。1个品系为1个处理,每个处理10杯(即每个处理10次重复),每杯10头幼虫,以蒸馏水为对照。为了满足蜂巢小甲虫羽化为成虫的时间,各处理将持续存放6周。4周后每天观察蜂巢小甲虫成虫的羽化情况并记录。将没有羽化为成虫的数量视为死亡数量,以此计算死亡率。
1.2.2 昆虫病原线虫不同施用时间对土壤内蜂巢小甲虫的致病力测定 选用1.2.1中高致病力线虫品系为研究对象,测定其不同施用时间对土壤内蜂巢小甲虫幼虫或蛹的致病力。线虫浓度和塑料杯大小同1.2.1。同一时间将10头末龄老熟幼虫放入装有土壤的塑料杯内,杯内加适量水,待幼虫完全钻入土壤内,用封口膜封住杯口,放于与1.2.1相同的试验环境中。实验设计4个处理时间,每个处理时间间隔1周,每个处理设10次重复(10杯),同一时间以蒸馏水处理为对照。末龄老熟幼虫入土24 h后首次将配置好的昆虫病原线虫悬浮液40 mL均匀倒入塑料杯内土壤。从幼虫入土时间算起,每处理4周后每天观察成虫出土情况,记录羽化成虫数量。每处理持续存放6周,将没有羽化为成虫的数量视为死亡数量,以此计算死亡率。
1.2.3 线虫不同剂量对土壤内蜂巢小甲虫致病力的测定 选用1.2.1中高致病力昆虫病原线虫,测定其不同剂量对蜂巢小甲虫末龄老熟幼虫的致病力。用蒸馏水将昆虫病原线虫稀释为0、425、850、1700、3500、5000、10 000 IJs/mL的悬浮液。在5 cm×7.5 cm(直径×高)的塑料杯内装入湿度约8%的土壤(高温烘干)150 g,然后放入8头末龄老熟幼虫。每杯加入1 mL线虫悬浮液,相当于每个处理的线虫剂量为0、53、106、213、438、625、1250 IJs/头甲虫幼虫。实验设6个浓度,每个浓度为1个处理,每个处理重复5次(5杯)。每隔4~5 d塑料杯内加适量水,以保持合适的土壤湿度。4周后每天观察记录蜂巢小甲虫成虫羽化情况。将未羽化的数量视为死亡数量,以此计算死亡率。其他试验条件同1.2.1。
1.3 数据处理
利用SPSS Base Ver. 19.0软件统计分析不同处理之间的差异显著性,采用Tukeys HSD test进行多重比较,采用独立样本t检测进行两组间的差异比较,采用GraphPad Prism 5软件制图。试验所得数据采用以下公式计算:
死亡率=死亡虫数/供试总虫数×100%。
校正死亡率=[(处理死亡率-对照死亡率)/(1-对照死亡率)]×100%。
2 结果与分析
2.1 不同品系昆虫病原线虫对蜂巢小甲虫致病力的影响
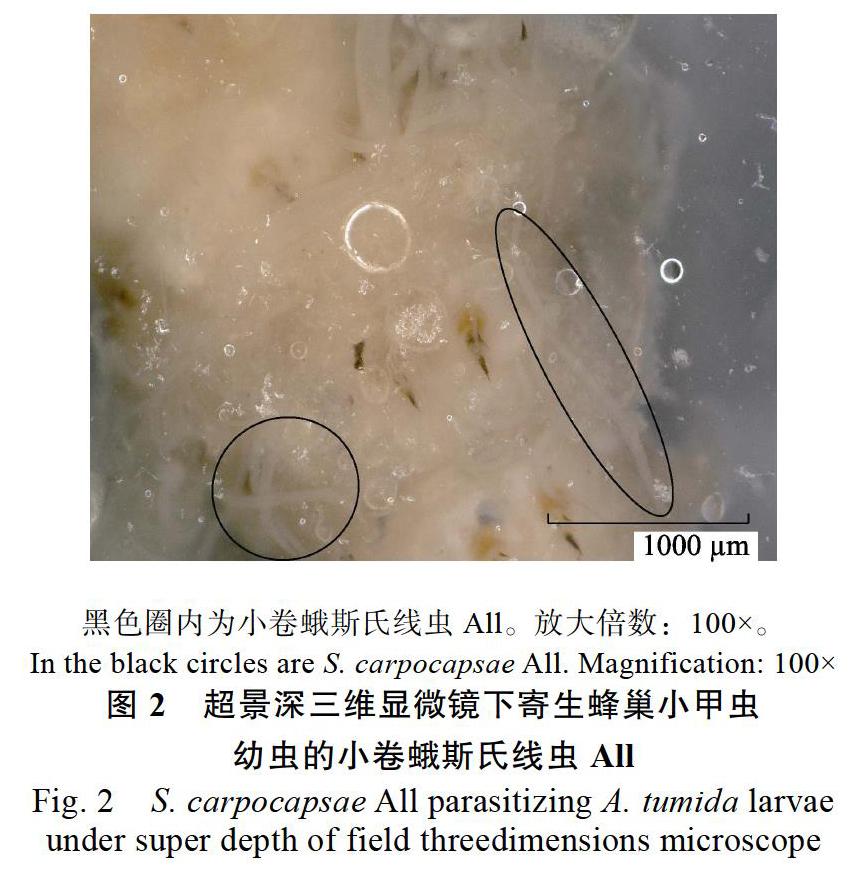
不同品系昆虫病原线虫直接暴露对蜂巢小甲虫末龄老熟幼虫的致病力如图1所示。小卷蛾斯氏线虫All海绵吸附剂侵染蜂巢小甲虫幼虫4 d和12 d后,蜂巢小甲虫幼虫的校正死亡率分别为72.00%±0.05%和78.00%±4.67%,小卷蛾斯氏线虫All粉剂侵染蜂巢小甲虫幼虫4 d和12 d后,蜂巢小甲虫幼虫的校正死亡率分别为67.50%± 0.05%和72.36%±3.14%。小卷蛾斯氏线虫All 2种剂型间差异不显著性,而均显著高于对照和其他线虫品系(4 d: df=6, 63, F=123.145, P<0.001; 12 d: df=6, 63, F=151.628, P<0.001)。将蜂巢小甲虫幼虫浸于1%氯化钾溶液内,超景深三维显微镜下可观察到小卷蛾斯氏线虫All存在于蜂巢小甲虫幼虫的体腔、脂肪等组织内(图2)。显微镜下还可观察到存活的小卷蛾斯氏线虫All主动从蜂巢小甲虫幼虫游向1%氯化钾溶液。因此证实小卷蛾斯氏线虫All即使短暂接触蜂巢小甲虫幼虫2~3 s也具备侵染能力。芫菁夜蛾斯氏线虫SN、长尾斯氏线虫X-7、芫菁夜蛾斯氏线虫JY-90和印度异小杆线虫LN2侵染造成蜂巢小甲虫幼虫的校正死亡率仅为0%~(8.00±2.91)%,与对照间差异不显著,尤其是芫菁夜蛾斯氏线虫JY-90几乎不能侵染蜂巢小甲虫幼虫。因此这几种线虫短暂暴露不具备侵染蜂巢小甲虫幼虫的潜力。
通过土壤法测定不同品系昆虫病原线虫对蜂All:小卷蛾斯氏线虫All海绵吸附剂;All(P):小卷蛾斯氏线虫All粉剂;SN(P):芫菁夜蛾斯氏线虫SN粉剂;X-7(P):长尾斯氏线虫X-7粉剂;JY-90:芫菁夜蛾斯氏线虫JY-90海绵吸附剂;LN2:印度异小杆线虫LN2海绵吸附剂。
巢小甲虫末龄老熟幼虫的致病力如图3所示。此方法可以更好地模拟蜂农防治蜂场土壤内蜂巢小甲虫末龄老熟幼虫或蛹的状况。不同品系昆虫病原线虫施入土壤6周后,蜂巢小甲虫幼虫的校正死亡率均显著高于对照(df=6, 63, F=47.713, P<0.001)。小卷蛾斯氏线虫All 2种剂型对蜂巢小甲虫幼虫的侵染效果几乎达到100%,显著高于其他线虫品系,2种剂型间差异不显著。在处理后2周,显微镜下可以观察到塑料杯封口膜扎孔处有聚集的昆虫病原线虫。芫菁夜蛾斯氏线虫SN、长尾斯氏线虫X-7、芫菁夜蛾斯氏线虫JY-90和印度异小杆线虫LN2处理土壤后6周,蜂巢小甲虫幼虫的校正死亡率达(62.83±6.93)%~(78.61± 5.66)%。
2.2 小卷蛾斯氏线虫All不同施用时间对蜂巢小甲虫致病力的影响
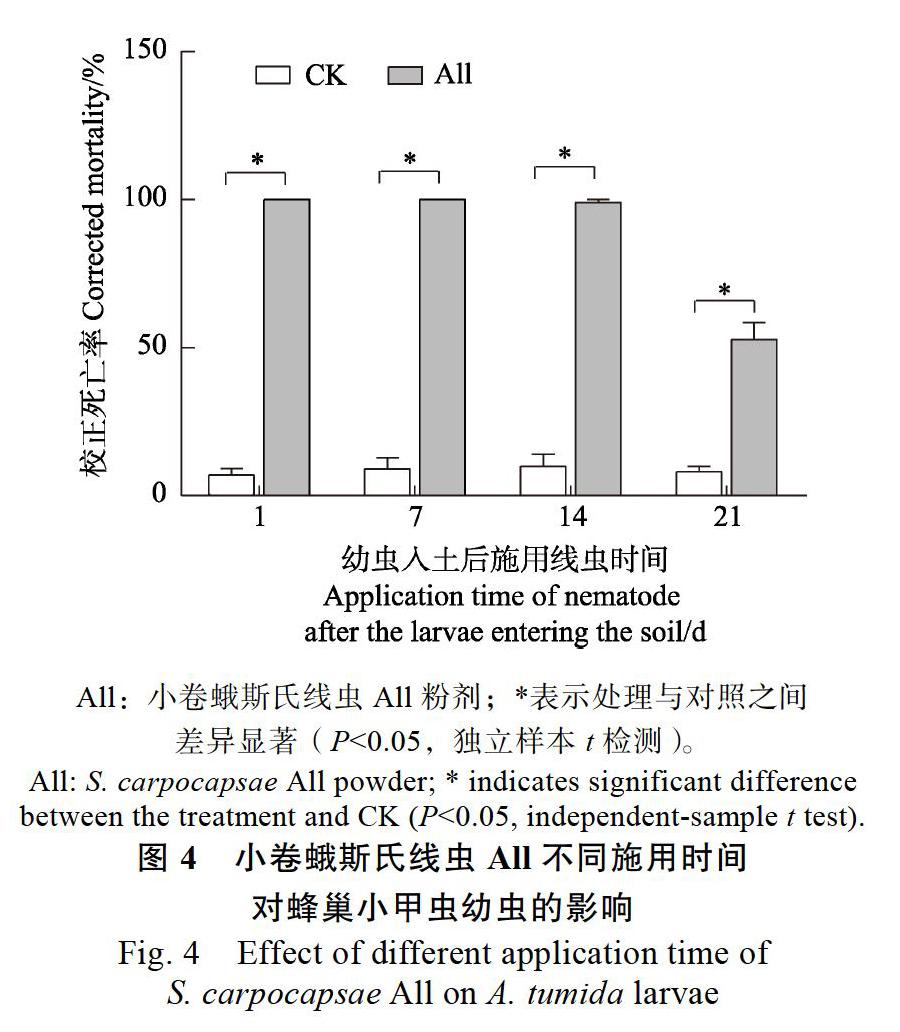
小卷蛾斯氏线虫All粉剂不同施用时间对土壤内蜂巢小甲虫幼虫或蛹均具有良好的防效,处理组的蜂巢小甲虫校正死亡率显著高于对照组(P<0.001)。幼虫入土1、7 d后施用小卷蛾斯氏线虫All,无蜂巢小甲虫成虫羽化,蜂巢小甲虫幼虫校正死亡率达100%;幼虫入土14、21 d后,此時已在土壤内化蛹,施用小卷蛾斯氏线虫All,蜂巢小甲虫蛹的校正死亡率分别为99.00%±1%、52.72%±5.74%(图4)。
2.3 小卷蛾斯氏线虫All不同剂量对蜂巢小甲虫致病力的影响
蜂巢小甲虫幼虫死亡率随线虫剂量的增加而显著升高(df=6, 28, F=73.867, P<0.001)(图5)。当线虫与蜂巢小甲虫幼虫的数量比为53∶1和106∶1时,蜂巢小甲虫幼虫的死亡率分别为55.00%±6.37%和62.50%±3.95%;而线虫与蜂巢小甲虫幼虫的数量比超过625∶1时,蜂∶巢小甲虫幼虫全部死亡,未出现羽化的成虫。因此,利用小卷蛾斯氏线虫All防治土壤中蜂巢小甲虫幼虫的推荐浓度为≥3500 IJs/mL。
试验线虫为小卷蛾斯氏线虫All粉剂;不同小写字母表示处理间差异显著(Tukeys HSD检测,P<0.05)。
3 讨论
昆虫病原线虫喜潮湿隐蔽环境,适于防治土栖害虫[23],但不同品系昆虫病原线虫对同一害虫的防治效果不同[24]。蜂巢小甲虫是近两年入侵我国的蜂群害虫,急需有效的绿色防控手段。国内商业化生产的小卷蛾斯氏线虫All、长尾斯氏线虫X-7、芫菁夜蛾斯氏线虫SN/ JY-90、印度异小杆线虫LN2可有效防治小地老虎(Agrotis ypsilon)、韭菜迟眼蕈蚊(Bradysia odoriphaga)、暗黑鳃金龟(Holotrichia parallela)、黄曲条跳甲(Phyllotreta striolata)等农业害虫[19, 25-27],而国内利用昆虫病原线虫对蜂巢小甲虫的防治研究尚无报道。本研究结果表明,5种不同品系昆虫病原线虫对蜂巢小甲虫幼虫的侵染力差别很大,其中小卷蛾斯氏线虫All的致病力最高。此研究结果与Cuthbertson等[20]的研究结果相似,其使用的小卷蛾斯氏线虫品系S. carpocapsae (Capsanem)对蜂巢小甲虫的致死率高于S. kraussei和S. feltiae品系;而Ellis等[21]筛选了7个种、10个品系昆虫病原线虫对蜂巢小甲虫幼虫的致病力,結果表明S. riobrave和H. indica对蜂巢小甲虫幼虫的致病力最高。据Ebssa等[28]报道,昆虫病原线虫的致病力受昆虫病原线虫种类、寄主龄期和评估时间的影响。一般而言,增加昆虫病原线虫的数量和延长暴露时间均能提高不同龄期寄主的死亡率。本研究供试的蜂巢小甲虫幼虫均为即将化蛹的老熟幼虫,直接暴露相同浓度的昆虫病原线虫2~3 s,仅小卷蛾斯氏线虫All成功附着蜂巢小甲虫幼虫体表并进入其体内,使67.50%~78.00%的幼虫死亡;间接暴露相同浓度的昆虫病原线虫6周,5种昆虫病原线虫侵染蜂巢小甲虫幼虫使其死亡率达62.83%~100.00%,均显著高于对照,因此本研究表明延长暴露时间会不同程度地提高昆虫病原线虫的致病力。
寄主蛹期是昆虫病原线虫最不敏感的阶段。已有研究表明,小卷蛾斯氏线虫S. carpocapsae 1、S. carpocapsae All对小地老虎的蛹无侵染能力[25],S. carpocapsae有些品系对小地老虎的侵染致死率不及50%[28]。蜂巢小甲虫在土壤里的化蛹阶段是对其进行防治的最佳时期,此阶段蜂巢小甲虫离开蜂箱,不会对蜜蜂产生负面影响。本研究结果表明,小卷蛾斯氏线虫All能有效防控蜂巢小甲虫蛹,在蜂巢小甲虫幼虫入土14 d和21 d后(已化蛹),施用小卷蛾斯氏线虫All后蜂巢小甲虫死亡率分别达99.00%±1%和100.00%。Ellis等[21]研究表明,蜂巢小甲虫蛹对昆虫病原线虫敏感,线虫S. riobrave 7-12和H. indica品系对蜂巢小甲虫蛹的致死率大于76%。已知侵染期线虫刺入寄主并在其体内取食/繁殖约14 d后,新的侵染期线虫从寄主体内爬出开始寻找新的寄主[29],因此可利用线虫持续防控不断入土化蛹的蜂巢小甲虫老熟幼虫和蛹。
昆虫病原线虫的施用剂量是影响防治效果的一个重要因素。一般而言,提高线虫的施用剂量会提高寄主的死亡率,但也会增加使用成本。本研究结果表明,小卷蛾斯氏线虫All与蜂巢小甲虫幼虫的数量比超过213∶1时,其侵染力无显著性差异,致使约100%的蜂巢小甲虫幼虫死亡。因小卷蛾斯氏线虫对渗透压、干燥、低温、缺氧、高温和紫外线辐射有较强的耐受性,国内生产厂家可以采用体外培养体系批量生产[30]。结合复杂的蜂场环境以及本研究结果,按厂家的推荐剂量(10 000 IJs/mL)施用可以有效防治土壤中的蜂巢小甲虫。
在生产实践中,剂型影响线虫存活的保质期。本研究中侵染蜂巢小甲虫的优势线虫小卷蛾斯氏线虫All粉剂和海绵吸附剂2种剂型,均在冰箱冷藏1周,试验前解剖显微镜下观察到线虫存活状况较为一致。直接暴露(浸渍法)和间接暴露(土壤法)测定结果表明,2种剂型对蜂巢小甲虫的防治效果无显著性差异,因此生产实践中均可使用。
参考文献
[1] Neumann P, Elzen PJ. The biology of the small hive beetle (Aethina tumida, Coleoptera: Nitidulidae): Gaps in our knowledge of an invasive species[J]. Apidologie, 2004, 35(3): 229-247.
[2] Spiewok S, Duncan M, Spooner-Hart R, et al. Small hive beetle, Aethina tumida, populations II: Dispersal of small hive beetles[J]. Apidologie, 2008, 39(6): 683-693.
[3] Torto B, Fombong AT, Arbogast RT, et al. Monitoring Aethina tumida (Coleoptera: Nitidulidae) with baited bottom board traps: Occurrence and seasonal abundance in honey bee colonies in Kenya[J]. Environmental Entomology, 2010, 39(6): 1731-1736.
[4] Muerrle T M, Neumann P, Dames J F, et al. Susceptibility of adult Aethina tumida (Coleoptera: Nitidulidae) to entomopathogenic fungi[J]. Journal of Economic Entomology, 2006, 99(1): 1-6.
[5] Toufailia H A, Alves D A, Bená D C, et al. First record of small hive beetle, Aethina tumida Murray, in South Ameri-ca[J]. Journal of Apicultural Research, 2017, 56(1): 76-80.
[6] Calderón R A, Ramírez M. New record of the small hive beetle, Aethina tumida, in africanized honey bee colonies in Costa Rica[J]. Bee World, 2019, 96(3): 87-89.
[7] Muli E, Kilonzo J, Sookar P. Small hive beetle infestations in Apis mellifera unicolor colonies in Mauritius Island, Mauritius[J]. Bee World, 2018, 95(2): 44-45.
[8] Neumann P, Pettis J S, Sch?fer M O. Quo vadis Aethina tumida? Biology and control of small hive beetles[J]. Api-dologie, 2016, 47(3): 427-466.
[9] 趙红霞, 王华堂, 侯春生, 等. 入侵中国的蜂箱小甲虫鉴定及发生为害调查[J]. 中国蜂业, 2018, 69(11): 29-31.
[10] 钟义海, 韩文素, 赵冬香, 等. 蜂巢小甲虫传入中国的风险评估[J]. 植物检疫, 2020, 34(2): 47-51.
[11] Cuthbertson A G S, Mathers J J, Blackburn L F, et al. Main-taining Aethina tumida (Coleoptera: Nitidulidae) under qua-rantine laboratory conditions in the UK and preliminary ob-servations on its behaviour. Journal of Apicultural Re-search and Bee World, 2008, 47(1): 192-193.
[12] Guzman L I d, Frake A M. Temperature affects Aethina tumida (Coleoptera: Nitidulidae) development[J]. Journal of Apicultural Research, 2007, 46(2): 88-93.
[13] Hood, W M. The small hive beetle, Aethina tumida: A re-view[J]. Bee World, 2004, 85(3): 51-59.
[14] Boemare N E, Akhurst R J, Mourant R G. DNA relatedness between Xenorhabdus spp. (Enterobacteriaceae), symbiotic bacteria of entomopathogenic nematodes, and a proposal to transfer Xenorhabdus luminescens to a new genus, Photor-habdus gen. nov[J]. International Journal of Systematic Bacteriology, 1993, 43(2): 249-255.
[15] Glazer I, Salame L, Goldenberg S, et al. Susceptibility of sap beetles (Coleoptera: Nitidulidae) to entomopathogenic nematodes[J]. Biocontrol Science and Technology, 1999, 9(2): 259-266.
[16] 李星月, 李其勇, 符慧娟, 等. 新型生防因子——昆虫病原线虫的研究进展[J]. 四川农业科技, 2019(1): 37-39.
[17] Tomalak M. Infectivity of entomopathogenic nematodes to soil-dwelling developmental stages of the tree leaf beetles Altica quercetorum and Agelastica alni[J]. Entomologia Ex-perimentalis et Applicata, 2004, 110(2): 125-133.
[18] Georgis R, Koppenh?fer A M, Lacey L A, et al. Successes and failures in the use of parasitic nematodes for pest con-trol[J]. Biological Control, 2006, 38(1): 103-123.
[19] 颜 珣, 郭文秀, 赵国玉, 等. 昆虫病原线虫防治地下害虫的研究进展[J]. 环境昆虫学报, 2014, 36(6): 1018-1024.
[20] Cuthbertson A G S, Mathers J J, Blackburn L F, et al. Screening commercially available entomopathogenic bio-control agents for the control of Aethina tumida (Coleoptera: Nitidulidae) in the UK[J]. Insects, 2012, 3(3): 719-726.
[21] Ellis J D, Spiewok S, Delaplane K S, et al. Susceptibility of Aethina tumida (Coleoptera: Nitidulidae) larvae and pupae to entomopathogenic nematodes[J]. Journal of Economic Entomology, 2010, 103(1): 1-9.
[22] Neumann P, Evans J D, Pettis J S, et al. Standard methods for small hive beetle research[J]. Journal of Apicultural Re-search, 2013, 52(4): 1-32.
[23] 刘奇志, 赵映霞, 严毓骅, 等. 我国昆虫病原线虫生物防治应用研究进展[J]. 中国农业大学学报, 2002, 7(5): 65-69.
[24] Georgisi R, Gaugler R. Predictability in biological control using entomopathogenic nematodes[J]. Journal of Economic Entomology, 1991, 84(3): 713-720.
[25] 李 根, 许文君, 王新中, 等. 不同品系昆虫病原线虫对烟草小地老虎的致病力[J]. 环境昆虫学报, 2017, 39(5): 1025-1031.
[26] 武海斌, 范 昆, 辛 力, 等. 昆虫病原线虫对小地老虎的致病力测定及防治效果[J]. 植物保护学报, 2015, 42(2): 244-250.
[27] 武海斌, 凌 飛, 宫庆涛, 等. 噻虫嗪对昆虫病原线虫侵染韭菜迟眼蕈蚊能力的影响[J]. 应用昆虫学报, 2016, 53(6): 1233-1241.
[28] Ebssa L, Koppenh?fer A M. Entomopathogenic nematodes for the management of Agrotis ipsilon: Effect of instar, ne-matode species and nematode production method[J]. Pest Management Science, 2012, 68(6): 947-957.
[29] Shapiro-Ilan D I, Gaugler R, Tedders W L, et al. Optimiza-tion of inoculation for in vivo production of entomopatho-genic nematodes[J]. Journal of Nematology, 2002, 34(4): 343-350.
[30] Yan X, Arain M S, Lin Y, et al. Efficacy of entomopatho-genic nematodes against the tobacco cutworm, Spodoptera litura (Lepidoptera: Noctuidae)[J]. Journal of Economic Entomology, 2020, 113(1): 64-72.
责任编辑:谢龙莲
