PD-1抑制剂在中高危弥漫大B细胞淋巴瘤维持治疗的临床观察
2021-07-20韦丽娅刘玄勇张弋慧智李旭绵王月乔陈丽娜
韦丽娅 郭 智 刘玄勇 陈 晓 张弋慧智 李旭绵 王月乔 谢 晶 陈丽娜
弥漫大B细胞淋巴瘤(DLBCL)是非霍奇金淋巴瘤(NHL)中最常见的病理类型[1-2]。尽管利妥昔单抗联合CHOP类化疗方案极大地提高了DLBCL患者的疗效,但仍有相当一部分患者复发或治疗失败,而一旦复发或失败,挽救性治疗效果较差[3]。近年来,免疫治疗特别是PD-1免疫检查点抑制剂,已被NCCN指南应用于经典型霍奇金淋巴瘤、纵隔大B淋巴瘤和结外NK/T细胞淋巴瘤的二线治疗[4],临床上已经开展应用PD-1抑制剂治疗难治复发性弥漫大B细胞淋巴瘤的临床试验[5],但对获得完全缓解(CR)的DLBCL患者能否提高生存率的研究很少,我们对15例初治中高危IPI评分≥3的DLBCL化疗结束后达到CR的患者进行维持治疗,探索PD-1抑制剂在中高危DLBCL患者的疗效和安全性。
1 资料与方法
1.1 临床资料
回顾性分析2019年1月至2020年1月在我院血液肿瘤科15例既往经过6~8个疗程R-CHOP方案化疗后达到CR的中高危DLBCL患者作为研究对象,开始进行PD-1抑制剂维持治疗,选择同期15例中高危DLBCL患者经过6~8个疗程R-CHOP方案缓解后不接受PD-1抑制剂维持治疗的设为对照。所有患者经我院病理科病理组织活检及免疫组织化学染色确诊为DLBCL淋巴瘤,临床分期采用AnnArbor分期。在初始治疗前,所有患者进行常规血液检测,包括血常规、血液生化和血清肿瘤标志物水平,以及增强CT或PET-CT检查,以全面评估病情并获得基线信息。定期复查患者血液学指标,包括血常规、生化等,采用增强CT或PET-CT检查评价患者的疗效,并详细记录治疗过程中出现的不良反应。
1.2 研究分组
在全部30例患者化疗结束后按其是否序贯使用PD-1抑制剂维持治疗,分为维持治疗组(n=15)和未维持组(n=15)。维持治疗组患者予PD-1抑制剂单药静点维持治疗,未维持治疗组患者予以定期随访观察。在维持治疗组中,15例患者中男性10例(67%),女性5例(33%),中位年龄45岁(31~64)岁。在未维持组中,15例患者中男性6例(40%),女性9例(60%),中位年龄48岁(32~64)。患者临床特征详见表1。维持治疗组患者接受化疗的中位治疗周期是6个周期,初始治疗结束后有1例患者(7%)接受了放射治疗,无患者接受自体造血干细胞移植。在未维持组中,患者既往接受化疗的中位治疗周期是6个周期,初始治疗结束后有4例患者(27%)接受了放射治疗,1例患者接受了自体造血干细胞移植。
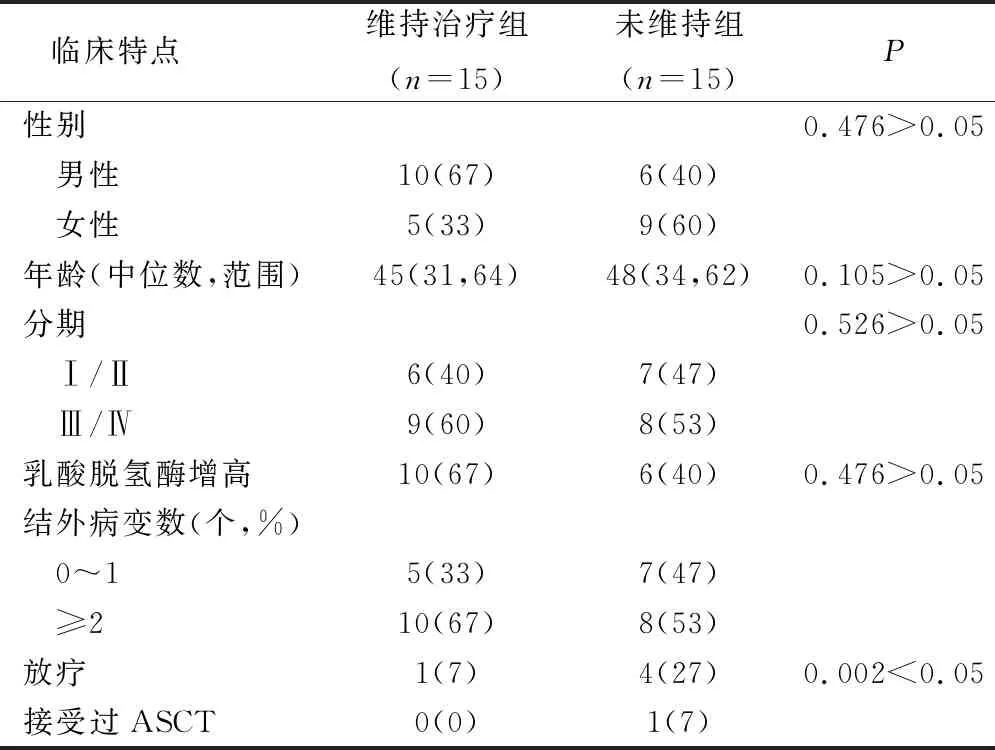
表1 30例DLBCL患者的一般资料(例,%)
1.3 治疗方案
化疗阶段两组患者均接受6-8个疗程的R-CHOP方案(每3周)。具体如下:利妥昔单抗375 mg/m2,第0天。CHOP:环磷酰胺(CTX)750 mg/m2,阿霉素(ADM)50 mg/m2或多柔比星脂质体30 mg/m2,长春新碱(VCR)1.4 mg/m2,第1天。泼尼松(PDN)60 mg/m2,第1~5天。维持治疗方案如下:PD-1抑制剂(信迪利单抗)200 mg每3~4周一次,在化疗结束4~8周开始,至少完成4个周期以上。
1.4 疗效判定及随访
疗效评价采用1999年版国际工作组(IWG)疗效评价指南联合PET/CT检查。治疗终点按照WHO疗效评价标准进行判定,包括CR、部分缓解(PR),疾病稳定(SD)和疾病进展(PD),远期疗效评价选用无病生存期(DFS)。药物不良反应(AEs)根据世界卫生组织常见不良反应事件评价标准4.0(CTCAE)的通用术语标准评价不良反应,分为Ⅰ~Ⅳ级。两组患者维持治疗结束后每3个月随访1次,随访时间至少半年以前,随访截止日期为2020年9月,中位随访时间为12个月(7~15个月),通过门诊复查及电话联系进行随访。
1.5 统计学方法
应用SPSS 25.0软件对数据进行统计学处理。两组间比较采用两独立样本的t检验;采用Kaplan-Meier法绘制生存曲线,以P<0.05为差异有统计学意义。
2 结果
2.1 疗效
全组30例患者均有随访资料且均可评价疗效。截至2020年9月,15例患者共完成124个疗程,中位疗程8个,有5例(33.3%)完成12个疗程,3例(20%)完成8个疗程,6例(40%)完成6个疗程,1例(6.7%)完成4个疗程后复发,终止PD-1抑制剂维持治疗后进行二线化疗。接受PD-1抑制剂的维持治疗组的15例患者,14例(93%)CR,1例(7%)PD;未维持组的15例患者,9例(60%)CR,6例(40%)PD。维持治疗组的疗效明显优于未维持组,两者间的疗效差异具有统计学意义(P=0.002<0.05)。
2.2 生存分析
截至随访结束,30例患者中无失访患者,均存活。截止随访日期,维持治疗组和未维持组的中位DFS均未达到。维持治疗组12个月的DFS为93%,未维持组12个月的DFS为60%,两组DFS率比较差异有统计学意义(P=0.034<0.05),见图1。
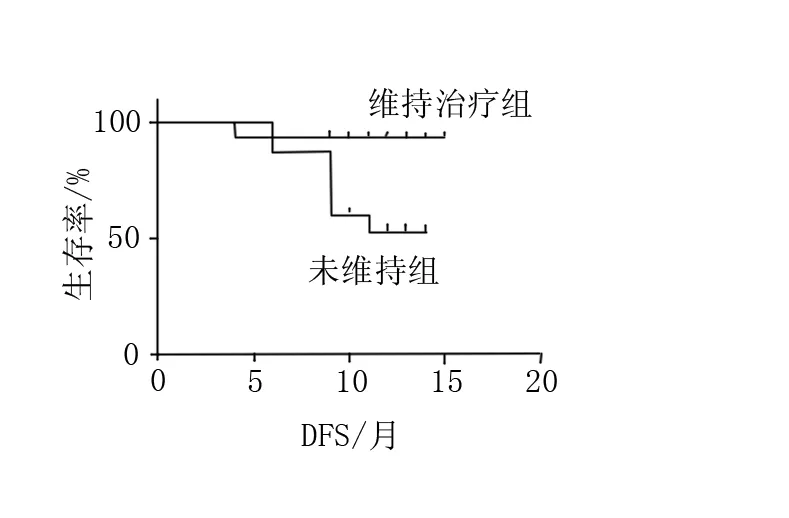
图1 维持治疗组患者和未维持组患者的DFS曲线图
2.3 不良反应
由于未维持组随访期间不良反应少,故未对其进行分析,本研究只对维持治疗组的不良反应进行了分析。维持治疗组所有患者均可评价不良反应。接受PD-1抑制剂维持治疗组的15例患者治疗期间均未发生严重不良反应,不良事件为Ⅱ级及以下。治疗相关的不良反应最常见的是发热和甲状腺功能减退,各有2例(13%)患者发生,发热患者经退热治疗后体温降至正常,甲状腺功能减退患者经口服优甲乐后甲功恢复正常。最严重的是肺炎,共有1例(7%)患者,经过抗炎、激素对症治疗后好转。血液学不良反应有:白细胞减少1例(7%),血小板减少1例(7%),经升白细胞、升血小板等对症治疗后好转。其余不良反应有:输液反应1例(7%),皮疹1例(7%),经抗过敏等对症治疗后好转。
3 讨论
近年来,免疫治疗特别是免疫检查点抑制剂(immune checkpoint inhibitor,ICI)的应用,在淋巴瘤的治疗中发挥了重要的作用。程序性死亡受体-1(PD-1)主要表达于激活的T细胞、B细胞、巨噬细胞、调节性T细胞和自然杀伤细胞表面,PD-1与肿瘤细胞表面的程序性死亡配体1(PD-L1)结合以后可以抑制T细胞活化、增殖、诱导免疫耐受[1]。PD-1/ PD-L1通路的异常激活是肿瘤发生免疫逃逸的基本机制之一,PD-1抑制剂可以通过阻断PD-1/ PD-L1通路的异常激活,逆转肿瘤细胞对免疫细胞的免疫抑制,促进T细胞活化和细胞因子产生,从而发生抗肿瘤作用而杀伤肿瘤细胞[2-3]。免疫检查点主要通过调节免疫强度维持机体正常免疫功能。PD-1是研究较多的免疫检查点分子,主要表达在活化T细胞以及其他免疫细胞(B细胞、NK细胞、单核细胞和树突状细胞等)的胞膜上,调节针对感染和恶性肿瘤的免疫应答中起重要作用[4-6]。在急性病毒感染期间,幼稚抗原特异性CD8+T细胞被激活,增殖并分化成效应CD8+T细胞,一旦感染被清除,其中大部分都会发生凋亡,尽管有些变成记忆细胞。然而,在慢性感染中,T细胞失去了效应功能,重要的是,这些耗竭的T细胞过表达PD-1。PD-1与其配体PD-L1结合后,胞质区ITSM结构域中的酪氨酸发生磷酸化,从而抑制T、B细胞增殖,IL-2,IFN-γ等细胞因子的产生,以及免疫球蛋白的分泌,进而抑制自身免疫应答,PD-1抑制剂可以恢复效应功能[7-8]。各种类型的肿瘤使用PD-1来逃避免疫系统,并阻断PD-1和PD-L1之间的相互作用,导致以T细胞依赖性方式降低免疫逃逸,靶向该途径的单克隆抗体已被批准用于治疗多种恶性肿瘤。
弥漫大B细胞淋巴瘤是非霍奇金淋巴瘤的常见亚型,使用标准的一线治疗后大约2/3的患者达到了长期缓解,对化疗敏感的复发患者可行ASCT。但是,难治性DLBCL,不适合进行ASCT或在ASCT后复发的患者的治疗方式有限选择,中位生存期仅6~10个月[9]。进行维持治疗的药物一般是低毒、有效、且能长期给药,而PD-1抑制剂正好符合这些要求。相关研究[10]对121例不适合做ASCT及ASCT失败后复发接受Nivolumab治疗的患者进行了9个月的中位随访,客观缓解率为10%,中位无进展生存期是1.9个月,总生存期是12.2个月。因此,Nivolumab成功运用于ASCT后复发的患者使人们对其能否在DLBCL维持治疗中起效充满期待,目前国外这方面的研究较少。在DLBCL中,在某些明确的大B细胞淋巴瘤(LBCL)亚型中发现了PD-L1表达增加,例如原发性纵隔性大B细胞淋巴瘤和EBV阳性,非生发中心来源的DLBCL。因此,PD-1/ PD-L1途径的阻断可能会在部分亚型中发挥抗肿瘤作用[11]。本研究中维持治疗组12个月的DFS为93%,未维持组12个月的DFS为60%,两组DFS率比较差异有统计学意义(P=0.034<0.05)。本研究结果维持治疗组和未维持组的中位DFS均未达到,其原因可能是随访时间太短,且维持组仅33.3%的患者完成治疗,相信随着入组病例数及完成治疗病例数的增加及随访时间的延长,完全有可能得出既有临床意义又有统计学意义的结果。本研究与文献9相比可发现该研究的几个不同之处:该研究入组的都是不适合做ASCT及ASCT失败后复发的难治复发性DLBCL患者,而本研究是按IPI积分决定是否使用PD-1抑制剂治疗;该研究釆用的是每2周连续给药直至疾病进展的方案,PD-1抑制剂的中位疗程数为4,而本研究釆用的是每3~4周给药1次共12次的方案,PD-1抑制剂的中位疗程数为8。基于上述原因,完全有理由相信本研究的最终结果支持PD-1抑制剂用于中高危的DLBCL患者的维持治疗。
PD-1抑制剂的安全性也是人们关心的问题,有文献报道接近10%的患者在接受PD-1抑制剂治疗之后产生严重的、甚至威胁生命的Ⅲ~Ⅳ级免疫异常不良反应[12]。常见PD-1抑制剂的不良反应有疲劳、发热、寒战、输液反应,器官特异性的不良反应包括皮肤瘙痒、皮疹,结肠炎,免疫性肺炎、肝炎等。本研究中应用PD-1抑制剂治疗的不良反应主要为发热和甲状腺功能减退,最严重的是肺炎,还有白细胞减少,血小板减少,输液反应,皮疹。发热和甲状腺功能减退是PD-1抑制剂最常见的不良事件。本研究中共有2例患者出现Ⅰ~Ⅱ级的发热,通常出现在第一次输注后的24 h内,并在同一天消失,患者后续不需要使用预防性退烧药物,是使用PD-1抑制剂后出现轻度肿瘤溶解综合征的表现。甲状腺功能减退发生率约为20%~30%[13],3~4级甲状腺功能减退较为罕见,本研究中共有2例患者出现Ⅰ~Ⅱ级的,口服优甲乐后恢复正常。治疗相关性肺炎的发生可能与免疫治疗后免疫力下降感染风险增加有关,本研究中共有1例患者发生,对症治疗后消失。需要特别提出的是,最近越来越多的文献中提出治疗相关的致死性的免疫相关性不良反应的报道[14],如致死性心肌炎、肝毒性的发生,虽然本研究中没有致死性的不良反应出现,但是仍认为在今后的治疗中需要加强对免疫相关不良反应的监控和管理[15]。本研究中,PD-1抑制剂单药应用于中高危的DLBCL患者的维持治疗,安全且耐受良好,没有患者因药物不良反应而终止治疗,大多数患者的不良反应是可控的。
本研究回顾性分析接受化疗后完全缓解的30例中高危弥漫大B细胞淋巴瘤,其中15例接受单药PD-1抑制剂维持治疗,15例未进行维持治疗。结果提示,维持治疗组的疗效明显优于未维持组,两者间的疗效差异具有统计学意义(P<0.05)。考虑接受PD-1抑制剂单药维持治疗的患者为对PD-1抑制剂部分敏感的DLBCL患者。本研究未进行PD-L1表达的检测,需进行前瞻性临床研究对其进一步探讨,也未评估DLBCL病理表型双打击或c-Myc阳性与疗效的关联,需进行前瞻性临床研究对其进一步探讨[16]。本研究的样本量和随访时间有限,因此无法进行预测结果的长期性,限制了我们对PD-1抑制剂单药维持治疗中、高危的DLBCL患者安全性和有效性的评估,对本研究患者的持续长期研究将进一步明确PD-1抑制剂的安全性和有效性。同时,本研究只有较少的DLBCL患者在PD-1抑制剂单药维持治疗接受了放疗和ASCT治疗。尽管存在这些局限性,但经过PD-1抑制剂治疗的患者群体12个月DFS超过90%。有文献表明在晚期DLBCL患者中,PD-1抑制剂治疗序贯ASCT可进一步降低复发率,但有可能增强免疫毒性反应,安全性及有效性仍需进一步研究。
综上所述,本研究结果表明PD-1抑制剂维持治疗对R-CHOP化疗后达CR且预后中高危的初治DLBCL患者,能提高其DFS率,不良反应轻微,耐受性良好。由于样本量较小、随访时间较短,明PD-1抑制剂维持治疗DLBCL的治疗价值还有待大样本研究明确。
