胃幽门螺杆菌感染后semaphorin 5A和TGF-β1的表达及其相关性研究
2021-07-20潘国庆
李 庚 何 颖 潘国庆
幽门螺旋杆菌(helicobacter pylori,Hp)感染是我国人群最常见的细菌病原体之一,最新报告显示国人感染率高达55%左右[1]。Hp作为启动子通过胃粘膜定植并形成胃粘膜相关病变,根据Correa级联反应[2],病变逐渐发展为胃癌,这一过程伴随着基因失活与激活机制的改变[3]。近年来,人类对胃癌精准性与靶向治疗的需求与日俱增,而其理论及构想必然基于胃癌相关的基因的研究。基因信号素5A(semaphorin 5A)和转化生长因子β1(TGF-β1)在胃癌及癌前病变中已有多次报道[4-6],然而Hp对semaphorin 5A、TGF-β1的影响尚未完全明确,因此本文就Hp感染状态下的实验动物及人胃腺癌组织中semaphorin 5A和TGF-β1表达情况做一初步研究,为Hp介导胃癌发生、发展机制研究提供一定前期基础。
1 材料与方法
1.1 主要试剂及仪器
小苏打,Giemsa及W-S银染液购于Solarbio公司;一抗semaphorin 5A、TGF-β1及β-actin抗体分别购于美国RD,Abcam,Sigma公司;ABI-7500实时荧光定量PCR仪购于美国ABI公司;试剂盒活性检测购于上海Beyotime生物工程有限公司,Real-time PCR试剂盒购自日本TaKaRa公司;转膜仪及SDS-PAGE电泳设备购于美国Bio-rad公司;PVDF膜、ECL超敏发光液购自德国Merck公司等。
1.2 幽门螺杆菌的培养
于-80 ℃冰箱取出ATCC26695菌株,水浴复苏,种植于含5%无菌脱纤维羊血的哥伦比亚琼脂培养基,放入微需氧培养罐中置于37 ℃培养箱培养。培养基经高压灭菌后自然冷却至50 ℃时添加脱纤维羊血及多粘菌素B,万古霉素,两性霉素,TMP混匀后浇板。将菌落形态的Hp悬浮于PBS中,测定OD660,1OD660=1×108菌落形成单位(CFU)。
1.3 模型鼠制备及分组
30只SPF级SD大鼠,6~ 8周龄,雌雄各半体质量180~ 200 g,由南京医科大学实验动物中心提供(合格证:NO.201917016)。大鼠随机分为对照组、感染组,每组各15只。均在SPF级动物实验室干湿适宜条件下,雌雄分开,分笼饲养。循环昼夜光照间隔12 h切换,室内温度为20 ℃ ~ 24 ℃。感染组大鼠每只用胃管喂以5%NaHCO32ml灌胃,半小时后用Hp培养细菌悬液4 ml进行灌胃(5×108CFU/ml),对照组灌胃等剂量PBS。每周感染大鼠2次,共8次,Hp末次灌胃结束后,分别继续常规饲料饲养3个月。
1.4 标本处理及Hp检测
大鼠麻醉固定后,快速取出全胃,沿胃大弯剪开,用冷生理盐水冲洗后,一分为二,分别于多聚甲醛固定和-80 ℃保存备用待测。分别于最后一次灌胃3月后取材,进行造模成功指标检测。胃黏膜石蜡Giemsa及W-S染色检查检测出Hp,均阳性说明造模成功。
1.5 RT-qPCR法检测组织中semaphorin 5A,TGF-β1的mRNA表达情况
胃组织中总RNA提取及cDNA合成:参照Trizol提取胃组织的总RNA,在nanodrop-2000上测260 nm/280 nm比值达到1.8至2.0后,按逆转录试剂盒操作方法得到cDNA。引物设计结果见表1。实时荧光定量RT-qPCR扩增程序用荧光定量检测试剂盒,在Bio-Rad荧光定量PCR仪上扩增。扩增条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃延伸60 s,40个循环。分析结果,得出各组内参基因和目的基因Ct值,运用2-△△Ct公式计算。

表1 引物序列
1.6 免疫印迹检测组织中semaphorin 5A和TGF-β1的蛋白表达情况
选取Hp感染组及对照组大鼠胃组织加RIPA裂解液冰上裂解,提取组织总蛋白,BCA法测定蛋白浓度。加入样品缓冲液后沸水浴变性,离心后上样,电泳分离,转印,5%脱脂奶粉封闭,加入抗semaphorin 5A、TGF-β1及β-actin抗体后4 ℃过夜。一抗孵育结束后,洗膜,二抗室温孵育1 h,洗膜后入ECL发光,凝胶成像分析曝光数据,上Image-J图像,计算灰度值。
1.7 胃癌标本收集及免疫组织化学检测组织中semaphorin 5A和TGF-β1的蛋白表达情况
收集本院2018至2019年胃癌切除术后诊断为胃腺癌石蜡组织100例,所有患者手术前未经过放化疗并有幽门螺杆菌感染病史。收集的蜡块切片脱蜡至水,EDTA抗原修复,过氧化氢消除内源性酶,分别加入同WB的一抗和二抗,DAB显色,苏木精复染。免疫组化结果判定:通过评分SEMA5A和TGF-β1染色阳性百分率和染色强度来确定表达水平。随机选取组织中3个区域,共300个细胞,计数免疫阳性细胞数,得分为0.1(阳性细胞的 1%~10%),0.2(阳性细胞的 11%~20%),和 0.3(20%~30%的细胞呈阳性),依此类推。此外,强度被指定为弱(1分),中(2 分),强(3 分)或非常强(4分)。通过将阳性细胞的范围乘以强度来计算 IHC 综合评分。
1.8 统计学分析
2 结果
2.1 大鼠 Hp定值及组织HE炎症结果
首先收集感染大鼠胃组织样本,再通过Giemsa染色及W-S银染显示胃粘膜可见Hp定植。镜下Giemsa染色背景为蓝色,Hp为深蓝色杆状。W-S银染背景为棕黄色,Hp呈黑色杆状。随着灌胃时间的延长,胃粘膜表面Hp也逐渐增多。
HE染色显示:感染组大鼠多量胃粘膜上皮脱落及坏死样物,随之感染时间延长,胃黏膜炎症细胞也随之出现,主要为淋巴细胞,部分可达粘膜下层。而对照组镜下未见明显炎症改变。
2.2 Hp感染对大鼠胃黏膜semaphorin 5A,TGF-β1mRNA表达的影响
如图1所示,随着Hp感染3个月后,semaphorin 5A及TGF-β1的mRNA表达水平较对照组表达均有上升(P<0.01),见表2。
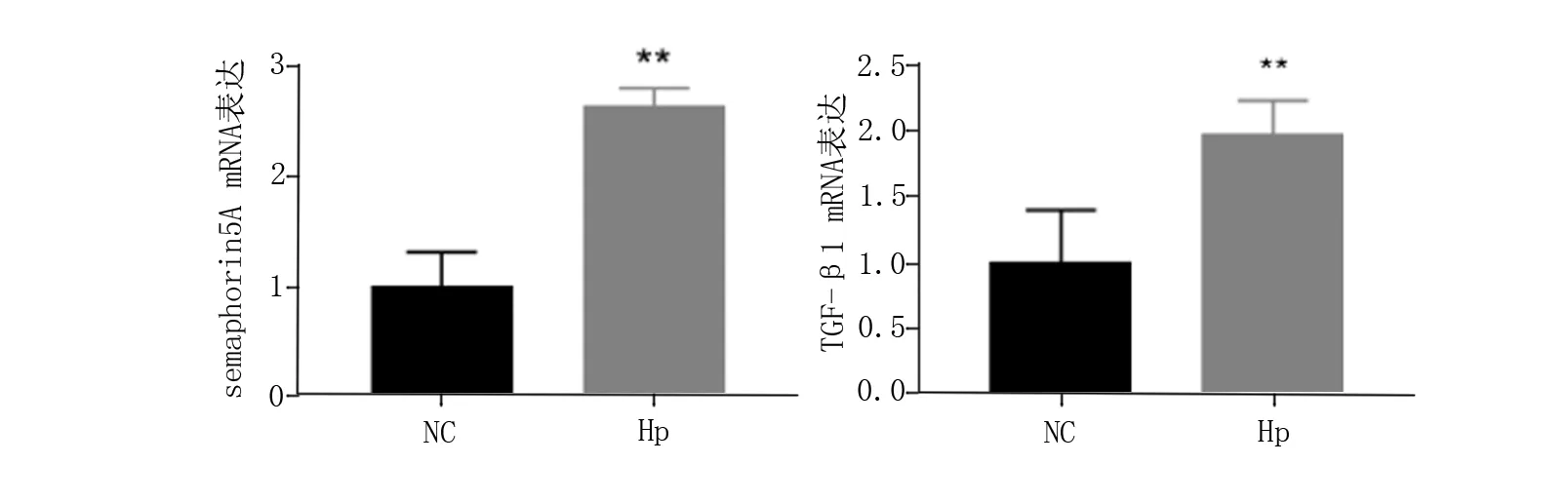
图1 各组胃粘膜中semaphorin 5A,TGF-β1 mRNA表达情况

表2 各组胃组织中semaphorin 5A和TGF-β1 mRNA表达水平比较
2.3 Hp感染对大鼠胃黏膜semaphorin 5A,TGF-β1蛋白表达的影响
WB结果显示和PCR结果一致,即Hp感染后能够明显上调semaphorin 5A、TGF-β1在胃粘膜内的表达。图2的B-C为semaphorin 5A和TGF-β1与β-actin的相对灰度值。

图2 各组胃组织中semaphorin 5A,TGF-β1蛋白表达情况
2.4 Hp感染对人胃腺癌semaphorin 5A,TGF-β1表达的影响
选取100例胃腺癌组织经Giemsa染色结果显示,100例胃癌中有54例为Hp+,46例为Hp-。 Hp阳性的胃腺癌组织,其中放大的癌旁腺体内见Hp;semaphorin 5A和 TGF-β1在Hp阳性胃癌腺体的细胞膜或质中呈强阳性反应;而在Hp阴性胃癌腺体的细胞质中呈中度阳性反应。二种蛋白免疫组化评分在Hp+组均高于Hp-组,P分别为0.002,0.007,均小于0.01。在Hp+后胃腺癌中semaphorin 5A表达与TGF-β1表达呈正相关(γ=0.762,P=0.001),见表3。

表3 Hp+组和Hp-组semaphorin 5A、TGF-β1表达的差异
3 讨论
胃癌的发生是1种多过程、多阶段疾病,幽门螺杆菌作为胃癌I类致癌原,约90%非贲门部胃癌的发生与Hp感染相关。Hp作为诱发胃癌的始动因素,利用毒力因子,通过Ⅳ型分泌系统(T4SS)使其在胃粘膜上皮内粘附引起宿主免疫应答,细胞增殖凋亡失衡,癌基因和抑癌基因的表达改变,最终导致胃癌[7-8]。然而,Hp感染具体调控细胞增殖凋亡失衡的分子机制有待进一步明确。有研究显示,semaphorin 5A与细胞增殖、凋亡过程有关[9]。课题组前期研究发现,Hp感染后的GES-1细胞中,semaphorin 5A表达上调。有趣的是,该研究同时发现,胃癌细胞中,semaphorin 5A亦呈高表达。
Semaphorin 5A,是semaphorins家族5类中的成员。Semaphorins又称为轴突导向分子,即在神经系统发育过程中引导轴突到达靶位点。后来发现其可以调节多种生理过程,包括胚胎心血管发育和免疫系统调节,更为重要的是发现在多种癌症中有异常表达,并且与癌症相关的肿瘤脉管形成和癌细胞转移有很大的关联性[10]。现阶段多项研究表明,semaphorin 5A作为1种胃癌相关基因,能够在胃癌中高表达并且可以调控癌细胞的生物学活性[11-12]。有报道指出semaphorin 5A和TGF-β1在结构上存在相同的结构域TSP-1(血小板反应素)[13],而TSP-1恰恰是活化TGF-β1的关键。在此理论基础上潘[14]利用RNAi技术在胃癌细胞实验上显示semaphorin 5A可以激活TGF-β1,证实TGF-β1为其下游信号分子。
现阶段研究表明TGF-β1在胃癌晚期起促进作用,包括肿瘤新生脉管形成、细胞黏附性降低、免疫抑制等效应[15]。该效应与semaphorin 5A在肿瘤中的生物学功能具有高度一致性。在本次实验中,我们也发现Hp感染后TGF-β1的表达量明显上升,具有统计学意义,与其他同类型的Hp相关性实验相一致。如马等[16]通过观察临床患者外周血清显示慢性活动性胃炎伴Hp阳性患者、TGF-β1水平高于阴性对照组,胃粘膜严重程度同样升高。柳等[17]研究也显示TGF-β1蛋白在Hp+胃癌石蜡标本中表达量更高。据此,我们推测,Hp感染后TGF-β1作为semaphorin 5A下游信号分子影响胃癌发病过程。
基于以上假设,我们参照史等[18]的方法构建体内动物模型,经检测,模型符合洛桑会议幽门螺杆菌感染标准[19]。进一步结果显示,随着Hp感染时间的延长,semaphorin 5A表达量要显著高于对照组(P<0.01),胃癌石蜡样本中同样Hp+组要显著高于对照组(P<0.01),提示Hp能够引起上调胃粘膜semaphorin 5A表达。这与先前我们在胃癌前病变,包括人GES-1细胞与Hp共培养的体外实验均证明Hp感染能够上调semaphorin 5A表达量相一致[5,20]。通过观察动物实验时间节点发现semaphorin 5A与TGF-β1表达量与Hp感染呈正相关,随着时间延长炎症严重程度也在加重,也符合Hp感染相关性胃炎的病理生理学改变。同时,本实验分析胃癌组织在蛋白水平的semaphorin 5A与TGF-β1表达的相关性发现,semaphorin 5A与TGF-β1呈正相关,提示Hp可能协同semaphorin 5A与TGF-β1在胃癌中进程发展,进一步证实了我们假设。
当然,本研究中仍然存在诸多不足。首先,由于时间限制,我们的动物模型尚未出现癌前病变的特征性表现;其次TGF-β1表达的上调是由于Hp感染直接引起,还是由于semaphorin 5A的表达升高,进而激活相关信号通路间接引起,还有待进一步探讨;最后,Hp感染后引起semaphorin 5A/TGF-β1信号轴的下游分子通路有待进一步明确。
综上所述,我们使用在时间点(3月)获得Hp感染大鼠模型,并分析得出semaphorin 5A和TGF-β1在大鼠及人Hp相关性胃粘膜病变中的表达上调,且在胃癌组织两者表达具有正相关性。可进一步证实Hp诱导胃粘膜相关病变的发生,其机制可能与Hp激活semaphorin 5A/ TGF-β1信号通路有关。据此,我们可以初步认为,Hp感染可能通过semaphorin 5A/TGF-β1信号轴介导胃癌发生。
