脂肪乳剂通过激活自噬流解救布比卡因心肌毒性
2021-07-20林婷婷施克俭金周晟张裕坚夏芳芳刘乐
林婷婷,施克俭,金周晟,张裕坚,夏芳芳,刘乐
温州医科大学附属第一医院 麻醉科,浙江 温州 325015
布比卡因是一种长效酰胺类局麻药,因起效较快、作用时间长、麻醉效能较强等优点被广泛应用于临床,但若误入血管可诱发严重的心脏毒性,甚至心脏停搏。1998年WEINBERG等[1]发现脂肪乳剂可增加布比卡因的毒性阈值,随后大量文献都证实了脂肪乳剂可解救布比卡因心肌毒性[2-3],但其机制仍不完全清楚。近几年来,局麻药和自噬的关系陆续被报道:丁卡因可造成Vero肾细胞自噬体的累积和溶酶体损伤[4],布比卡因可抑制C2c12成肌细胞自噬流造成大量自噬体堆积[5],而XIONG等[6]发现局麻药可增加人成神经细胞瘤SH-SY5Y细胞自噬体清除。但布比卡因是否通过调控自噬造成心肌毒性,脂肪乳剂是否通过调控自噬来解救布比卡因心肌毒性均鲜见报道。因此本研究通过建立布比卡因心肌毒性模型,用脂肪乳剂进行处理,检测心肌细胞损伤及自噬水平,探讨自噬在脂肪乳剂解救布比卡因心肌毒性中的作用。
1 材料和方法
1.1 材料 H9C2心肌细胞株购自上海中科院细胞库。布比卡因(美国Sigma公司,B5274-5G),20%脂肪乳剂Intralipid(华瑞制药有限公司,80EL046),胎牛血清(美国Gibco公司,10099-141),DMEM培养基(美国Gibco公司,C11995500BT),CCK8细胞增殖毒性检测试剂盒(日本DOJINDO公司,CK04),mRFP-GFPLC3双标腺病毒(上海汉恒生物科技有限公司,HBAP2100001),BCA蛋白浓度测定试剂盒(美国Thermo公司,23227),微管相关蛋白1轻链3(microtubule- associated protein 1 light chain 3,LC3)抗体(美国Novus公司,NB100-2220SS),p62抗体(英国Abcam公司,ab109012),反转录cDNA合成试剂盒(美国Thermo公司,K1622),GAPDH、MAP1LC3、p62引物(上海生工生物工程股份有限公司),SYBR PCR试剂盒(日本Takara公司,RR820A)。
1.2 方法
1.2.1 细胞培养:大鼠心肌H9C2细胞用含5%胎牛血清的DMEM培养基,37 ℃、5% CO2细胞培养箱(美国Thermo公司)中培养。当细胞生长面积达到90%左右,PBS清洗培养瓶,0.25%胰蛋白酶消化细胞,离心弃去消化液后用培养基重悬,吹打,制成单细胞悬液。细胞悬液按1:4传代,取100 μL、2 mL或者3 mL接种于96孔、6孔板或培养瓶中。
1.2.2 实验分组:用DMSO将布比卡因粉末配成 200 mmol/L的溶液作为存储液,-20 ℃分装保存,在使用时用培养基稀释成1 mmol/L终浓度。20%的脂肪乳剂Intralipid在使用时用培养基稀释成1%的终浓度。H9C2心肌细胞置于37 ℃、5% CO2培养箱中培养至对数生长期,换成无血清培养基饥饿8~ 10 h后随机分成空白溶剂组(DMSO组)、1 mmol/L 布比卡因组(Bup组)、1%脂肪乳剂组(Lip组)、1 mmol/L布比卡因联用1%脂肪乳剂组(BLp组),各组用相应药物处理24 h。本实验布比卡因及脂肪乳剂的选用剂量及处理时间参考团队前期研究结果[3]。
1.2.3 CCK8检测细胞增殖抑制率:将细胞培养至对数生长期后用胰蛋白酶消化,离心重悬计数后,分别取100 μL至96孔板使其细胞数为5×103个/孔,每组设3个复孔,以100 μL无细胞的培养基做空白对照,待细胞长至70%左右按照实验分组进行药物处理,结束后弃去培养基,用PBS 100 μL/孔清洗;按1:10体积比混合CCK8和无血清培养基DMEM,每孔100 μL加入待测孔中,37 ℃,5% CO2孵育4 h;用酶标仪(美国Molecular Devices公司,Plus384)测定450 nm波长吸光度。记录每块板的酶标仪OD值。根据说明书公式计算细胞增殖抑制率。
1.2.4 光镜下观察H9C2心肌细胞形态:药物处理结束后将各组培养瓶放置光学显微镜(日本Olymous公司,BX51)下观察,在40、100、200三个倍数下拍照保存图片。
1.2.5 电镜下观察H9C2心肌细胞自噬情况:药物处理结束后,用细胞刮轻轻刮取细胞移到1.5 mL离心管,低速离心5 min,弃上清液,PBS清洗,离心成团,加入新鲜2.5%戊二醛固定液,4 ℃过夜。取出固定液中心肌细胞,随后用1%锇酸固定1 h,缓冲液洗脱残余锇酸后,1%醋酸铀块染2 h,通过乙醇梯度脱水,纯丙酮深度脱水2次,各10 min;包埋液:丙酮=1:1混合后37 ℃烘箱2 h,然后包埋液:丙酮=4:1 37 ℃烘箱过夜。第2天准备好标签,标记好组织名称、编号。取出样品转移到另一新的 0.5 mL离心管中,加入纯包埋液同时将标签纸贴壁放入离心管中,45 ℃烘箱3 h,65 ℃烘箱48 h。干燥后制作半薄切片和超薄切片,经醋酸铀-枸橼酸铅复染后在透射电镜下观察。
1.2.6 mRFP-GFP-LC3双标腺病毒检测自噬流:将细胞状态良好的H9C2心肌细胞铺在激光共聚焦显微镜专用培养皿中,细胞密度为1×105个/mL。贴壁24 h后,加入感染复数(multiplicity of infection,MOI)=300左右剂量的mRFP-GFP-LC3转染H9C2心肌细胞,细胞放入培养箱孵化6 h后更换成新鲜培养基。转染12 h后按照实验分组进行药物处理,结束后弃掉培养基加入5%的多聚甲醛固定10~15 min,之后DAPI染色5~10 min于激光共聚焦显微镜(德国徕卡公司,TCSSP8X)下观察拍照。RFP用于标记及追踪LC3,GFP在溶酶体酸性环境下容易淬灭,因此,GFP指示的绿色荧光斑点是自噬体,RFP指示的红色荧光斑点是自噬体及自噬溶酶体,两者合并呈现黄色荧光斑点(即GFP+/RFP+-LC3)表示自噬体,而红色荧光斑点(即GFP-/RFP+-LC3)指自噬溶酶体。
1.2.7 Western blot检测LC3II/I和p62蛋白相对表达量:药物处理结束后,弃去培养基,加入4 ℃预冷PBS清洗,培养细胞总蛋白提取剂及蛋白酶抑制剂(PMSF)(100:1配制)提取蛋白,用BCA法测定蛋白浓度并配置上样蛋白。SDS-PAGE电泳将目的蛋白转移至PVDF膜。用含5%脱脂奶粉的TBST室温下封闭1 h,之后用兔抗GAPDH(1:1 000)、兔抗LC3(1:1 000)、兔抗p62(1:1 000)等一抗4 ℃水平摇床孵育过夜,次日加入山羊抗兔IgG(H+L)HRP(1: 5 000)室温孵1 h,后加入ECL发光液,用凝胶成像仪(美国Bio-Rad公司)自动显影读取条带灰度值,以GAPDH为内参,计算目的蛋白条带灰度值与内参条带灰度值的比值。最后组间数据比较时,以DMSO组为对照组,计算其他组与DMSO组的相对值。
1.2.8 RT-PCR检测MAP1LC3 mRNA和P62 mRNA的表达:药物处理结束后,TRIzol法提取总RNA,用酶标仪测定RNA的浓度和纯度,A260 nm/A280 nm比值为1.8~2.0则认为RNA纯度合格。使用反转录cDNA合成试剂盒将RNA合成cDNA,管家基因GAPDH的上游引 物序列为5’-GACATGCCGCCTGGAGAAAC-3’,下游引物序列为5’-AGCCCAGGATGCCCTTTAGT-3’,MAP1LC3的上游引物序列为5’-CCTTCTTCCTGCTGGTGAAC-3’,下游引物序列为5’-CCGTCTTCATCCTTCTCCTG-3’;P62的上游引物序列为5’-CAAGATGGAGCCGGAGAATA-3’,下游引物序列为5’-CATGGCGTGAGTGAAGGAC-3’。以上述合成的cDNA为模板,按照SYBR PCR试剂盒说明书配制PCR反应体系,将上述反应体系置Bio-Rad荧光定量PCR检测系统,95 ℃变性30 s,95℃ 5 s,60℃ 30 s,共40个循环,熔解曲线为65~95℃,每5 s增加0.5℃。所有目的基因阈值与内参相比较,计算2-ΔΔCT表示基因相对表达量。
1.3 统计学处理方法 应用SPSS22.0软件进行统计分析。计量资料用±s表示,多组比较采用单因素方差分析,组间两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 四组H9C2心肌细胞增殖抑制率比较 DMSO组、Bup组、Lip组、BLp组细胞增殖抑制率分别为0.05±0.04、52.17±5.02,4.34±3.14,16.92± 3.09。与DMSO组比较,Bup组及BLp组的细胞增殖抑制率均显著增高(P<0.05);与Bup组比较,Lip组及BLp组的细胞增殖抑制率均显著下降(P<0.05);与Lip组比较,BLp组的细胞增殖抑制率显著增高(P< 0.05)。
2.2 四组H9C2心肌细胞光镜下形态比较 DMSO组细胞形态长梭型,细胞界限清楚,胞浆无杂质,细胞核清楚;Bup组死亡细胞较多,细胞形态不规则,胞浆杂质多,看不清细胞核;Lip细胞状态与DMSO组类似;BLp组与Bup组比较,漂浮死亡细胞大大减少,细胞界限清楚,胞浆清晰,胞核清楚。见图1。
2.3 四组H9C2心肌细胞电镜下自噬现象 电镜下DMSO组未见明显自噬现象,Bup组可见自噬体堆积,未见自噬溶酶体;Lip组的自噬溶酶体较Bup组多,自噬体较少;BLp组的自噬溶酶体较Bup组多,但比Lip组少。见图2。
2.4 mRFP-GFP-LC3双标腺病毒检测自噬流 Bup组出现自噬体堆积,却未见自噬溶酶体;Lip组主要是自噬溶酶体,自噬体较少;相比较于Bup组,BLp组自噬体减少,但自噬溶酶体较多。见图3。
2.5 四组H9C2心肌细胞LC3II/I、p62蛋白表达情况 与DMSO组比较,Bup组及BLp组LC3II/I蛋白表达均显著增高(P<0.05);与Bup组比较,Lip组及BLp组均显著下降(P<0.05)。与DMSO组比较,Bup组及BLp组p62蛋白表达均显著增高(P<0.05);与Bup组比较,Lip组及BLp组均显著下降(P<0.05);与Lip组比较,BLp组显著增高(P<0.05)。见表1。2.6 四组H9C2心肌细胞MAP1LC3和p62 mRNA表达情况 与DMSO组比较,Bup组、Lip组及BLp组MAP1LC3 mRNA表达均显著增高(P<0.05);与Bup组比较,Lip组及BLp组均显著下降(P<0.05)。与DMSO组比较,Bup组p62 mRNA表达显著增高(P<0.05);与Bup组比较,Lip组及BLp组均显著下降(P<0.05);与Lip组比较,BLp组显著增高(P<0.05)。见表1。
3 讨论
本研究参照团队前期研究方法[3]建立布比卡因心肌毒性模型,用脂肪乳剂进行处理,用CCK8法检测细胞增殖抑制率及光镜下观察细胞形态损伤,结果发现,布比卡因处理后细胞增殖抑制率显著升高,光镜下漂浮死亡细胞较多,细胞形态不规则,胞浆杂质多,看不清细胞核,而用脂肪乳剂处理后细胞增殖抑制率显著下降,漂浮死亡细胞大大减少,细胞界限清楚,胞浆清晰,胞核清楚,说明脂肪乳剂解救布比卡因心肌毒性模型制备成功。

图1 光镜下四组H9C2心肌细胞形态比较
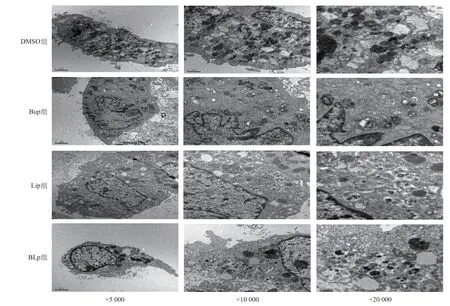
图2 电镜下四组H9C2心肌细胞自噬现象
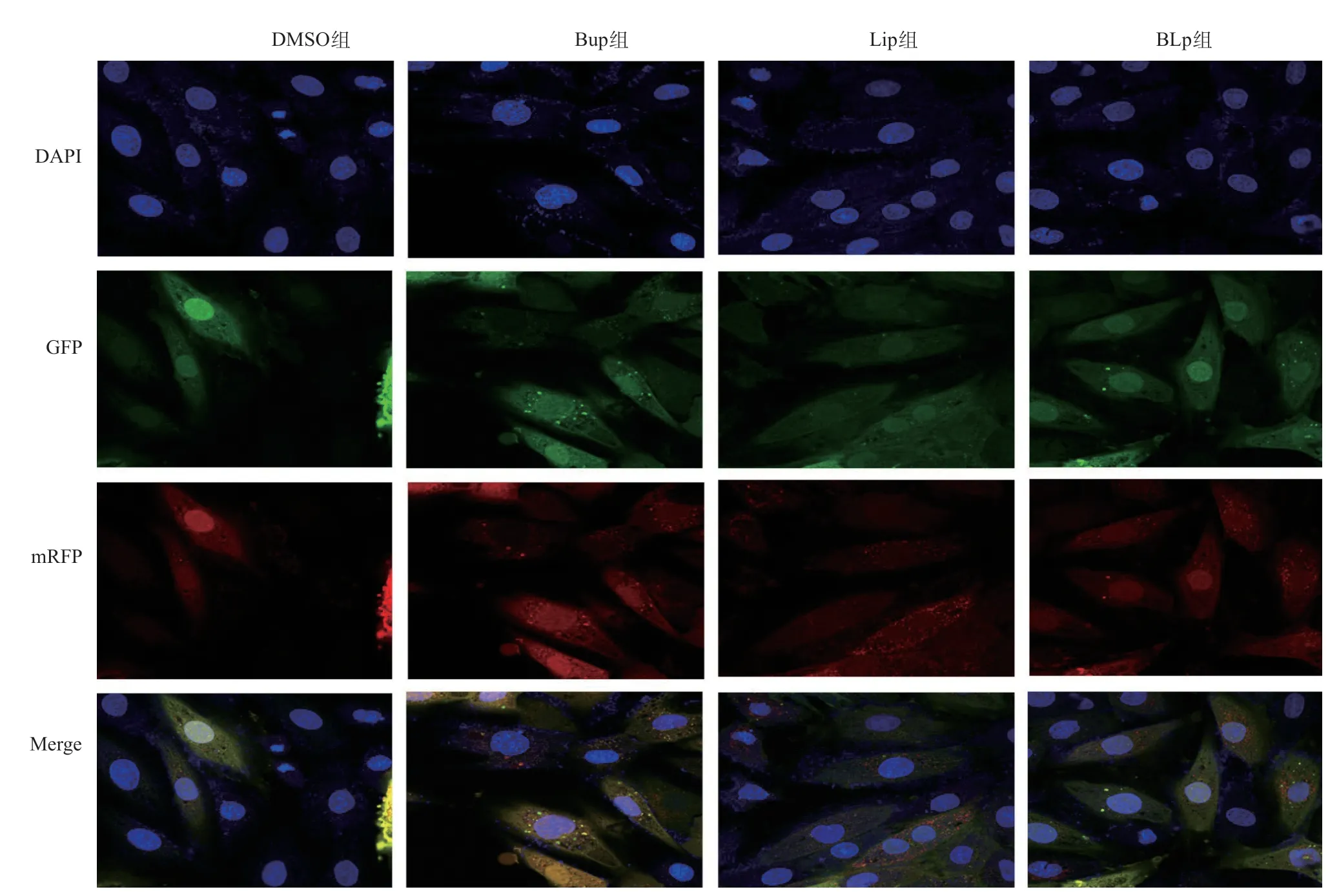
图3 激光共聚焦显微镜下四组H9C2心肌细胞自噬流现象(×400)
表1 四组H9C2心肌细胞LC3、p62蛋白及mRNA表达水平比较(每组n=5,±s)
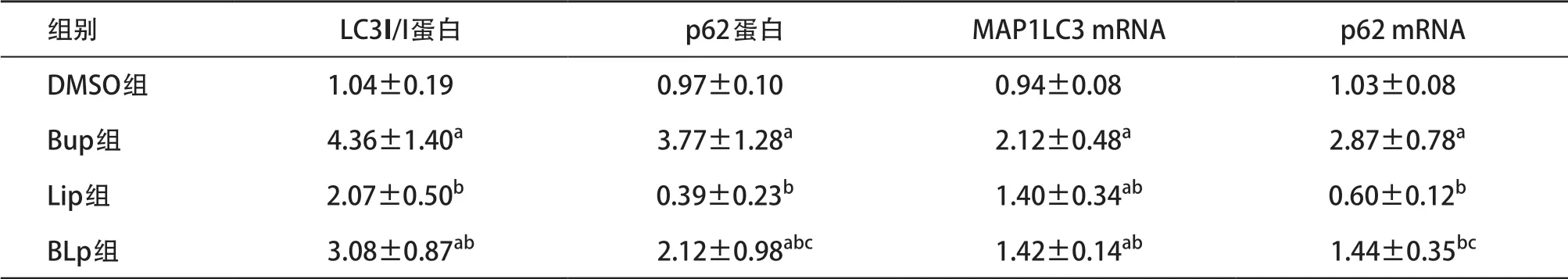
表1 四组H9C2心肌细胞LC3、p62蛋白及mRNA表达水平比较(每组n=5,±s)
与DMSO组比:aP<0.05;与Bup组比:bP<0.05;与Lip组比:cP<0.05
组别 LC3II/I蛋白 p62蛋白 MAP1LC3 mRNA p62 mRNA DMSO组 1.04±0.19 0.97±0.10 0.94±0.08 1.03±0.08 Bup组 4.36±1.40a 3.77±1.28a 2.12±0.48a 2.87±0.78a Lip组 2.07±0.50b 0.39±0.23b 1.40±0.34ab 0.60±0.12b BLp组 3.08±0.87ab 2.12±0.98abc 1.42±0.14ab 1.44±0.35bc
细胞死亡形式分为细胞坏死、凋亡性程序性细胞死亡和自噬性程序性细胞死亡三种类型[7]。自噬是几乎所有的真核细胞高度保守的进化过程。在正常情况下细胞自噬水平很低,但在细胞应激条件下,如营养物质消耗或氧化应激时可激活自噬,降解异常蛋白质,回收降解产物氨基酸,供细胞利用以维持细胞存活[8-9]。自噬的激活在心脏疾病中是一把双刃剑。如在心力衰竭情况下自噬激活,将促进肥厚性心肌病导致心力衰竭的异常蛋白降解,从而拮抗心室肥厚[10];另一方面,过度的自噬损害正常有功能的蛋白和细胞器,导致心功能不全[11]。而细胞自噬水平的下降又将导致细胞内代谢产物的堆积,最终引发心肌疾病[12]。总而言之,自噬在心室肥厚疾病[10]、心力衰竭[11]、心脏缺血再灌注[13-14]等过程中都有参与调控。
自噬的一个主要特点是自噬体的形成。ERICSSON[15]首次用透射电镜技术详细研究了具有双膜结构包裹着受损的细胞器或者异常蛋白质等的自噬体。LC3在翻译后加工成水溶性胞浆形式的LC3I,LC3I与磷脂酰乙醇胺缀合形成脂溶性膜型的LC3II,其被招募定位在自噬体膜,故LC3的转化(LC3II/I)或LC3II的水平被广泛认可用作自噬体的量化标志物[16]。本研究结果显示布比卡因处理后电镜下出现了大量双膜结构的自噬体,LC3II/I蛋白及基因表达明显增高,而用脂肪乳剂处理后电镜下自噬体数量及LC3II/I蛋白表达均有所减少。上述结果表明布比卡因可造成自噬体的堆积,而联用脂肪乳剂处理可改善这一现象。
自噬在细胞内是一个动态过程,涉及自噬体生成和清除两个阶段,因此布比卡因造成心肌细胞自噬体的堆积表明自噬体生成增加或自噬体清除减少。为进一步探讨自噬在脂肪乳剂解救布比卡因心肌毒性中的作用,本研究采用了mRFP-GFP-LC3双标腺病毒来监测自噬体转化为自噬溶酶体的动态过程(自噬流),结果显示布比卡因处理后出现大量黄色荧光斑点,却未见红色荧光斑点,而联用脂肪乳剂处理后黄色荧光斑点减少,出现红色荧光斑点,说明布比卡因主要通过抑制自噬体清除造成自噬体的堆积,而脂肪乳剂可激活自噬流加快自噬体清除。
p62是自噬的特异性底物,通过与LC3直接结合从而定位于自噬体中,参与自噬体选择性的清除过程,因此可通过检测p62蛋白的表达来评估自噬体清除情况[5,14]。本研究结果显示,布比卡因处理后p62蛋白及mRNA表达均明显增加,这结果与LI等[5]的报道类似,而联用脂肪乳剂可下调p62的表达,进一步说明布比卡因造成自噬体清除障碍导致自噬体堆积,而脂肪乳剂促进了自噬体的清除。
综上所述,脂肪乳剂解救布比卡因心肌毒性,其机制与通过激活自噬流从而加快堆积自噬体的清除有关。
