胎盘lncRNA H19/miR-675/PPARα与非妊娠期糖尿病巨大儿发生的关系
2021-07-20丁苗苗倪丽芳郑添俞秋嫣王玉环杨新军
丁苗苗,倪丽芳,郑添,俞秋嫣,王玉环,杨新军
1.温州医科大学 公共卫生与管理学院 预防医学系,浙江 温州 325035;2.温州医科大学附属第二医院育英儿童医院 产科,浙江 温州 325027
巨大儿(macrosomia)是指任何孕周出生体质量≥4 000 g的新生儿[1]。近年来,我国巨大儿的发生率呈上升趋势,从2006年的6.5%增加到2016年的7.46%[2-3],部分地区已达到9.2%[4]。分娩巨大儿不仅会增加产妇发生肩难产、产后出血、阴道撕裂等并发症的风险[5],还会增加巨大儿成年后罹患肥胖、糖尿病、心血管疾病等的风险[6]。近年来关于妊娠期糖尿病(gestational diabetes mellitus,GDM)巨大儿的研究较多,且结论较为一致,而非GDM巨大儿发生原因和机制尚不明确。
lncRNA H19是序列长度大于200 nt不编码蛋白质的长链非编码RNA,可通过其第一个外显子区域加工产生的衍生物miR-675发挥作用,呈胎盘特异性高表达,是胎盘和胎儿生长发育的关键调控基因[7-8]。lncRNA H19/miR-675可调节胎盘生长和滋养层细胞增殖[8-9],但是否参与非GDM巨大儿的发生发展仍不清楚。我们前期研究发现,过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor alpha,PPARα)在非GDM巨大儿胎盘中表达增加[10],且有研究报道PPARα可受lncRNA H19/miR-675的靶向调控[11],因此本研究假设胎盘lncRNA H19/miR-675/PPARα与非GDM巨大儿之间存在一定关系,通过人群研究和细胞实验两个角度对其进行探讨。
1 对象和方法
1.1 对象 基于2014—2016年在温州医科大学附属第二医院育英儿童医院产科建立的孕妇-新生儿队列,采用巢氏病例对照研究设计,病例组(巨大儿组)为出生体质量≥4 000 g的新生儿,对照组为随机选择的出生体质量2 500~3 999 g,且与巨大儿分娩时间相差3 d以内的新生儿。入选标准:正常妊娠、单胎、足月分娩,糖耐量试验正常。排除标准:有妊娠合并症者(高血压、心脏病、肝脏疾病等),有妊娠并发症(如胎盘异常、胎膜早破、先兆子痫等),新生儿先天畸形。本研究经温州医科大学伦理委员会批准,所有产妇均签署知情同意书。
1.2 方法
1.2.1 一般资料收集:采用自行设计的调查问卷收集产妇和新生儿的基本信息,包括产妇年龄、身高、孕前体质量、孕期体质量增加、分娩方式,新生儿性别、出生体质量及其他相关信息。
1.2.2 胎盘样品采集和处理:胎盘娩出后,立即无菌操作取胎盘母体面的滋养层组织1 cm3,放入加有RNAlater(美国Ambion公司)的DEPC处理过的冻存管中,4 ℃保存。采集的样品液氮运输,并保存于-80 ℃冰箱待检测分析。
1.2.3 细胞培养和转染:人绒毛膜滋养层细胞(HTR-8/SVneo)使用含有10%胎牛血清的DMEM培养基,并于37 ℃,5% CO2培养箱孵育。细胞按 lipofectamine 3000说明书的步骤转染。所用的si-H19序列:5’-CCGUCCCUUCUGAAUUUATT-3’,si-NC序 列:5’-UUCUCCGAACGUGUCACGUTT-3’,miR-675-mimic 序列:5’-UGGUGCGGAGAGGGCCCACAGUG-3’,mimic-NC序列:5’-UUGUACUACACAAAAGUACUG-3’。
1.2.4 胎盘lncRNA H19、miR-675和PPARα的mRNA水平检测:用TRIzol法提取胎盘及细胞总RNA,反转录后进行qPCR检测胎盘lncRNA H19、miR-675和PPARα的mRNA表达水平,lncRNA H19、PPARα以GAPDH作为内参基因,miR-675以U6作为内参基因。所用引物序列lncRNA H19上游:5’-GGACGTGACAAGCA GGACAT-3’,下游:5’-CATAGTGTGCCGACTCCGTG-3’,产物片段长度为148 bp;PPARα上游:5’-CTATCATTTGC TGTGGAGATCG-3’,下游:5’-AAGATATCGTCCGGGTGGT T-3’,产物片段长度为121 bp。GAPDH上游:5’-CAGGA GGCATTGCTGATGAT-3’,下游:5’-GAAGGCTGGGGCTCATT T-3’,产物片段长度为138 bp。miR-675、U6的反转录和qPCR引物均购自广州市锐博生物科技有限公司。qPCR反应条件为:95℃ 30s,95℃ 5s,60 ℃ 30s,共40个循环。用2-△△Ct法计算基因的相对表达量。
1.2.5 Western blot分析:在细胞转染24~48 h后提取HTR-8/SVneo细胞的蛋白质,BCA法测定蛋白质浓度,金属浴100 ℃、5 min变性蛋白质。取等量蛋白质进行SDS-PAGE,将蛋白质转移到PVDF膜,用10%脱脂牛奶室温封闭2 h,TBST漂洗10 min×3次,PPARα抗体4 ℃摇床孵育过夜,再经TBST漂洗10 min×3次,用二抗(1:5 000稀释)室温孵育1 h,TBST漂洗10 min×3次。用化学发光法Bio-Rad凝胶成像系统进行检测,蛋白质条带的密度由Quantity One(美国Bio-Rad公司)定量。用GAPDH蛋白进行标准化,检测细胞总蛋白质中PPARα的表达水平。
1.3 统计学处理方法 采用SPSS22.0软件进行数据分析。计量资料若呈正态分布以±s表示,组间比较采用成组t检验;非正态分布以M(P25,P75)表示,采用Mann-WhitneyU检验。计数资料采用例数和百分比表示,组间比较用χ2检验或秩和检验。采用logistic回归分析巨大儿的影响因素,以OR(95%CI)表示各因素对巨大儿发生的危险程度。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共收集巨大儿55例,对照组58例。两组间孕前体质量、孕前BMI、孕期体质量增加、孕周、分娩方式、胎儿性别的差异有统计学意义(P<0.05),产妇年龄、身高、初产妇的比例、巨大儿史在两组间差异无统计学意义(P>0.05),见表1。
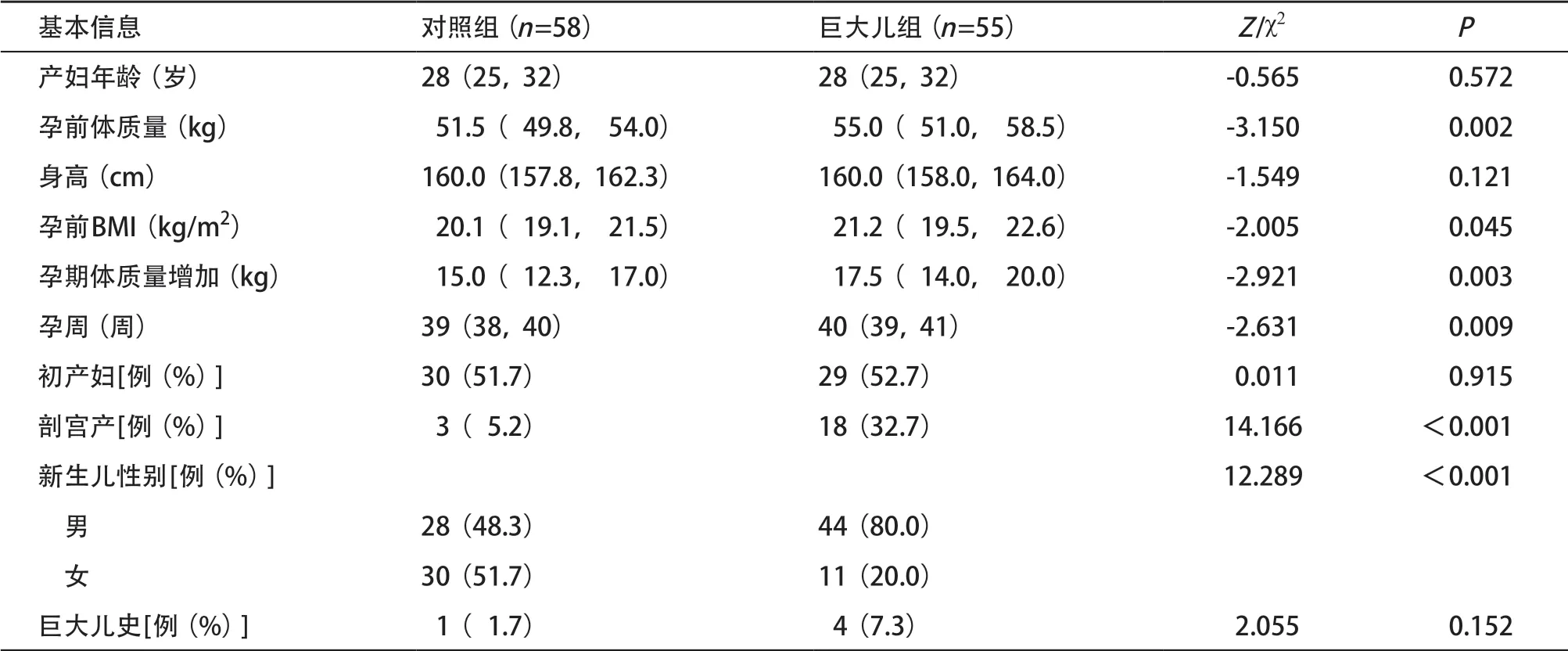
表1 两组产妇及新生儿的基线资料比较
2.2 胎盘lncRNA H19、miR-675、PPARα的mRNA表达水平 巨大儿组胎盘lncRNA H19和miR-675的表达量低于对照组,PPARα的表达量高于对照组,差异均有统计学意义[lncRNA H19:0.89(0.63,1.06)vs.0.97 (0.84,1.30),P<0.01;miR-675:0.79(0.44,1.05)vs.0.98(0.63,1.47),P<0.05;PPARα:1.45(1.01,1.92)vs.1.06(0.76,1.44),P<0.01],见图1。

图1 两组胎盘lncRNA H19、miR-675、PPARα的mRNA表达水平比较
2.3 胎盘lncRNA H19、miR-675和PPARα表达与非GDM巨大儿发生的关系 考虑潜在影响lncRNA H19、miR-675和PPARα表达差异的混杂因素,采用多因素logistic回归分析上述三种基因的胎盘表达水平与非GDM巨大儿的关系。在校正孕前BMI、新生儿性别变量后,胎盘lncRNA H19、miR-675和PPARα的mRNA表达仍与非GDM巨大儿的发生风险相关联,即胎盘lncRNA H19和miR-675的低表达及PPARα高表达均可增加非GDM巨大儿发生的风险,见表2。

表2 胎盘lncRNA H19、miR-675和PPARα的mRNA表达水平与非GDM巨大儿的关系
2.4 细胞水平验证lncRNA H19/miR-675对PPARα的调控作用 在人绒毛膜滋养层细胞(HTR-8/SVneo)中用siRNA敲低lncRNA H19,结果显示miR-675表达下调,PPARα的mRNA和蛋白表达水平上调,见图2A-D。 然而,在HTR-8/SVneo细胞中敲低lncRNA H19,同时过表达miR-675,则PPARα的表达上调被抑制,mRNA和蛋白表达水平与对照组比差异无统计学意义 (P>0.05),见图2E-H。
3 讨论
本研究分析发现,孕前高BMI和男性新生儿可增加非GDM巨大儿的发生风险,与以往的研究[12]结果一致。此外,在非GDM巨大儿组中孕期体质量增加、孕周高于对照组且差异有统计学意义,表明这些也是影响非GDM巨大儿发生的重要因素。
本研究显示,在非GDM巨大儿的胎盘组织中lncRNA H19表达水平低于对照组,调整了潜在的混杂因素后,发现胎盘lncRNA H19低表达可增加非GDM巨大儿的发生风险,此研究结果与JIANG等[13]和刘小霄等[14]的报道一致。lncRNA H19是一种父系印迹、母系表达的印记基因,具有限制胚胎发育和减缓子代生长速度的功能[15],因此当胎盘lncRNA H19表达下调时,可导致胚胎过度发育、加快胎儿的生长速度,从而促进巨大儿的发生发展。有研究报道,lncRNA H19是miR-675的主要前体物[16],它的第一个外显子区域加工后可产生miR-675,且胎盘lncRNA H19可通过核糖核酸结合蛋白HuR动态调节miR-675的加工过程,从而影响miR-675的表达,也可进一步通过miR-675发挥其生物学功能[8]。在本研究中,miR-675在非GDM巨大儿的胎盘组织中呈低表达(与对照组相比),可增加非GDM巨大儿的发生风险,此结果与lncRNA H19一致,因此,可以认为胎盘lncRNA H19/miR-675参与了非GDM巨大儿的发生发展。
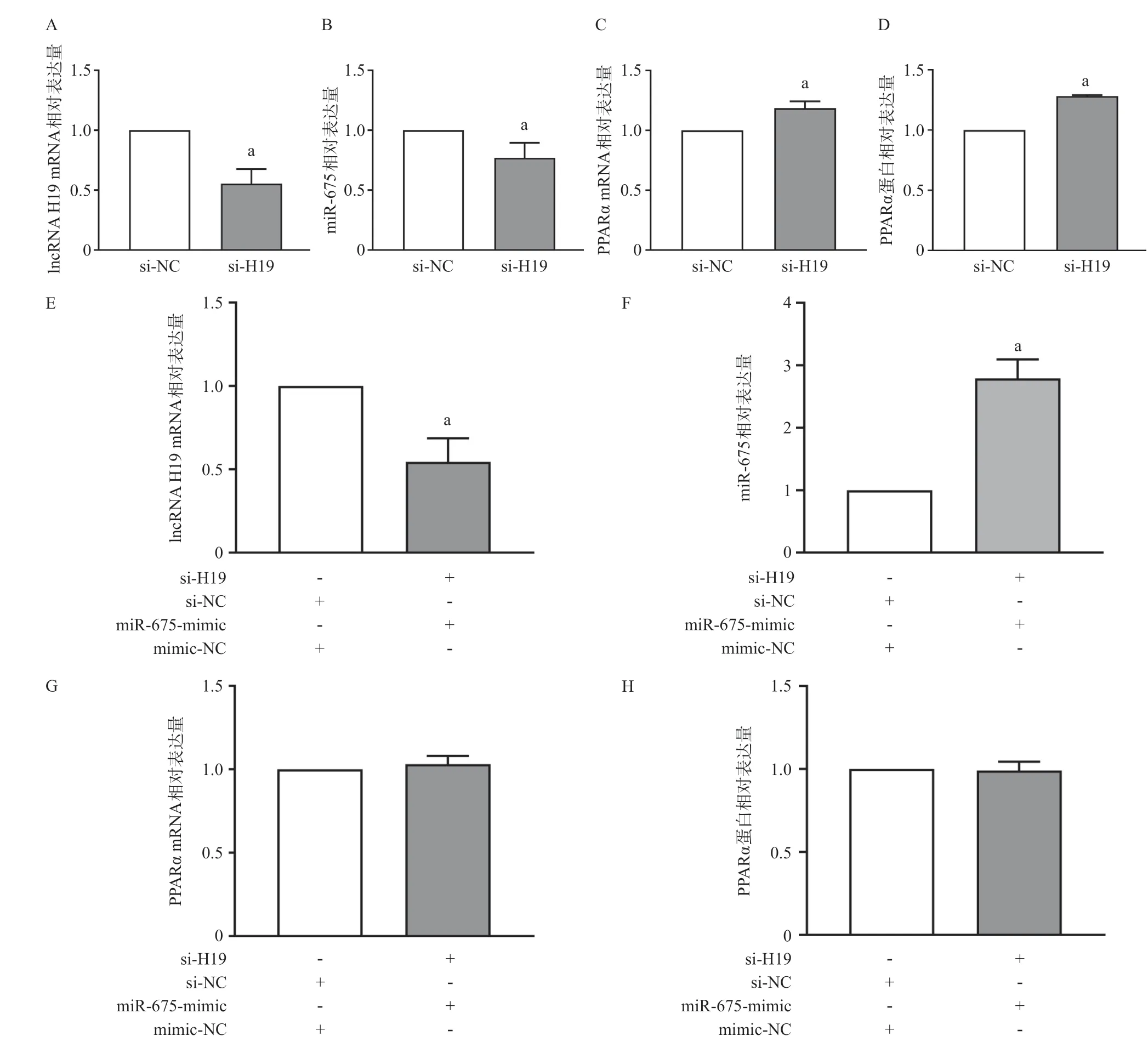
与对照组比:aP<0.01图2 lncRNA H19/miR-675在HTR-8/SVneo细胞水平可调控PPARα的表达
PPARα是过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors,PPARs)家族成员之一,在调节脂肪酸转运、脂肪酸氧化中发挥重要作用[17]。我们前期研究发现,非GDM巨大儿胎盘组织中PPARα表达增加。进一步通过TargetScan和MiRanda两种工具,我们发现PPARα是miR-675潜在的靶基因。本研究在校正了孕前BMI、新生儿性别等混杂因素后,发现胎盘PPARα高表达仍可增加非GDM巨大儿的发生风险,且有研究报道在肝脏和心脏组织中PPARα的表达可受lncRNA H19/miR-675的靶向负调控[11,18],因此在非GDM巨大儿胎盘组织中PPARα的高表达可能部分受lncRNA H19/miR-675低表达的影响。本研究通过构建体外细胞模型,发现在人绒毛膜滋养层细胞(HTR-8/SVneo)中lncRNA H19/miR-675可调控PPARα的表达。综上,胎盘lncRNA H19/miR-675/PPARα通路可能参与了非GDM巨大儿的发生发展。
本团队前期研究发现非GDM巨大儿胎盘中脂肪酸转位酶(FAT/CD36)和膜脂肪酸结合蛋白(FABPpm)等脂肪酸转运相关的蛋白表达与PPARα一致增 加[19-20],并与PPARα的表达水平成正相关[10]。研究报道PPARα可通过结合下游靶基因的PPRE元件从而增强脂肪酸转运相关基因的转录[21],但在非GDM巨大儿胎盘中PPARα是否调控FAT/CD36和FABPpm的表达并影响了脂肪酸转运仍然不清楚,其具体机制以及PPARα在非GDM巨大儿中的临床意义需进一步深入研究。
综上所述,胎盘lncRNA H19/miR-675表达下调,可增加非GDM巨大儿的发生风险。此外,胎盘PPARα表达上调,部分受lncRNA H19/miR-675的调控,胎盘lncRNA H19/miR-675/PPARα与非GDM巨大儿的发生存在一定关系。
