脱硫石膏制备γ-CaSO4晶须及II-CaSO4晶须
2021-07-19马文静陈学青郜丽丽郭宏飞李治水曹吉林
马文静, 陈学青, 郜丽丽, 李 雲, 郭宏飞, 李治水, 曹吉林
脱硫石膏制备-CaSO4晶须及II-CaSO4晶须
马文静1, 陈学青1, 郜丽丽1, 李 雲1, 郭宏飞1, 李治水2, 曹吉林1
(1. 河北省绿色化工与高效节能重点实验室, 河北工业大学 化工学院, 天津 300130;2. 天津渤化永利化工股份有限公司, 天津 300452)
为了制备稳定的无水不溶硫酸钙(II-CaSO4)晶须,提出改进的水热–焙烧工艺。以脱硫石膏为原料,在HCl-MgCl2溶液中通过加压水热反应合成无水可溶硫酸钙(-CaSO4)晶须,焙烧得到II-CaSO4晶须。采用X射线衍射(XRD)和扫描电镜(SEM)等进行表征。实验结果表明,-CaSO4晶须的最佳生长条件为:MgCl2浓度为0.07 mol·L−1,脱硫石膏与水的质量比(gypsum)/(H2O) 为 0.09,HCl浓度为0.44 mol·L−1,反应温度为120 ℃,反应时间为2.5 h。在600 ℃焙烧后,制得长径比大、表面光滑且规整度高的II-CaSO4晶须。相比于传统的水热–焙烧工艺,以-CaSO4晶须为中间产物的工艺避免了结晶水脱除对晶格的破坏,制得的II-CaSO4晶须结构致密,具有高稳定性。
脱硫石膏;无水硫酸钙晶须;水热–焙烧法;长径比
1 前 言
脱硫石膏(flue gas desulfurization gypsum,FGD gypsum)是工业烟气湿法脱硫的副产物,主要成分为二水硫酸钙(CaSO4·2H2O),还含有粉煤灰、铁硅氧化物、碳酸钙、亚硫酸钙、钾镁硫酸盐等杂质。由于脱硫石膏杂质复杂、颗粒级配差等因素的影响,脱硫石膏的应用水平不高且利用率低[1-2],造成资源浪费和环境污染。因此,脱硫石膏的高效利用是当前研究的重要问题。
硫酸钙晶须是硫酸钙的一种纤维状单晶体,可分为CaSO4·2H2O、半水硫酸钙(CaSO4·0.5H2O)和无水硫酸钙(CaSO4)晶须,其中CaSO4晶须又可以分为无水可溶型(-CaSO4)和无水不溶型(II-CaSO4)[3]。CaSO4·2H2O晶须易风化,CaSO4·0.5H2O和-CaSO4晶须易发生水化反应,导致晶体结构改变,而II-CaSO4晶须晶格之间不存在吸附结晶水的通道,难于水化,韧性好、强度高、耐高温、比表面积大、分散性好,广泛应用于水处理[4]、沥青[5]、造纸[6]、摩擦材料[7]及高分子材料[8]领域。因此,开发脱硫石膏制备II-CaSO4晶须材料具有重要的现实意义。
目前II-CaSO4晶须制备方法主要有常压酸化法、一步水热法和水热–焙烧法。常压酸化法需要酸浓度较高的合成体系,易对设备造成腐蚀,难以实现工业化利用[9];一步水热法需要较多的晶型控制剂且合成出的产品长径比较小[10]。水热–焙烧法是目前制备II-CaSO4晶须的主要方法,一般先用水热法制备CaSO4·0.5H2O晶须,然后进行焙烧脱水,经过CaSO4·0.5H2O →-CaSO4→ II-CaSO4的转化历程,得到II-CaSO4晶须[11-12]。然而,焙烧法需要强行从CaSO4·0.5H2O晶须的晶格中脱除水分子,导致晶体构型崩塌,从而使晶须表面产生裂纹,甚至局部应力集中造成晶须折断,影响II-CaSO4晶须在材料领域的应用。
本研究提出一种改进的水热–焙烧工艺,以脱硫石膏为原料在低酸度HCl–MgCl2体系中直接水热合成-CaSO4晶须,以避免水合硫酸钙焙烧时水分子逸出对晶格结构的破坏,然后通过焙烧制备II-CaSO4晶须。考察了MgCl2浓度、脱硫石膏与水的质量比(gypsum)/(H2O)、HCl浓度、反应时间、反应温度以及焙烧温度对产品的影响。
2 实验(材料与方法)
2.1 实验材料
本实验中所用原料为脱硫石膏(来自某碱厂烟气脱硫系统,主要成分见表1,表中B为质量分数,白度为44.12%),六水氯化镁(MgCl2·6H2O,分析纯,天津光复科技发展有限公司),盐酸(HCl,分析纯,北京化工厂)以及蒸馏水(河北工业大学自制)。

表1 脱硫石膏主要化学成分
2.2 实验方法
如图1所示为脱硫石膏纯化及制备II-CaSO4晶须的工艺流程图。首先通过物理洗涤对脱硫石膏进行初步提纯,得到水洗石膏[13]。取少量水洗石膏、适量MgCl2·6H2O和HCl,以及50 mL蒸馏水于反应釜中进行水热反应。反应结束,所得产物用沸腾的蒸馏水清洗数次并在100 ℃烘箱中烘干,制得-CaSO4晶须。以-CaSO4晶须为中间产物,在不同温度下焙烧4 h,得到II-CaSO4晶须产品。
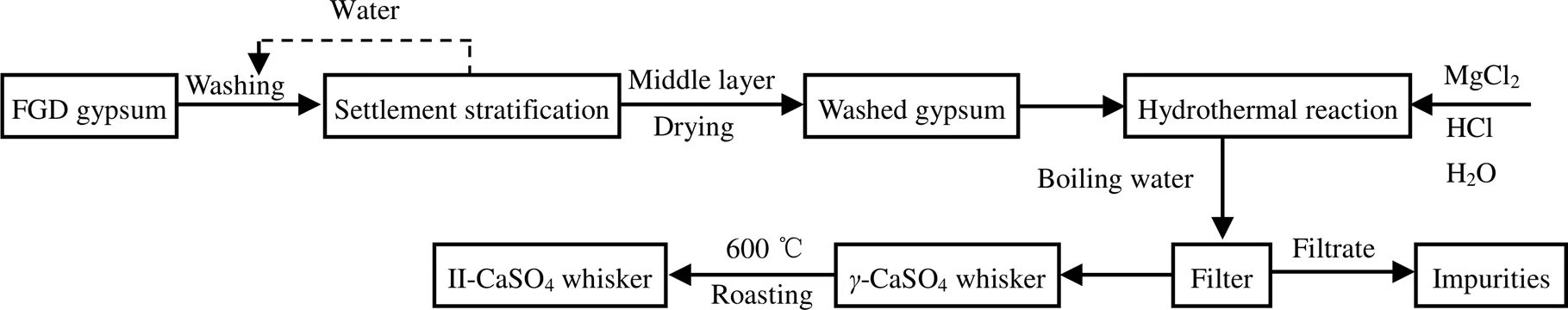
图1 以FGD gypsum为原料制备II-CaSO4晶须的工艺流程图
2.3 分析方法
通过X射线衍射仪(X-ray diffraction,XRD,D/MaxII-2500VB2+/PC,Rigaku,Japan)表征样品的晶型,测试范围为5°~90°。采用扫描电子显微镜(scanning electron microscope,SEM,Nano SEM 450,FEI,America)观察样品的形貌和大小,最大放大倍数为100万倍。通过全自动测色色差计(SC-80,康光仪器有限公司,北京)测试产品白度。利用乙二胺四乙酸二钠(EDTA)滴定法测定Ca2+浓度。根据GB 9776-2008(建筑石膏测定方法)测定原料及产品的结晶水质量分数。
3 实验结果与讨论
3.1 脱硫石膏的物理提纯
如图2所示为水洗前后石膏的SEM图及水洗石膏的XRD图。从图2(a)中可以看出,石膏原料的粒径为60~150 μm,未洗涤的石膏表面附着许多杂质,白度为44.12%。从图2(b)中可以看出,经过3次水洗后,原料表面光滑,没有杂晶,白度上升至69.76%。说明水洗过程可以达到初步除杂的效果。图2(c)显示的特征峰可归属于CaSO4·2H2O晶体的特征峰且无杂峰,说明水热反应前原料的主要化学成分为CaSO4·2H2O。

图2 未洗涤和洗涤3次后脱硫石膏的SEM图及水洗石膏的XRD图
3.2 水热法制备γ-CaSO4晶须
3.2.1 MgCl2浓度的影响
如图3和4所示为当HCl浓度(HCl) = 0.44 mol·L−1,(gypsum)/(H2O) = 0.09,反应温度为120 ℃,反应时间为2.5 h,不同MgCl2浓度(MgCl2)下所得样品的SEM和XRD图。如图5所示为MgCl2浓度对晶须长径比和样品中结晶水质量分数的影响。未添加MgCl2时,所得产品为-CaSO4晶须,长径比为24,随着MgCl2浓度的逐渐增加,-CaSO4晶须的长径比逐渐增大;当(MgCl2) = 0.07 mol·L−1时,-CaSO4晶须长径比达到最大,为120;继续增加MgCl2浓度,所得产品为CaSO4·0.5H2O晶须,且长径比逐渐减小,相应地样品中的结晶水的质量分数由0增加至4.660% 和4.670%,可见在(MgCl2) = 0.07~0.09 mol·L−1的结晶区域内,晶型发生-CaSO4→ CaSO4·0.5H2O的转化过程。如图6所示,Mg2+通过吸附在晶体的表面控制晶体形貌。-CaSO4的晶格结构与CaSO4·0.5H2O相似,Ca2+–SO42−–Ca2+沿C轴方向交替呈层状排列,使得SO42−在(200)和(110)面上分布较密集,而Ca2+密集分布于(111)面。因此,Mg2+易在侧面结合成MgSO4离子对,Ca2+与SO42−在空间位阻的影响下优先在(111)面缔合,最终导致了硫酸钙晶体的一维形貌,且长径比随MgCl2浓度的增加而逐渐增大[14]。当MgCl2浓度大于0.07 mol·L−1时,-CaSO4转变为CaSO4·0.5H2O,这是由于MgSO4离子对的生成使晶须表面的Ca2+活性增强,Ca2+活性位点一方面吸引水分子进入晶格间隙,另一方面易与溶液中的Cl−结合生成易吸水的氯化钙,导致晶体脱水困难。取反应后的滤液测得Ca2+浓度(Ca2+)变化如图5所示,以Ca2+的浓度代表脱硫石膏的溶解度,发现脱硫石膏在HCl溶液中的溶解度随MgCl2浓度的增加而增加,说明MgSO4离子对的生成可以促进石膏的溶解。综合以上分析,故确定最佳MgCl2浓度为0.07 mol·L−1。

图3 不同MgCl2浓度下产品的SEM图

图5 MgCl2浓度对Ca2+浓度、晶须长径比以及结晶水的影响

图4 不同MgCl2浓度下产品的XRD图

图6 Mg2+与硫酸钙晶须键合结构示意图
3.2.2(gypsum)/(H2O)的影响
当(MgCl2) = 0.07 mol·L−1,(HCl) = 0.44 mol·L−1,反应温度为120 ℃,反应时间为2.5 h时,不同(gypsum)/(H2O)下产物的SEM照片如图7所示。随着(gypsum)/(H2O)的增大,原料液的过饱和度和黏度增大,离子自由移动受到的阻力也增大,溶液中产生大量晶核但是晶体没有足够的生长空间,长径比下降。当(gypsum)/(H2O) = 0.09时,晶须形貌最为完好。

图7 不同m(gypsum)/m(H2O)下产品的SEM图
如图8所示为不同(gypsum)/(H2O)下产品的结晶水质量分数变化图和XRD图。当(gypsum)/(H2O) = 0.05、0.09时,结晶水质量分数依次为0.031%、0.057%,XRD图显示为-CaSO4。当(gypsum)/(H2O)=0.13,0.17时,样品表现为CaSO4·0.5H2O的特征峰,结晶水质量分数分别为3.800%、4.320%。这是因为随着(gypsum)/(H2O)增大,溶液的黏度增大,传热阻力上升,对溶液内部的热量供应不足,脱水速率减慢,所以产物为CaSO4·0.5H2O。综合考虑以上因素,最佳的(gypsum)/(H2O) = 0.09。

图8 不同m(gypsum)/m(H2O)对产品结晶水质量分数及XRD谱图的影响
3.2.3 HCl浓度的影响
如图9所示为(MgCl2) = 0.07 mol·L−1,(gypsum)/(H2O) = 0.09,反应温度为120 ℃,反应时间为2.5 h,不同HCl浓度下产品的SEM图。随着HCl浓度的提高,晶须长度和直径都增大,长径比上升。当HCl浓度为0.44 mol·L−1时,产品的平均长度为1 100 μm,平均直径为9 μm。说明HCl有使晶须增长的作用。由于HCl为原料液提供了H+,一方面H+与SO42−结合生成HSO4−,促进脱硫石膏溶解[15];另一方面H3O+受负电性吸引聚集在晶体的侧面,阻碍溶液中的Ca2+和SO42−在侧面缔合,促使晶体向高长径比转化[16]。当继续增加HCl浓度至1.11 mol·L−1时,原料大量溶解,溶液中过饱和度大大增加,故在体系内形成大量晶核,导致晶体没有充分的空间沿C轴生长,且生长速率减小,从而产物长径比下降。同时,溶液体系的高酸度使晶体表面出现细纹和分叉,晶体形貌变差。

图9 不同HCl浓度下产品的SEM图
如图10所示为不同HCl浓度下产品的XRD图和结晶水质量分数随反应时间的变化图。当不添加HCl时,测定结晶水的质量分数为2.800%,产品主要为CaSO4·0.5H2O。随着HCl浓度增加,结晶水质量分数依次为0.830%、0.080%、0.050%、0.020%、0.010%,产品逐渐转化为-CaSO4。由图10(b)可知,随着HCl浓度增加,产品脱水时间和结晶水质量分数减少,这是因为高酸浓度下CaSO4·2H2O和CaSO4·0.5H2O不稳定,有利于CaSO4生成[15]。另外,由图10(b)可知,HCl具有加速水合硫酸钙脱水的作用。考虑到当HCl浓度过高时,不利于产品经济性,还会对设备造成腐蚀,故HCl的最佳浓度为0.44 mol·L−1。
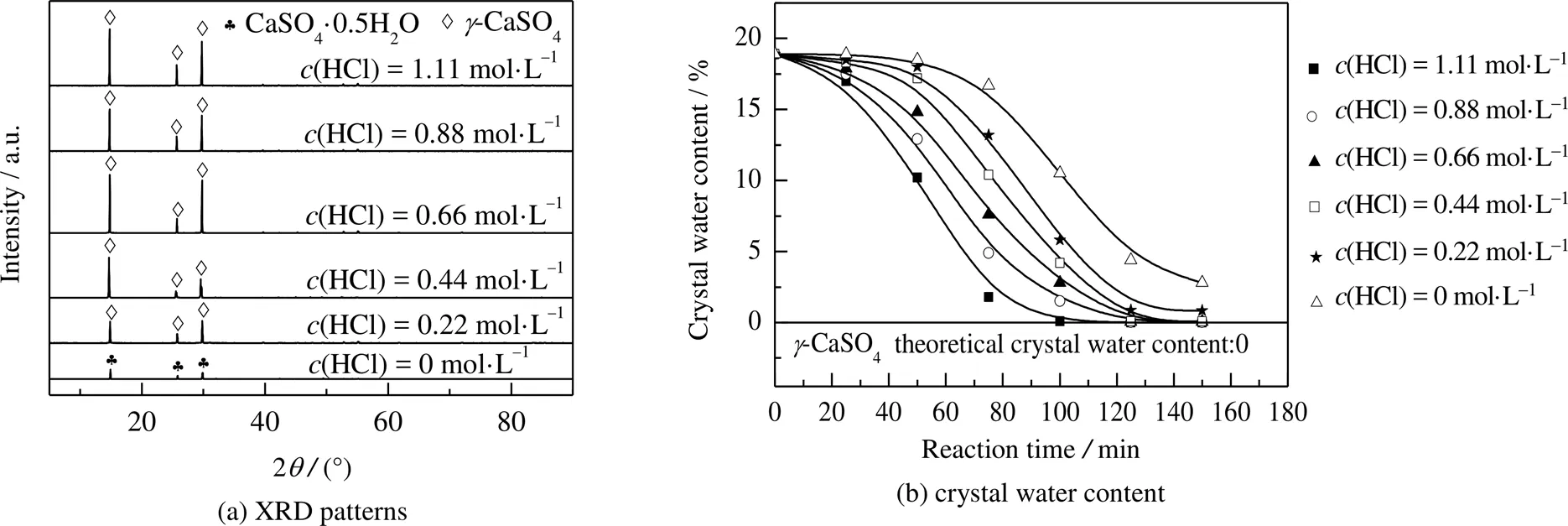
图10 不同HCl浓度下产品的XRD图及结晶水随时间的变化
3.2.4 反应时间的影响
如图11和12所示为(MgCl2) = 0.07 mol·L−1,(gypsum)/(H2O) = 0.09,(HCl) = 0.44 mol·L−1,反应温度为120 ℃时,不同反应时间下产物的XRD和SEM图。当反应时间= 0.5 h时,产品呈颗粒状且部分石膏呈无定形态,XRD图显示为CaSO4·0.5H2O的特征峰,表明CaSO4·2H2O发生脱水反应并有部分溶解。CaSO4·2H2O的结构是由Ca2+和SO42−结合成的离子层(平行于C轴)和水分子层交替排列而成,水分子层和离子层之间是偶极子和离子的相互作用力,Ca2+和SO42−的结合远较水分子要牢固得多,故加热CaSO4·2H2O时水分子优先沿C轴方向从晶格逸出形成CaSO4·0.5H2O,继而开始在溶液中溶解形成游离的Ca2+和SO42−。当反应时间延长至1.5 h,根据溶解–析晶机理,溶液中溶解的Ca2+和SO42−的数量达到-CaSO4晶体的过饱和度,迅速结晶生长得到-CaSO4晶须,但是由于反应时间不足,仍含有未转化的石膏颗粒。当反应时间为2.5 h时,所有的石膏颗粒完全转化为形貌规整的-CaSO4晶须。若继续延长反应时间至3.5 h,细小的晶须发生溶解,粗大的晶须进一步生长粗化,长径比下降,且产物晶型转化为CaSO4·0.5H2O。这是-CaSO4晶须进一步吸附结晶水造成。由此可见,-CaSO4晶须的合成符合二次生成机理[17,18],其在溶液中的形成经过CaSO4·2H2O → CaSO4·0.5H2O →-CaSO4的转化历程。

图11 不同反应时间下产品的XRD图

图12 不同反应时间下产品的SEM图
3.2.5 反应温度的影响


图13 不同反应温度下产品的XRD图

图14 不同反应温度下产品的SEM图
3.3 焙烧法制备II-CaSO4晶须
如图15(a)所示为不同焙烧温度下产品的XRD图。随着焙烧温度的升高,-CaSO4逐渐转变为II-CaSO4。当焙烧温度由200上升到500 ℃时,-CaSO4的(100)面和(200)面特征衍射峰逐渐减弱,而(110)面特征衍射峰逐渐增强。这是因为-CaSO4的(110)面和II-CaSO4的(020)面特征衍射峰的出峰位置十分接近,所以特征峰发生重叠,此时产品为-CaSO4和II-CaSO4的混合物,II-CaSO4的质量分数增加使该处特征衍射峰强度增大。当焙烧温度为500 ℃时,产品的XRD图出现了II-CaSO4的(022)面和(040)面特征衍射峰。当焙烧温度由500上升到700 ℃时,这两处的特征衍射峰逐渐增强。当焙烧温度为600 ℃时,-CaSO4的特征衍射峰消失,此时完全表现为II-CaSO4的特征衍射峰,说明产品完全转变成II-CaSO4。该焙烧过程中发生的相转化符合固相烧结机理。由于-CaSO4(110)面的分子层与II-CaSO4(020)面非常接近,Ca2+和SO42−在热激励的作用下仅需微小的相对位移就可以发生相转变。因此,在-CaSO4向II-CaSO4转变的焙烧过程中,只是结晶排列发生了细微的变化,但仍能保持母体结晶构架。

图15 不同焙烧温度及水化产品的XRD图
将600 ℃下焙烧的产品进行水化实验,水化温度为25 ℃,水化时间为6 h,水化质量分数为0.5%,如图15(b)所示,水化产物仍为II-CaSO4,说明焙烧产物没有吸附结晶水,产品晶型稳定。综合以上分析,确定600 ℃为最佳焙烧温度。
3.4 与传统水热-焙烧工艺的对比
如图16所示为本研究制得的-CaSO4及其焙烧得到的II-CaSO4的SEM图。焙烧后的晶须形貌规整,表面光滑,长径比大约为100。将3.2.4节中反应3.5 h制得的CaSO4·0.5H2O晶须于600 ℃下焙烧4 h,CaSO4·0.5H2O晶须经过焙烧后表面出现明显的裂纹(图16(e))。这是由于结晶水在晶胞中通过化学键占有晶位,高温焙烧下水分子通过空穴迁移到晶体表面,当吸收的能量足以使化学键断裂从晶格中逸出,造成原有晶体构型塌陷,导致晶体表面出现裂纹以及晶须折断。文献[20]也报道了相同的结果。相比于传统的由CaSO4·0.5H2O晶须焙烧制备II-CaSO4晶须的工艺,本研究提出的从-CaSO4焙烧制备II-CaSO4晶须的工艺只发生了原子在相界面的近距离迁移,避免了焙烧过程中水分子逸出对晶格的破坏,制得的II-CaSO4晶须结构致密,难于水化。

图16 焙烧前后晶须的SEM图
4 结 论
本研究提出了一种简单通用的II-CaSO4晶须合成新方法,即以脱硫石膏为原料通过加压水热法直接制备出高长径比且晶体形貌完整的-CaSO4晶须,进一步通过焙烧生成II-CaSO4晶须。最佳的工艺条件:MgCl2浓度为0.07 mol·L−1,(gypsum)/(H2O) = 0.09,HCl浓度为0.44 mol·L−1,反应温度为120 ℃,反应时间为2.5 h,焙烧温度为600 ℃,焙烧时间为4 h。相比于传统的由CaSO4·0.5H2O晶须焙烧制备II-CaSO4晶须的工艺,本研究提出的从-CaSO4焙烧制备II-CaSO4晶须工艺避免了焙烧过程中水分子逸出对晶格结构的损害,故制得的II-CaSO4晶须表面光滑,形貌规整,长径比达到100。
[1] KORALEGEDARA N H, PINTO P X, DIONYSIOU D D,. Recent advances in flue gas desulfurization gypsum processes and applications - A review [J]. Journal of Environmental Management, 2019, 251: 1-13.
[2] MIAO M, FENG X, WANG G L,. Direct transformation of FGD gypsum to calcium sulfate hemihydrate whiskers: Preparation, simulations, and process analysis [J]. Particuology, 2015, 19: 53-59.
[3] HONG T Z, LV Z H, LIU X,. A novel surface modification method for anhydrite whisker [J]. Materials and Design, 2016, 107(5): 117-122.
[4] CHEN X J, YANG L C, ZHANG J F,. Exploration of As(III)/As(V) uptake from aqueous solution by synthesized calcium sulfate whisker [J]. Chinese Journal of Chemical Engineering, 2014, 22(11/12): 1340-1346.
[5] 李冠玉, 李峻峰, 高阳, 等. 硫酸钙晶须改性沥青的感温性及黏度特性研究 [J]. 化工新型材料, 2017, 45(9): 241-243.
LI G Y, LI J F, GAO Y,. Research on temperature sensitivity and viscosity of calcium sulphate whisker modified asphalt [J]. New Chemical Materials, 2017, 45(9): 235-237.
[6] FENG X, ZHANG Y, WANG G L,. Dual-surface modification of calcium sulfate whisker with sodium hexametaphosphate/silica and use as new water-resistant reinforcing fillers in papermaking [J]. Powder Technology, 2015, 271: 1-6.
[7] ZHU Z C, XU L, CHEN G A. Effect of different whiskers on the physical and tribological properties of non-metallic friction materials [J]. Materials and Design, 2011, 32(1): 54-61.
[8] WANG J C, PAN X C, XUE Y,. Studies on the application properties of calcium sulfate whisker in silicone rubber composites [J]. Journal of Elastomers and Plastics, 2012, 44(1): 55-66.
[9] MA X L, TAN H B, HE X C. Preparation and surface modification of anhydrous calcium sulfate whiskers from FGD gypsum in autoclave-free hydrothermal system [J]. Energy Sources, Part A: Recovery, Utilization, and Environmental Effects, 2018, 40(17): 2055-2062.
[10] 吕智慧, 乃学瑛, 朱东海, 等. 一步水热法制备无水硫酸钙晶须 [J]. 人工晶体学报, 2016, 45(3): 51-56.
LV Z H, NAI X Y, ZHU D H,. Preparation of anhydrous calcium sulfate whisker by one-step hydrothermal method [J]. Journal of Synthetic Crystals, 2016, 45(3): 51-56.
[11] 韩跃新, 王宇斌, 袁致涛, 等. 煅烧对硫酸钙晶须结构及稳定性的影响 [J]. 化工矿物与加工, 2008(3): 13-16.
HAN Y X, WANG Y B, YUAN Z T,. Effect of calcine on crystal structure and stability of calcium sulfate whiskers [J]. Industrial Minerals and Processing, 2008(3): 13-16.
[12] 杨娜, 肖汉宁, 郭文明. 添加剂辅助水热法制备硫酸钙晶须及生长机理研究 [J]. 硅酸盐学报, 2014, 42(4): 539-544.
YANG N, XIAO H N, GUO W M. Additives-assisted hydrothermal synthesis of calcium sulfate whisker and its growth mechanism [J]. Journal of the Chinese Ceramic Society, 2014, 42(4): 539-544.
[13] SHAO D D, ZHAO B, ZHANG H Q,. Preparation of large-grained α-high strength gypsum with FGD gypsum [J]. Crystal Research and Technology, 2017, 52(7): 1-8.
[14] HOU S C, WANG J, WANG X X,. Effect of Mg2+on hydrothermal formation of-CaSO4·0.5H2O whisker with high aspect ratio [J]. Langmuir, 2014, 30(32): 9804-9810.
[15] LI Z B, DEMOPOULOS G P. Solubility of CaSO4phases in aqueous HCl + CaCl2solutions from 283 K to 353 K [J]. Journal of Chemical and Engineering Data, 2005, 50(7): 1971-1982.
[16] WU X Q, WU Z B. Modification of FGD gypsum in hydrothermal mixed salt solution [J]. Journal of Environmental Sciences, 2006, 18(1): 170-175.
[17] BADENS E, LLEWELLYN P, FULCONIS J M,. Study of gypsum dehydration by controlled transformation rate thermal analysis (CRTA) [J]. Journal of Solid State Chemistry, 1998, 139(1): 37-44.
[18] LOU W B, GUAN B H, WU Z B. Dehydration behavior of FGD gypsum by simultaneous TG and DSC analysis [J]. Journal of Thermal Analysis and Calorimetry, 2010, 104(2): 661-669.
[19] 张克从, 张乐潓. 晶体生长科学与技术 [M]. 北京: 科学出版社, 1997: 196-198.
ZHANG K C, ZHANG L H. Crystal growth science and technology [M]. Beijing: Science Press, 1997: 196-198.
[20] 王海龙, 梁富政, 周景辉, 等. 煅烧硫酸钙晶须用于废纸浆生产文化用纸填料 [J]. 大连工业大学学报, 2014, 33(1): 28-33.
WANG H L, LIANG F Z, ZHOU J H,. Application of calcined calcium sulphate whisker as filler in culture paper produced by deiked pulp [J]. Journal of Dalian Polytechnic University, 2014, 33 (1): 28-33.
Preparation of-CaSO4and II-CaSO4whiskers using FGD gypsum
MA Wen-jing1, CHEN Xue-qing1, GAO Li-li1, LI Yun1, GUO Hong-fei1, LI Zhi-shui2, CAO Ji-lin1
(1. Hebei Provincial Key Lab of Green Chemical Technology and High Efficient Energy Saving, School of Chemical Engineering and Technology, Hebei University of Technology, Tianjin 300130, China;2. Tianjin Bohua Yongli Chemical Industry Co. Ltd., Tianjin 300452, China)
An improved hydrothermal-calcination process was proposed to prepare anhydrous-insoluble calcium sulfate (II-CaSO4) whisker with good stability. The anhydrous-soluble calcium sulfate (-CaSO4) whisker was synthesized by autoclave hydrothermal reaction in HCl-MgCl2solution from flue gas desulfurization gypsum, and then calcined to obtain II-CaSO4whisker. X-ray diffraction (XRD), scanning electron microscope (SEM) and other characterization techniques were used. The experimental results show that the optimum growth conditions of-CaSO4whisker are MgCl2concentration of 0.07 mol·L−1, mass ratio of desulfurization gypsum to water(gypsum)/(H2O) = 0.09, HCl concentration of 0.44 mol·L−1, reaction time of 2.5 h and reaction temperature of 120 ℃. After calcination at 600 ℃, II-CaSO4whisker featuring large aspect ratio, smooth surface, and high regularity could be obtained. Compared with the conventional hydrothermal-calcination method, using-CaSO4whisker as the intermediate product circumvent the destruction of crystal lattice due to the release of crystal water, thus endowing the obtained II-CaSO4whisker with dense structure and high stability.
FGD gypsum; anhydrous calcium sulfate whisker; hydrothermal-calcination method; aspect ratio
TQ 177.3
A
10.3969/j.issn.1003-9015.2021.03.018
1003-9015(2021)03-0520-09
2020-06-04;
2020-09-21。
河北省自然科学基金(B2018202330);河北省高等学校科学技术研究项目(ZD2019042,QN2019012);天津市科技局企业科技特派员项目。
马文静(1996-),女,河北保定人,河北工业大学硕士生。
李雲,E-mail:liyun@hebut.edu.cn
