急性痛风患者NALP3炎症小体表达及相关指标的价值研究
2021-07-19王正义郭林旺
钟 山,王正义,郭林旺,林 玉
中南大学湘雅医学院附属海口医院滨江分院全科,海南海口 571100
痛风是因为单钠尿酸盐晶体异常引起的炎症性疾病,主要表现为嘌呤代谢和尿酸排泄异常以及障碍[1]。长期的高尿酸血症会导致关节和周围软组织尿酸盐晶体沉淀,进而反复出现急性关节炎,软组织、关节损害,以及痛风石性关节炎[2]。而急性痛风则是病情发展快、疼痛剧烈,且伴随C反应蛋白(CRP)和红细胞沉降率(ESR)的升高,但是大部分患者可在一定时间内自行缓解,临床上仅部分患者可由高尿酸血症发展为急性痛风,所以寻找更加有效预测痛风的指标显得较为重要[3]。CRP是一种急性时相反应蛋白,是机体出现炎性反应时最敏感的指标之一;ESR是指红细胞在一定条件内的沉降速度,在急性痛风发作期可明显升高[4]。血清核苷酸结合寡聚化结构域样受体3(NALP3)属于大分子复合物,能够充当半胱天冬酶-1活化的平台,同时能够起到促进白细胞介素(IL)-lβ、IL-18等炎性因子生成以及成熟的作用。既往有文献显示,NALP3在痛风、肾脏疾病当中起到重要的作用[5-6]。因此,本研究选取本院收治的152例急性痛风患者的临床资料进行分析,探讨急性痛风患者NALP3炎症小体表达及相关指标的价值。
1 资料与方法
1.1一般资料 选取2018年3月至2020年3月本院收治的152例急性痛风患者作为试验组。纳入标准:(1)符合《痛风的防治》[7]中痛风诊断标准;(2)年龄>18岁;(3)精神意识正常;(4)双源CT检查尿酸盐结晶沉积情况,均发现尿酸盐沉积,结晶沉积数量在120个以下;(5)临床资料完整。排除标准:(1)存在恶性肿瘤、心肌梗死等重大疾病;(2)存在肺、脑、肾等重要器官障碍;(3)中途退出或死亡。另选取同期体检健康者151例作为对照组。试验组男75例,女77例;年龄31~68岁,平均(50.14±5.48)岁;病程10~19 h,平均(15.25±3.19)h。对照组男74例,女77例,年龄30~69岁,平均(50.21±5.51)岁。两组患者性别、年龄等一般资料比较,差异无统计学意义(P>0.05)。所有患者及其家属知情且签署知情同意书,本研究经本院伦理委员会批准。
1.2方法
1.2.1NALP3 mRNA检测 分别抽取两组患者空腹静脉血2.5 mL,高速离心分离血清,参考TIANamp Blood DNA Kit说明书提取DNA,-70 ℃保存。采用荧光定量PCR检测NALP3 mRNA相对表达水平。参考GenBank中NALP3 mRNA的序列,采用Primer Express2.0软件设计引物,NALP3上游引物为5′-CCCCGTGAGTCCCATTA-3′,NALP3下游引物为5′-GAC-GCCCAGTCCAACAT-3′。内参基因GAPDH上游引物为5′-ACCCAGAAGACTGTGGATGG-3′,下游引物为5′-TTCAGCTCAGGGATGACCTT-3′。逆转录反应条件:45 ℃,持续45 min。采用荧光定量PCR测定NALP3 mRNA相对表达水平。95 ℃,预变性2 min,95 ℃ 15 s,60 ℃退火,72 ℃延伸45 s,连续40个循环。PCR完成后,分析扩增曲线对应循环阈值(Ct值)。
1.2.2NALP3蛋白检测 分别抽取两组患者外周血2.5 mL,提取外周血单个核细胞进行蛋白定量检测,严格按照蛋白抽提试剂盒说明书提取细胞总蛋白,使用BCA法进行蛋白定量。取50 μg细胞总蛋白进行电泳,转移至PVDF膜,5%脱脂奶粉孵育1.5 h;采用NALP3抗体(武汉博士德生物工程公司)及GAPDH抗体(美国Abcam公司)4 ℃孵育过夜。第2天加入被辣根过氧化酶所标记的二抗,孵育1 h,随后进行ECL化学发光显色,应用Image J软件进行图像分析。
1.2.3实验室检查 观察两组受试者尿酸(UA)、空腹血糖(FPG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、ESR、CRP水平。抽取两组受试者空腹静脉血3.5 mL,高速离心分层,分离血清,送至检验科,应用美国贝克曼有限公司的AU5800检测UA、ESR、LDL-C、HDL-C水平;应用泰康医学系统股份有限公司的血糖检测仪检测FPG水平;应用固相夹心法酶联免疫吸附试验(ELISA)检测CRP水平,人CRP ELISA试剂盒购自上海酶联生物科技有限公司。参考《常见疾病的实验室检查》[8]中实验室指标正常范围。UA正常范围:<420 μmol/L;FPG正常范围:3.9~6.1 mmol/L;LDL-C正常范围:<3.41 mmol/L;HDL-C正常范围:1.16~1.42 mmol/L;ESR正常范围:<20 mm/h;CRP正常范围:<2.87 ng/L。
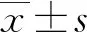
2 结 果
2.1两组患者实验室检查指标的比较 两组患者FPG、LDL-C、HDL-C水平比较,差异无统计学意义(P>0.05);试验组UA、ESR、CRP水平高于对照组,差异均有统计学意义(P<0.05)。见表1。

表1 两组患者实验室检查指标的比较
2.2两组患者血清NALP3 mRNA和蛋白质表达情况比较 试验组NALP3 mRNA表达水平及NALP3蛋白表达水平均高于对照组,差异有统计学意义(P<0.05),见图1、图2。

图2 两组NALP3蛋白表达水平比较

注:与对照组比较,*P<0.05。
2.3急性痛风独立危险因素分析 经多因素Logistic回归分析,NALP3炎症小体、UA、ESR和CRP是导致急性痛风的独立危险因素。见表3。

表3 急性痛风的独立危险因素分析
2.4NALP3炎症小体表达水平与血清指标相关性分析 Spearman相关性分析显示,健康者和急性痛风患者NALP3 mRNA的表达水平与UA、CRP、ESR均呈正相关(r=0.559、0.548、0.727,P<0.001)。
3 讨 论
痛风是目前风湿免疫科较为常见关节炎性疾病之一,临床表现为关节周围红肿、剧烈疼痛等,往往在1周左右可自行缓解,但是随着时间的变化,痛风的次数会逐渐增加,出现痛风石,最终引起关节畸形[9]。痛风急性发作期存在较为明显的特异性,急性发作期患者患病侧关节可出现红肿、灼烧以及疼痛感导致行动受到限制,如果影响到大关节甚至会引起渗液,患者多伴随发热的症状,往往会出现寒战、倦怠、头痛等情况,由于痛风急性发作期出现的皮肤暗红也会随之消失,大部分患者会出现脱屑、瘙痒等情况[10-12]。通常采用激素类药物进行治疗痛风急性发作期患者,虽可缓解病情,但其治疗效果受到治疗是否及时的影响,因此对于痛风急性发作的预测和诊断显得极其重要[13-15]。
NALP3炎症小体属于炎性复合体的一类。痛风性关节炎生成的尿酸炎结晶体是一种活化剂,能够活化炎性体,促进活性氧簇的分泌,激活NALP3的炎性信号通道,进而促进TNF-α、TL-1β等一系列炎性因子的分泌,使机体的炎性反应得到进一步扩大[16]。NALP3炎症小体的主要由NALP3、凋亡相关斑点样蛋白(ASC)、半胱氨酸蛋白酶(caspase)组成,这3种因子均能抑制IL-1β的成熟,表明NALP3炎性体与痛风炎性反应紧密相关,而有研究证实IL-1β能够促进炎症因子的分泌,引起炎症应答,与痛风急性发作密切相关[17]。本研究结果显示,试验组NALP3 mRNA及蛋白表达水平高于对照组,差异有统计学意义(P<0.05),且NALP3炎症小体是痛风急性发作的独立危险因素,与据李芳等[18]研究一致。提示痛风的急性发作期同样与NALP3炎症小体的表达升高有关。UA水平的升高是痛风的主要特征之一,本研究结果显示,相比于对照组,试验组UA水平显著升高,且UA是痛风急性发作的独立危险因素,分析原因,UA的代谢异常会导致尿酸盐结晶堆积于关节腔内部,促进炎性因子,进而引发痛风急性发作[19]。CRP是一种在IL-1、IL-6等炎性因子刺激下由肝细胞所合成的蛋白,健康人体内表达水平较低,但是在患者体内出现炎性因子的情况下,其水平会急剧升高。ESR升高多见于各种炎症。本研究中,试验组CRP、ESR水平较对照组显著升高,提示其能够作为痛风急性发作的检测指标。本研究结果还显示,痛风急性发作期体内NALP3 mRNA的表达与患者UA、CRP、ESR呈正相关。分析原因:患者在痛风急性发作期体内,因为炎性反应导致NALP3 mRNA的表达急剧升高,而在炎性反应的促进下,CRP水平急剧升高,ESR也随之升高[20]。
综上所述,NALP3炎症小体在急性痛风患者中的表达水平明显升高,NALP3炎症小体、血清UA、ESR、CRP是急性痛风的独立危险因素,同时NALP3炎症小体与UA、ESR、CRP的表达水平呈正相关。
