血清PGC-1α、Irisin水平对急性缺血性脑卒中患者出血转化的预测价值*
2021-07-19平会坤于彩敏
平会坤,刘 丽,于彩敏,余 兰
1.定州市人民医院神经内科,河北定州 073000;2.保定市第二医院神经内科,河北保定 071051
急性缺血性脑卒中(AIS)为脑卒中的一种,占所有脑卒中的80%,是由局部脑组织因血流循环障碍导致缺血缺氧,引起脑组织软化、坏死的一种中枢神经系统疾病,病死率和致残率较高[1-2]。出血转化(HT)是缺血性脑卒中的严重并发症之一,在缺血性脑卒中梗死区发生继发性出血,导致患者病情加重、预后不良。因此,早期评估AIS患者是否发生HT对改善患者预后具有重要意义[3]。血清过氧化物酶体增殖物激活受体γ辅助激活因子-1α(PGC-1α)是增加线粒体抗氧化酶能力的必需因子。最新研究发现,PGC-1α基因的抑制导致部分线粒体功能失效,通过AMP活化蛋白激酶(AMPK)/沉默信息调节因子1(SIRT1)-PGC-1α途径抑制C1q肿瘤坏死因子相关蛋白3(CTRP3)在缺血性脑卒中海马神经元凋亡中的保护作用[4]。然而,PGC-1α在AIS患者HT中的生理作用尚不清楚。鸢尾素(Irisin)是一种含有Ⅲ型结构域的跨膜蛋白,有研究发现,Irisin可通过抑制Toll样受体4(TLR4)/髓样分化因子88(MyD88)途径保护脑缺血/再灌注损伤[5-6]。目前,关于AIS发生HT患者血清PGC-1α与Irisin水平的关系,以及二者与AIS预后关系的研究较少,因此,本研究分析AIS患者血清PGC-1α、Irisin水平对HT的预测价值,以期为临床治疗提供参考。
1 资料与方法
1.1一般资料 选取2018年8月至2020年6月定州市人民医院收治的AIS患者124例作为研究对象。根据患者头颅CT复查结果将其分为HT组(53例)和非HT组(71例)。纳入标准:(1)符合《中国急性缺血性脑卒中诊治指南2018》[7]中相关AIS诊断标准;(2)经脑颅CT或核磁共振成像证实为缺血性脑卒中;(3)行静脉溶栓治疗;(4)均为首次治疗且出现症状12 h内就诊;(5)入院时CT检查未发现脑部出血。排除标准:(1)合并脑出血、短暂性脑缺血;(2)合并严重心、肝、肾功能不全;(3)合并恶性肿瘤;(4)合并感染性疾病或血液系统疾病;(5)可能引起血清指标变化的其他头颅损伤(如脑震荡、颅脑外伤等);(6)精神障碍,不能配合完成检查。HT组男36例,女17例,年龄39~84岁,平均(67.36±4.13)岁;非HT组男39例,女32例,年龄35~79岁,平均(66.41±3.76)岁。两组患者年龄、性别差异无统计学意义(P>0.05),具有可比性。本研究经定州市人民医院伦理委员会批准,入选患者及其家属签订知情同意书。
1.2方法
1.2.1基线资料收集 于患者入院时收集并记录一般资料,包括年龄、性别、体质量指数(BMI)、既往史(高血压、糖尿病、高血脂、吸烟史、饮酒史),以及发病至静脉溶栓时间、入院时美国国立卫生研究院卒中量表(NIHSS)评分、血糖水平、血钠水平、血小板计数、血脂水平、入院收缩压及舒张压等。NIHSS评分越高提示患者神经功能缺损越严重。
1.2.2血清学检测 收集患者入院次日清晨空腹静脉血5 mL,2 000 r/min离心10 min后取上层清液于干净EP管,-80 ℃冰箱保存,待测。利用7600-020型全自动生化分析仪(日本日立公司)检测血糖、血脂水平[包括血清总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平]。利用酶联免疫吸附试验(ELISA)检测血清PGC-1α、Irisin水平,试剂盒购自上海江莱生物科技有限公司,批号分别为LD-10237、LD-50493,操作步骤均按照说明书方法进行。
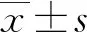
2 结 果
2.1HT组和非HT组患者基线资料比较 HT组和非HT组患者年龄、性别、BMI,高血压史、糖尿病史、高血脂史、吸烟史、饮酒史人数占比,血糖、血钠、TC、TG、HDL-C、LDL-C水平,以及入院收缩压和舒张压比较,差异无统计学意义(P>0.05);HT组患者发病至溶栓时间、入院时NIHSS评分、血小板计数均明显高于非HT组,差异均有统计学意义(P<0.05)。见表1。

表1 HT组和非HT组患者基线资料比较
2.2HT组和非HT组血清PGC-1α、Irisin水平比较 与非HT组相比,HT组患者血清PGC-1α、Irisin水平均较低,差异均有统计学意义(P<0.05)。见表2。

表2 HT组和非HT组血清PGC-1α、Irisin水平比较
2.3AIS合并HT患者血清PGC-1α水平与Irisin的相关性分析 Pearson相关分析结果显示,HT组AIS患者血清PGC-1α水平与Irisin呈正相关(r=0.562,P<0.001)。见图1。
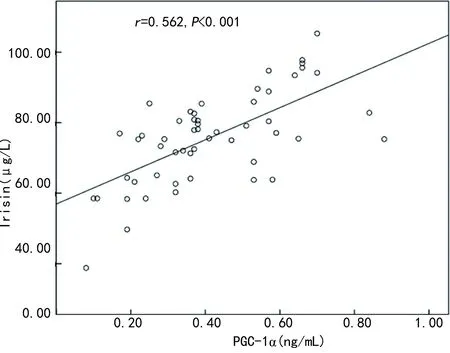
图1 AIS合并HT患者血清PGC-1α、Irisin水平相关性分析
2.4血清PGC-1α、Irisin水平对AIS患者发生HT的预测价值 ROC曲线分析结果显示,血清PGC-1α、Irisin水平预测AIS患者发生HT的曲线下面积(AUC)分别为0.886(95%CI:0.817~0.936)、0.811(95%CI:0.731~0.876),对应的敏感度分别为83.02%、67.92%,特异度分别为80.28%、81.69%;当PGC-1α≤0.58 ng/mL、Irisin≤79.40 μg/L时,发生HT的概率升高。二者联合预测AIS患者发生HT的AUC为0.934(95%CI:0.874~0.970),敏感度和特异度分别为86.79%、85.92%。见图2。

图2 血清PGC-1α、Irisin水平预测AIS患者发生HT的ROC曲线
2.5AIS患者发生HT的危险因素分析 以AIS患者是否发生HT为因变量(1=是,0=否),以发病至静脉溶栓时间≥4 h(中位数,1=是,0=否),入院时NIHSS评分>13分(中位数,1=是,0=否),血小板计数>443×109/L(中位数,1=是,0=否),PGC-1α≤0.58 ng/mL(1=是,0=否),Irisin≤79.40 μg/L(1=是,0=否)为自变量进行多因素Logistic回归分析,结果显示,发病至静脉溶栓时间≥4 h、入院时NIHSS评分>13分、PGC-1α≤0.58 ng/mL、Irisin≤79.40 μg/L是AIS患者发生HT的危险因素(P<0.05),见表3。

表3 多因素Logistic分析影响AIS患者发生HT的危险因素
3 讨 论
PGC-1广泛存在于线粒体代谢的多条途径中,其共有3个亚型,分别为PGC-1α、PGC-1β和PGC-1相关共激活剂(PRC)[8]。近年研究发现,PGC-1α不仅参与调控线粒体生物合成,在诱导细胞凋亡、炎性反应、心肌梗死等心血管事件中亦发挥重要作用[9-10]。PGC-1α多表达于脑、心肌、骨骼肌等能量代谢活跃组织,有研究认为低氧、寒冷、饥饿等刺激可促进PGC-1α表达上调,促进线粒体产生更多能量供给机体[11]。KALLIORA等[12]研究了在野生型和糖尿病模型小鼠中PGC-1α激动剂对心脏的毒性作用,结果显示激活PGC-1α会导致与PGC-1α抑制相关的心脏功能障碍,而且在各种脂肪酸代谢基因中PGC-1α表达下调幅度最大。本研究结果显示,AIS患者HT组血清PGC-1α水平明显低于非HT组(P<0.05)。氧自由基大量堆积造成的氧化应激反应及抗氧化系统失衡,这可能是缺血性脑卒中氧化应激受损的关键。有研究证明,发生氧化应激时神经细胞中PGC-1α活性升高可减轻自由基损伤、增强细胞活性,在脑缺血-再灌注损伤中起保护作用[13]。根据本研究结果,笔者推测血清PGC-1α水平降低,提示AIS患者抵抗氧化应激能力较弱,细胞受损严重,可能是发生出血转化的原因之一。
Irisin是最近研究发现的一种可将白色脂肪转化为棕色脂肪的肌肉因子,由Ⅲ型纤连蛋白结构域包含蛋白5(FNDC5)经剪切、修饰而成的多肽片段,广泛存在于血液、脑脊液、唾液等体液中,可经血液到达机体各个组织器官,现已证实其具有抗凋亡、抗氧化应激、促进线粒体代谢等生物功能[14-16]。FNDC5是一种膜整合前体蛋白,受心肌细胞中的PGC-1α调控。有研究发现,运动诱导的FNDC5/Irisin水平升高与心血管保护、修复及神经元功能改善有关[17-19]。徐瑄培等[20]通过动物实验发现,Irisin可以有效减轻新生大鼠缺氧、缺血性脑损伤,高剂量组大鼠脑损伤明显较轻,并认为其保护机制可能与减少细胞凋亡有关。本研究结果显示,HT组AIS患者血清Irisin与非HT组相比呈低表达,表明病情较重的AIS患者血清Irisin水平较低,提示Irisin差异性表达与AIS患者预后有关,Irisin水平降低与AIS患者发生HT有关,但具体作用机制尚不明了。本研究中,ROC曲线分析发现,血清PGC-1α、Irisin水平预测AIS患者发生HT的AUC分别为0.886、0.811,当PGC-1α≤0.58 ng/mL、Irisin≤79.40 μg/L时,AIS患者发生HT的概率增高,二者联合预测AIS患者发生HT的AUC为0.934,敏感度和特异度均有所提高,提示血清PGC-1α、Irisin对AIS患者发生HT均有一定预测价值,且二者联合对AIS患者发生HT的预测效能更好。本研究还发现,AIS合并HT患者血清PGC-1α水平与Irisin水平呈正相关,且发病至静脉溶栓时间≥4 h、入院时NIHSS评分>13分、PGC-1α水平≤0.58 ng/mL、Irisin水平≤79.40 μg/L是AIS患者发生HT的危险因素,提示二者可能共同作用影响AIS患者病情发展,与患者发生HT密切相关。本研究还存在一些不足,今后仍需更大样本量、多中心研究对本结果进行验证,二者的具体作用机制有待进一步研究。
综上所述,血清PGC-1α、Irisin水平在AIS合并HT患者中低表达,二者可能共同作用参与HT的发生、发展,是患者发生HT的危险因素,提示血清PGC-1α、Irisin可作为预测AIS患者发生HT的血清标志物。
