VPA对VEGF诱导的HRMECs成管能力的影响及其机制*
2021-07-19于明洲吴函书
于明洲,吴函书,冷 瀛
1.中国人民解放军联勤保障部队第九六五医院眼科,吉林吉林 132011;2.北华大学附属医院眼科,吉林吉林 132011
增殖型糖尿病性视网膜病变(PDR)中,异常新生的血管和结缔组织可能导致视网膜脱离并危及视力。有研究发现,PDR中眼组织的新血管形成与血管内皮生长因子(VEGF)水平密切相关[1]。目前,PDR的标准治疗方法都集中在PDR的晚期,并存在潜在不良反应[2-3]。丙戊酸(VPA)是一种能够抑制细胞增殖的组蛋白去乙酰化酶抑制剂[4]。有研究报道,VPA能够抑制内皮细胞的增殖及血管新生[5-6]。本研究通过观察VPA对VEGF条件下人视网膜微血管内皮细胞(HRMECs)的影响,以期为PDR的治疗找到新的思路。
1 材料与方法
1.1材料 HRMECs购自北京裕恒丰科技有限公司,RPMI 1640细胞培养液及胎牛血清购自Hylcone公司(美国),磷酸盐缓冲液(PBS,0.1 mol/L,pH 7.4)购自武汉博士德生物公司,VPA购自Sigma公司(美国),VEGF购自PeproTech公司(美国),CCK8试剂盒购自南京碧云天生物技术研究所,基质胶购自BD公司(美国),迁移小室(Transwell)及胰酶购自Millipore公司(美国),BCA蛋白定量试剂盒购自北京百泰克生物公司,兔抗人磷酸化-血管内皮细胞生长因子受体2(p-VEGFR2)、磷酸化-丝氨酸/苏氨酸激酶(p-AKT)、磷酸化-细胞外调节蛋白激酶1/2(p-ERK1/2)购自CST公司(美国,货号2478T、4060T、4370T)。
1.2方法
1.2.1细胞培养 用含有10%胎牛血清的RPMI 1640细胞培养液培养HRMECs,置于5%CO2、37 ℃恒温细胞培养箱中培养。
1.2.2细胞增殖能力检测 将对数生长期的HRMECs用0.25%的胰酶消化下来制成细胞悬液,并接种到96孔培养板中,每孔细胞悬液200 μL,细胞浓度1×104个/孔。设置细胞对照组、试剂对照组、VPA处理组(VPA终浓度分别为10、20、40、80、160 μmol/L),每孔均含VEGF 10 ng/mL。在5% CO2、37 ℃孵箱中分别孵育24 h和48 h,处理与培养结束后,各孔分别加入10 μL CCK8试剂,轻轻摇晃混匀,4 h内用酶标仪检测450 nm波长下各孔的吸光度(A)值,计算各组细胞增殖抑制率。细胞增殖抑制率=[1-(AVPA处理组-A试剂对照组)/(A细胞对照组-A试剂对照组)]×100%。
1.2.3细胞迁移能力检测 将处理后的各组HRMECs用胰酶消化,用RPMI 1640细胞培养液制成单细胞悬液,Transwell上室内接种浓度为5×104个/孔的HRMECs。Transwell下室内加入10%胎牛血清的内皮细胞培养基及终浓度为50 ng/mL的VEGF共600 μL。经20 h共培养后取出Transwell小室,弃去上室培养液,上室内未迁移的细胞用棉签擦去,PBS洗3遍。95%的乙醇固定膜下表面细胞,取下Transwell小室膜,经结晶紫染色后置于载玻片上用中性树胶封片。在100倍光学显微镜下观察迁移细胞的数量,随机选取5个视野计数,计算平均迁移细胞数。
1.2.4细胞体外成管能力检测 在冰上将预先4 ℃过夜融化的基质胶与无血清培养基(含100 ng/mL的VEGF)按1∶1混合加入预冷的24孔板,每孔300 μL, 然后置于37 ℃孵育1 h使其成胶。将处理好的各组HRMECs用含10%胎牛血清的培养基制成单细胞悬液,HRMECs以5×104个/孔的密度接种于预置基质胶的24孔板内,37 ℃孵育24 h,在100倍光学显微镜下观察,随机选取3处管腔密集处计数。
1.2.5蛋白表达检测 收集处理好的各组HRMECs,每组加入裂解液(RIPA裂解液与PMSF以100∶1的比例配制)100 μL,用移液枪反复吹打使细胞与裂解液充分接触,冰上静置30 min,低温离心机中4 ℃、10 000 r/min离心15 min后,将上清液移至新的EP管中。用BCA法定量各组上清液中蛋白质浓度。在恒压条件下采用SDS-PAGE凝胶电泳分离蛋白质,然后以250 mA恒定电流将蛋白质转印至PVDF膜上。PVDF膜放入5%的脱脂牛奶中37 ℃下封闭3 h后,加入一抗4 ℃孵育过夜,洗涤3次,加入二抗37 ℃孵育2 h,ECL化学发光法显影,采集图像,用Quantity One图像分析软件测定灰度值。
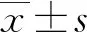
2 结 果
2.1VPA对VEGF诱导的HRMECs增殖能力的影响 CCK8实验结果显示,A值随着VPA浓度的增高而减小,提示随着VPA浓度增高活细胞数减少,并且随着VPA作用时间的增加,其对HRMECs的增殖抑制增强,见图1。结果表明,VPA能够抑制HRMECs的增殖,且VPA在0~160 μmol/L的浓度范围内与HRMECs的增殖能力呈负相关。VPA处理 24 h和48 h的半效抑制浓度(IC50值)分别为160.37 μmol/L和78.95 μmol/L。因此,在后续实验中以作用时间48 h、浓度40 μmol/L作为VPA处理方式(VAP处理组),以不加药物的HRMECs作为对照组。
图1 VPA对VEGF诱导的HRMECs增殖能力的影响
2.2VPA对VEGF诱导的HRMECs迁移能力的影响 Transwell小室迁移实验结果显示,HRMECs经40 μmol/L VPA处理48 h后,穿过Transwell小室膜的细胞数目明显减少,差异有统计学意义(P<0.05),结果表明HRMECs的迁移能力明显降低,见图2,提示VPA能抑制VEGF诱导的HRMECs细胞迁移。
2.3VPA对VEGF诱导的HRMECs体外成管能力的影响 基质胶体外成管能力实验结果表明,HRMECs经40 μmol/L VPA处理48 h后,HRMECs在基质胶上形成的管腔样结构的数量明显减少,差异有统计学意义(P<0.05),见图3。结果提示,VPA能够抑制VEGF诱导的HRMECs体外形成管腔的能力。

注:A为对照组;B为VPA处理组;C为两组定量分析结果;与对照组比较,*P<0.05。
2.4VPA对HRMECs蛋白表达的影响 Western blot结果表明,VEGF组较对照组p-VEGFR2、p-AKT以及p-ERK1/2的蛋白水平均有升高,而HRMECs经40 μmol/L VPA处理48 h后,细胞中VEGF介导的信号通路相关蛋白的水平发生变化。其中,p-VEGFR2及其下游的p-AKT及p-ERK1/2的蛋白水平均降低,差异均有统计学意义(P<0.05),见图4。结果表明,VPA能引起存在于内皮细胞表面的VEGFR2磷酸化水平降低,以及降低内皮细胞增殖及迁移相关蛋白AKT、ERK1/2的磷酸化水平。
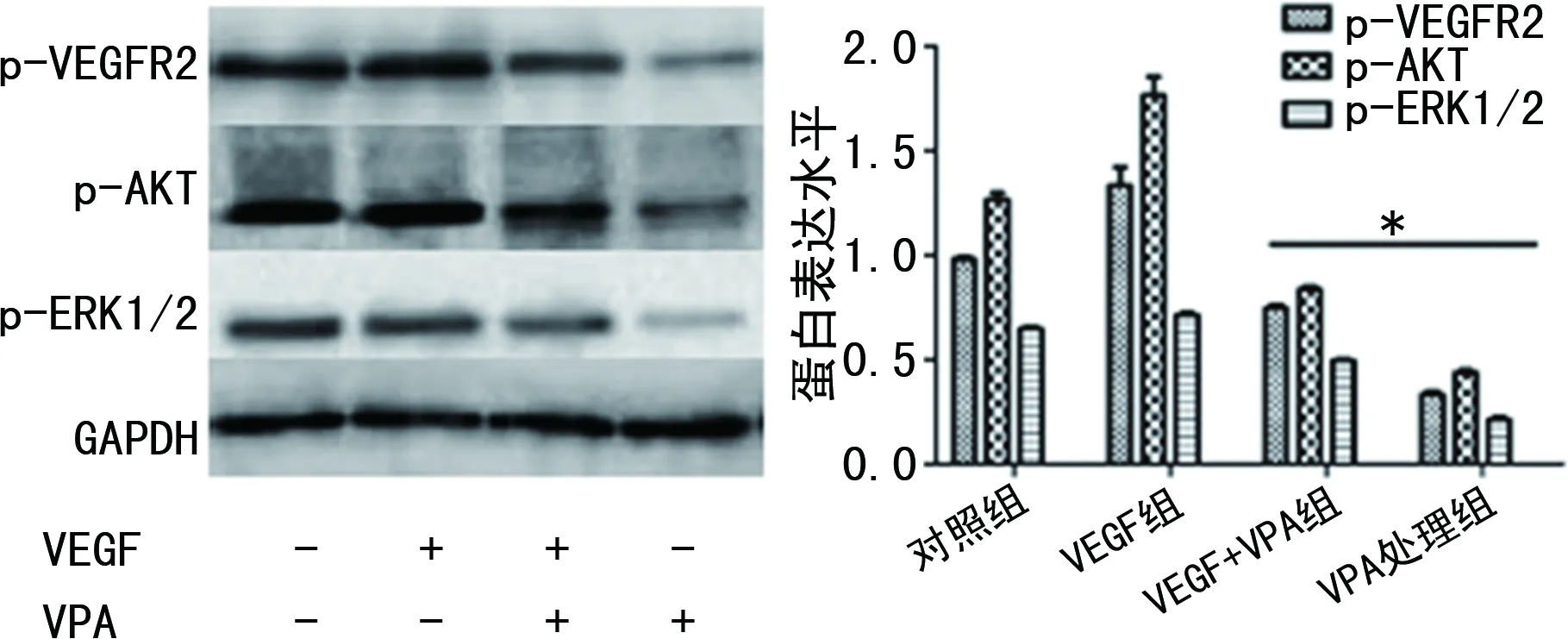
注:A为 Western blot检测蛋白表达结果;B为蛋白定量分析结果;与对照组比较,*P<0.05。
3 讨 论
糖尿病性视网膜病变是糖尿病性微血管病变中最重要的表现,PDR中新生血管生长影响并通过多种因素导致严重视力下降,甚至完全失明。血管新生是一个由内皮细胞构成新血管的复杂过程。血管内皮基质降解、内皮细胞迁移、内皮细胞增殖、内皮细胞管道化分支形成血管环等步骤是血管生成的主要过程[7]。本研究结果发现,组蛋白去乙酰化酶抑制剂VPA明显抑制了VEGF诱导的HRMECs增殖,并且这种抑制能力于一定的时间和剂量范围内呈正相关。此外,VPA也能够抑制VEGF诱导的HRMECs细胞体外成管及细胞迁移。以上结果表明,VPA具有抑制VEGF引起的HRMECs血管新生作用。
VEGF水平在很大程度上影响糖尿病性视网膜病变患者眼组织新血管形成。高葡萄糖水平对血管内皮细胞的损害作用引起一些血管闭塞导致缺氧和局部缺血[8]。而通过缺氧产生的低氧诱导因子-1诱导的VEGF是眼新血管形成的关键调节剂,并且在视网膜内皮细胞和周细胞上存在高亲和力的VEGF受体[9-10]。VEGF是一类由细胞产生的能够引起血管生成的信号蛋白,它与生理状态下及病理状态下的血管新生有着密切联系[11]。过度表达的VEGF可能引起视网膜和身体其他部位的血管疾病。VEGF与周围血管壁静止内皮细胞表面的VEGFR2结合,触发内皮激活和下游血管生成的信号通路[12]。当VEGF与内皮细胞膜上的VEGFR2结合,引起受体自身磷酸化,从而进一步引发内皮细胞中AKT和ERK的磷酸化,诱导内皮细胞增生,进而引起一系列的血管生成进程[13]。此外,VEGFR2介导的AKT和ERK的磷酸化对内皮细胞的迁移能力具有关键的调节作用[14-15]。因此,VEGF对新生血管形成的促进作用可能是通过磷酸化VEGFR2进而引起下游AKT、ERK的磷酸化水平增高来实现的。本研究结果发现,VPA能够抑制HRMECs的增殖、迁移及体外成管能力,VPA能够降低VEGF诱导的p-VEGFR2、p-AKT和p-ERK1/2的蛋白水平。因此,可以推测VPA对HRMECs增殖、迁移及成管能力的抑制可能是通过下调VEGF诱导的p-VEGFR2、p-AKT和p-ERK1/2的蛋白水平来实现的。
组蛋白去乙酰化酶抑制剂VPA能够在体外抑制VEGF诱导的HRMECs的增殖、迁移及成管能力,其可能的机制为VPA抑制了VEGF介导的VEGFR2磷酸化水平及其下游AKT/ERK信号通路。
