5-氮杂-2-脱氧胞苷对MEG3启动子超甲基化逆转及膀胱癌细胞凋亡的作用
2021-07-19姜应传陈炳邬嘉波王婕张小荣
姜应传 陈炳 邬嘉波 王婕 张小荣
膀胱癌是泌尿系最常见的恶性肿瘤,全世界每年约有54.9万例新发病例,约20万例患者死于膀胱癌,且发病率和病死率仍在不断上升[1]。近年来研究发现,一些长链非编码RNA(long noncoding RNA,lncRNA)作为基因表达的重要调控因子,参与调节膀胱癌细胞增殖、分化和凋亡等过程[2]。母系表达基因3(maternally expressed gene 3,MEG3)是最早被发现具有抑癌作用的lncRNA之一,在多数肿瘤中呈低表达或表达缺失,而启动子超甲基化可能是导致其低表达的原因之一[3]。本研究使用不同浓度的DNA甲基化特异性抑制剂5-氮杂-2-脱氧胞苷(5-aza-2-deoxycytidine,5-Aza-CdR)作用人膀胱癌T24细胞,检测MEG3启动子甲基化程度、MEG3 mRNA表达和细胞凋亡情况,进而探讨5-Aza-CdR对MEG3启动子超甲基化逆转及膀胱癌细胞凋亡的作用。
1 材料和方法
1.1 材料和试剂 人膀胱癌细胞系T24购自上海生工细胞库。FBS(批号:11011-8611)购自杭州四季青生物公司,胰蛋白酶(批号:25200114)、DMEM 培养基(批号:11995065)均购自美国 Gibco公司;5-Aza-CdR(批号:A3656)、二甲基亚砜(dimethyl sulfoxide,DMSO;批号:D2650)均购自美国Sigma公司;QIAmp DNA Mini Kit试剂盒(批号:51304)、EpiTect Bisulfite Kit(批号:59104)、EpiTect MSP Kit试剂盒(批号:59496)均购自德国Qiagen公司;荧光定量试剂盒(批号:A6001)、反转录试剂盒(批号:A5001)均购自美国 Promega公司;Hoechst33258试剂盒(批号:C1011)购自上海碧云天生物技术研究所;Annexin V PE/7-AAD凋亡试剂盒(批号:559763)购自美国BD生物科学公司,各引物购自上海生工生物工程公司。
1.2 药物配置 5 mg 5-Aza-CdR溶于DMSO中,配制成浓度为2.2×105μmol/L的母液,置于-20°C冰箱内储存;用 DMEM 培养基配制浓度为 0、2.5、10 μmol/L 的5-Aza-CdR培养液,同时用DMEM培养基配制浓度为0、2.5、10 μmol/L 的 DMSO 培养液,于 4 °C 保存。
1.3 细胞培养 人膀胱癌T24细胞用10%FBS+DMEM培养基,于37℃、含5%CO2的培养箱中培养。每1~2 d换液1次,当细胞生长至90%以上时,用0.25%胰蛋白酶消化细胞并传代,取对数生长期的细胞用于实验。
1.4 MEG3启动子甲基化程度检测 采用甲基化特异性PCR法。T24细胞按1.0×105个/孔的密度接种于6孔板中,待细胞贴壁后,实验组加入浓度为 0、2.5、10 μmol/L的5-Aza-CdR培养液,对照组加入浓度为0、2.5、10 μmol/L的DMSO培养液,分别作用3 d。收集细胞,按照 QIAmp DNA Mini Kit、EpiTect Bisulfite Kit试剂盒说明书进行基因组DNA提取和亚硫酸盐修饰。MEG3基因甲基化特异性引物序列如下,甲基化引物:正向5'-GTT AGTAATCGGGTTTGTCGGC-3',反向 5'-AATCATAACTCCGAACACCCGCG-3';非甲基化引物:正向5'-GAGGATGGTTAGTTATTGGGG T-3',反向 5'-CCA CCATAACCAACACCCTATAATCACA-3'。按EpiTectMSP Kit试剂盒说明书在PCR扩增仪(MyCycler,美国Bio-Rad公司)上进行甲基化特异性PCR。扩增反应总体系50 μl,其中EpiTect Master Mix 25 μl(1×)、primer A 2 μl(0.4 μmol/L)、primer B 2 μl(0.4 μmol/L)、模板DNA(<200 ng/50 μl)、RNase free dH2O 补足至 50 μl。扩增条件:95 ℃ 10 min;94 ℃ 15 s,50 ℃ 30 s,72 ℃ 30 s,30 个循环;72 ℃ 10 min。PCR产物于2.5%琼脂糖凝胶电泳后观察,使用凝胶成像仪(Universal HoodⅡ,美国Bio-Rad公司)摄像。出现甲基化条带而未出现非甲基化条带提示超甲基化,而非甲基化条带越清晰代表甲基化程度越低。
1.5 MEG3 mRNA表达检测 采用RT-qPCR法。T24细胞按1.0×105个/孔的密度接种于6孔板中,待细胞贴壁后,加入浓度为 0、2.5、10 μmol/L 的 5-Aza-CdR 培养液作用3 d。使用Trizol试剂提取总RNA,将提取的RNA进行反转录和PCR扩增。MEG3引物序列:正向5'-CTGCCCATCTACACCTCACG-3',反向 5'-CTCTCCGCCGTCTGCGCTAGGGGCT-3'。每个待测样品设置3个平行复孔,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参。PCR体系:10 μl 2×SYBR Premix Ex Taq;1 μl Reverse Primer;5.2 μl RNase Free dH2O;4 μl cDNA;0.2 μl DyeⅡ;1 μl Forward Primer。在RT-qPCR仪(7500 fast Real-Time PCR system,美国ABI公司)上进行反应。反应程序:95℃2 min;95 ℃ 15 s,60 ℃ 60 s,60℃ 60 s,40个循环。记录 Ct值,采用2-ΔΔCt方法计算MEG3 mRNA相对表达量。
1.6 细胞凋亡检测 (1)采用Hoechst33528核染色法。在6孔板中配置2 ml密度为2×104个/ml的T24细胞悬液,加入 0、2.5、10 μmol/L 的 5-Aza-CdR 培养液作用3 d。用0.1%多聚甲醛固定30 min,PBS洗5 min;加入Hoechst33258 染色液(1:1 000)避光作用 10 min;置于荧光显微镜(LSM800,德国Zeiss公司)下,在波长340 nm处进行观察。在荧光显微镜下,存活细胞呈弥散均匀荧光,凋亡细胞在细胞核或细胞质内可见浓染致密的颗粒块状荧光。(2)采用流式细胞术。T24细胞按1.0×105个/孔的密度接种于6孔板中,待细胞贴壁后,加入浓度为0、2.5、10 μmol/L的5-Aza-CdR作用3 d。将细胞浓度调整为1×106个/ml,用预冷的PBS洗涤细胞1次,再用冷的盐酸缓冲液洗涤1次,1 000 r/min离心5 min;弃上清液,收集细胞,加入500 μl结合缓冲液重悬细胞;再次离心沉淀细胞,小心吸除上清液;用去离子水按 1:3稀释结合缓冲液(4 ml 4×结合缓冲液+12 ml去离子水);用1×结合缓冲液重悬细胞,调节其浓度为1×106个/ml;取100 μl细胞悬液于5 ml流式管中,加入 5 μl Annexin V PE混匀后于室温避光孵育5 min;加入10 μl 20 mg/L的 7-AAD、400 μl PBS,立刻使用流式细胞仪(FACSVia,美国BD公司)进行检测。凋亡率=早期凋亡率(右下象限)+晚期凋亡率(右上象限);实验重复3次,取平均值。
1.7 统计学处理 采用Graphpad Prism 7.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同药物作用后T24细胞MEG3启动子甲基化程度比较 对照组出现清晰的M带(甲基化条带)未出现U带(非甲基化条带),提示对照组MEG3启动子发生超甲基化;实验组随5-Aza-CdR浓度的增加逐渐出现清晰的U带,MEG3启动子甲基化程度随着5-Aza-CdR浓度增加而下降,见图1。
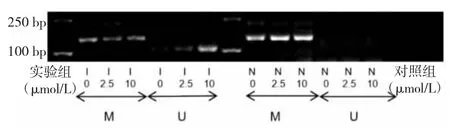
图1 不同药物作用后T24细胞母系表达基因3(MEG3)启动子甲基化程度比较
2.2 不同浓度5-Aza-CdR作用后T24细胞MEG3 mRNA表达比较 0、2.5、10 μmol/L 5-Aza-CdR作用T24细胞后MEG3 mRNA相对表达量分别为1.00±0.00、3.17±0.14、6.73±0.57,差异有统计学意义(F=73.43,P<0.05),且MEG3 mRNA相对表达量随着5-Aza-CdR浓度增加而增加(均P<0.05)。
2.3 不同浓度5-Aza-CdR作用后T24细胞凋亡情况比较 在荧光显微镜下,0 μmol/L组T24细胞形态基本正常,2.5 μmol/L 组、10 μmol/L 组 T24细胞出现不同程度的凋亡,表现为荧光集中,核固缩、分解等形态,见图2(插页)。流式细胞术检测显示,0、2.5、10 μmol/L 5-Aza-CdR作用T24细胞后细胞凋亡率分别为(0.34±0.05)%、(11.49±0.36)%、(17.53±2.03)%,差异有统计学意义(F=53.28,P<0.05),且 T24细胞凋亡率随着 5-Aza-CdR浓度增加而升高(均P<0.05),见图3(插页)。
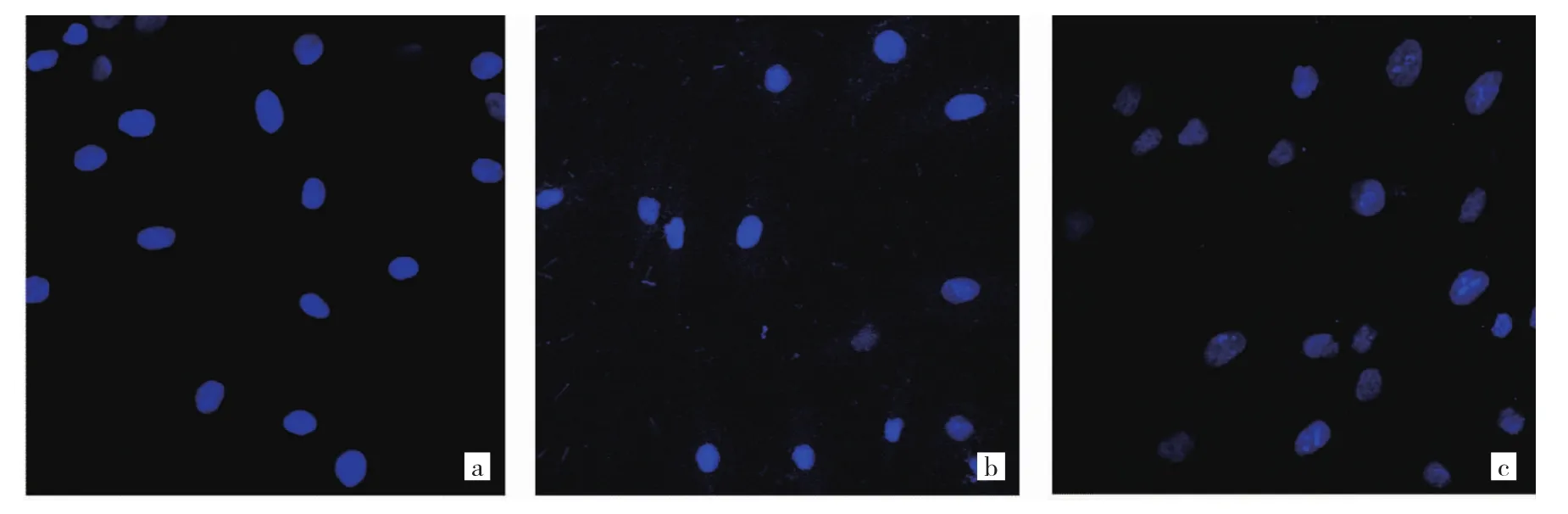
图2 不同浓度5-氮杂-2-脱氧胞苷(5-Aza-CdR)作用后T24细胞凋亡情况(Hoechst33528核染色,×200)
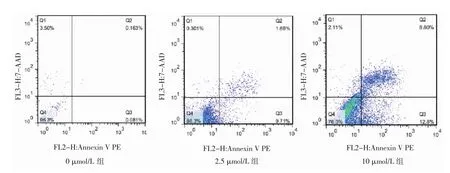
图3 不同浓度5-氮杂-2-脱氧胞苷(5-Aza-CdR)作用后T24细胞凋亡情况(流式细胞术)
3 讨论
膀胱癌的演化和进展与多种癌基因及抑癌基因异常表达有关[4]。DNA甲基化是表观遗传学重要的调控过程之一,可以直接改变其表观遗传学内容或使基因发生突变,导致抑癌基因“静默”,从而导致肿瘤恶性转化[5]。目前已在多种恶性肿瘤中发现MEG3启动子存在异常甲基化的CpG岛(胞嘧啶C和鸟嘌呤G富集的区域),而且这种改变可能与MEG3表达降低有关[3,6]。另有研究发现,MEG3在多种肿瘤中通过调控不同信号通路发挥抑癌作用,比如在非小细胞肺癌、胰腺癌中,MEG3可以通过激活p53引发肿瘤细胞凋亡[7]。而5-Aza-CdR是已知最强的DNA甲基化特异性抑制剂,能抑制DNA甲基化。研究表明,去甲基化可诱导MEG3重新活化和表达[8]。故本研究使用不同浓度5-Aza-CdR作用人膀胱癌T24细胞,以探讨其对MEG3启动子超甲基化逆转及膀胱癌细胞凋亡的作用。
本研究检测MEG3启动子甲基化程度发现,对照组、0 μmol/L 5-Aza-CdR组T24细胞均呈现超甲基化状态,同时MEG3启动子甲基化程度随着5-Aza-CdR浓度增加而下降。这说明在膀胱癌细胞中存在MEG3启动子甲基化,而5-Aza-CdR能够逆转膀胱癌细胞中MEG3启动子甲基化,其原理可能是5-Aza-CdR通过共价结合DNA甲基化转移酶的方式来抑制DNA甲基化转移酶的活性,从而抑制MEG3启动子甲基化效应,使其呈去甲基化状态。本研究继续采用RT-qPCR检测MEG3 mRNA表达,发现5-Aza-CdR作用后T24细胞恢复MEG3 mRNA表达,且相对表达量随着5-Aza-CdR浓度增加而增加。这间接表明MEG3基因表达下调归因于其启动子超甲基化。相关研究表明,MEG3表达与肿瘤的发生呈负相关,MEG3在许多恶性肿瘤中发挥着抑癌作用[9]。为了明确MEG3恢复表达后对膀胱癌细胞产生何种效果,本研究进一步采用Hoechst33528核染色法和流式细胞术检测T24细胞凋亡情况,结果发现5-Aza-CdR作用后T24细胞出现不同程度的凋亡,且随着5-Aza-CdR浓度增加而凋亡程度更明显。
综上所述,5-Aza-CdR可能通过逆转膀胱癌细胞中MEG3启动子超甲基化状态来恢复MEG3 mRNA表达,进而诱发膀胱癌细胞发生凋亡,但具体分子机制有待进一步研究证实。
