内脏转移性去势抵抗性前列腺癌患者的基因突变特征分析
2021-07-19蒋斌浩林琦黄航陈伟
蒋斌浩 林琦 黄航 陈伟
近年来我国前列腺癌发病率呈上升趋势,据统计,2008—2012年期间年增长率为2.6%[1]。既往报道的前列腺癌基因组学研究多数是基于高加索人群的研究[2]。随着第二代测序技术在前列腺癌诊疗中的广泛应用[3],基于中国人群的前列腺癌基因突变特征研究也相继开展[4],有研究发现我国前列腺癌患者的基因组改变与西方国家的患者存在明显差异[5]。我国前列腺癌患者多数初诊时已发生远处转移;当出现内脏转移时,患者的生存质量明显下降,生存期明显减少[6]。目前关于内脏转移性去势抵抗性前列腺癌(viscerally-metastatic castrationresistant prostate cancer,mCRPC-VM)患者的基因组学研究较为少见,故本研究基于本中心mCRPC-VM患者数据对其遗传突变特征进行分析,以期为后续诊疗提供指导。
1 对象和方法
1.1 对象 选取2017年1月至2019年12月在温州医科大学附属第一医院泌尿外科确诊为mCRPC-VM的患者 33 例,年龄 48~81(64.52±8.03)岁;初诊时 Gleason评分≥8分23例;初诊时前列腺特异抗原(prostate specific antigen,PSA)≥20 μg/L 31 例;所有患者存在骨转移和淋巴结转移,同时合并肝转移12例(其中2例患者合并肺转移,本研究根据Halabi等[7]的内脏转移分类标准“出现肝转移的患者即使有其他转移部位,均被归类为肝转移”进行分类),肺转移17例,脑转移2例,腹腔转移1例,胸膜转移1例。纳入标准:(1)组织病理学证实为前列腺腺癌,且疾病进展至转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)阶段;(2)增强CT检查证实为mCRPC-VM;(3)已完善前列腺易感基因二代测序。排除合并其他恶性肿瘤的患者。本研究经医院医学伦理委员会审查通过,所有患者签署知情同意书。
1.2 基因测序及生物信息学分析 采集患者血液中的白细胞进行胚系基因检测,采集患者循环肿瘤细胞和(或)肿瘤组织标本进行体系基因检测。对所有患者的前列腺易感基因进行二代测序,胚系突变检测深度2 500×,体系突变检测深度10 000×;测序试剂盒为KAPA Hyper prep Kit二代测序文库构建试剂盒(美国Illumina公司),测序平台为NextSeq CN500平台(美国Illumina公司)。临床医生根据患者病情需要和经济能力推荐基因检测组合,再由患方同意并选取,所检测的目标基因数目50~642个。这些基因检测组合为临床上成熟应用的检测基因组合,覆盖绝大多数遗传性肿瘤相关基因、免疫治疗相关基因、靶向治疗相关基因、化学治疗相关基因等。33例患者的基因检测组合覆盖本研究所涉及的全部目标基因。
1.3 统计学处理 采用SPSS 26.0统计软件。计量资料以表示,组间比较采用两独立样本t检验;计数资料组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 高频率突变基因分析 33例mCRPC-VM患者突变频率最高的基因为TP53,达45.45%(15/33);其次为AR,达 42.42%(14/33);再次为 NCOR2、PTEN、FOXA1、PIK3CA、RB1,均为 15.15%(5/33)。3例(9.09%)患者携带胚系突变,均发生于DNA损伤修复通路基因。12例肝转移患者突变频率较高的基因为AR(66.67%)、TP53(41.67%)、FOXA1(33.33%),其中 AR 突变频率明显高于非肝转移患者的28.57%,FOXA1突变频率明显高于非肝转移患者的4.76%,差异均有统计学意义(均P<0.05)。17例肺转移患者中突变频率较高的基因为TP53(52.94%)、AR(29.41%),见图 1(插页)。
2.2 高频率突变基因的类型分布 TP53突变类型占比最高为错义突变(66.67%);AR突变类型包括基因扩增(57.14%)、错义突变(42.86%);NCOR2、PTEN、FOXA1、PIK3CA突变类型占比最高均为错义突变,分别占60.00%、40.00%、80.00%、100.00%;RB1突变类型占比最高为移码突变(80.00%),见表1。基因缺失突变仅发生于肺转移患者(71.43%)和胸膜转移患者(28.57%);基因扩增突变在肝、肺、脑转移患者中均有发生,大多集中于肝转移患者(66.67%),且88.89%的基因扩增发生于AR基因上,见图2。
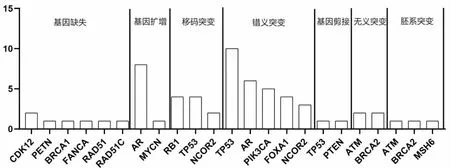
图2 不同基因突变类型的高频分布情况
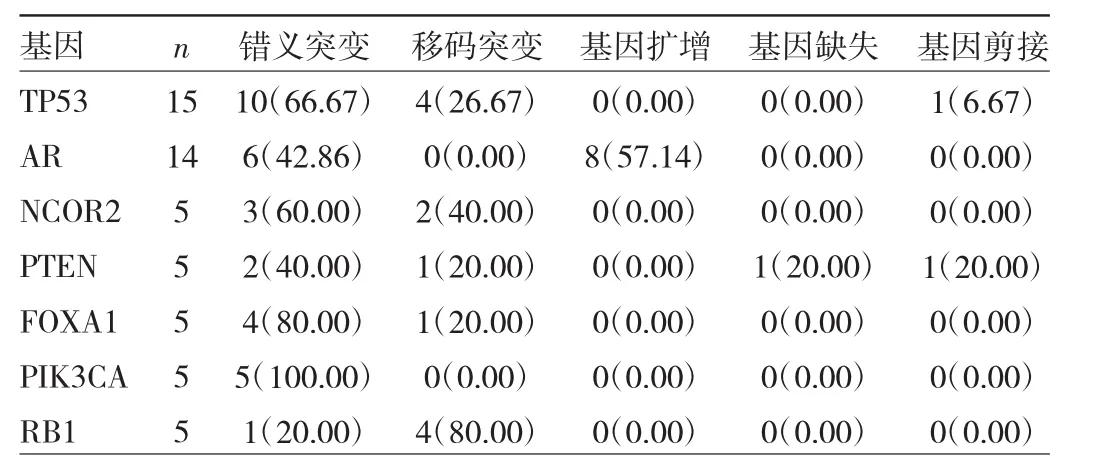
表1 高频率突变基因的类型分布[例(%)]
2.3 本院与SU2C-PCF数据库患者基因突变频率比较 将本院33例mCRPC-VM患者数据与SU2C-PCF数据库的444例mCRPC患者基因组数据[8]进行比较,发现本院患者PTEN突变频率明显较低(15.15%比32.66%),差异有统计学意义(P<0.05);而 AR(42.42%比58.78%)、TP53(45.45%比40.09%)、NCOR2(15.15%比 8.78%)、FOXA1(15.15%比 13.96%)、PIK3CA(15.15%比 11.94%)、RB1(15.15%比 12.84%)等基因突变频率比较,差异均无统计学意义(均P>0.05),见图3。
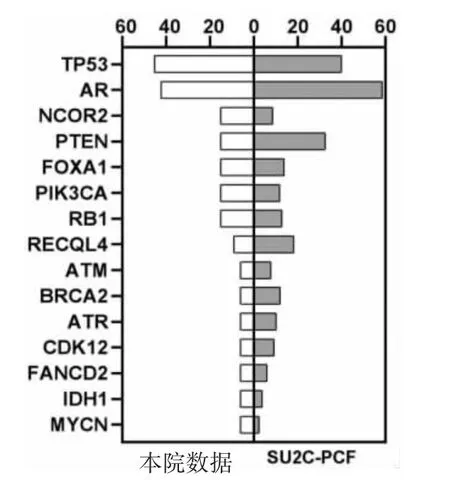
图3 本院与SU2C-PCF数据库患者基因突变频率比较
3 讨论
目前,第二代测序技术已在前列腺癌诊疗中得到广泛应用[3]。随着《中国前列腺癌患者基因检测专家共识》的发布与更新,基于中国人群的前列腺癌精准治疗时代已经到来。专家共识推荐mCRPC患者完善二代基因测序,并指出检测应至少包含HRR基因胚系及体系变异的检测,同时可以考虑行微卫星不稳定性和DNA错配修复缺陷检测[8]。既往研究表明,mCRPC-VM患者的预后更差[7]、药物治疗获益更小[9-10]。基于此,本研究对本中心mCRPC-VM患者二代基因测序结果作一分析。
本研究结果表明,mCRPC-VM患者突变频率由高到低的基因为 TP53、AR、NCOR2、PTEN、FOXA1、PIK3CA、RB1,所有的胚系突变发生于DNA损伤修复通路基因,占9.09%。此外,肝转移患者FOXA1、AR突变频率均高于非肝转移患者,差异均有统计学意义。Li等[5]研究显示,41%的中国患者携带FOXA1突变,远高于既往西方国家患者的比例。FOXA1是与AR受体通路相关的重要基因,FOXA1高表达与前列腺癌预后不良相关。肝转移患者FOXA1、AR突变频率均较高,这或许能从基因水平解释肝转移患者预后相对较差的原因。
本研究进一步将本院33例mCRPC-VM患者数据与SU2C-PCF数据库444例患者基因组数据进行对比,发现除PTEN外,本院患者与SU2C-PCF数据库患者的高频突变基因无明显差异。但Li等[5]研究表明,中国患者与西方国家患者在前列腺癌基因组学方面存在显著差异。分析原因可能有以下几点:(1)单纯与西方国家患者的mCRPC队列进行对比,可能存在一定的误差;(2)SU2C-PCF数据库的mCRPC队列未对患者是否存在内脏转移作进一步区分。研究表明,在接受一线治疗前,约20%的mCRPC患者伴有内脏转移[11-12],随着治疗的进行,这个比例会不断增加,临终前3个月内近50%的患者伴有内脏转移[13],故其中内脏转移患者的数据可能导致一定的偏倚。
综上所述,本研究揭示了真实世界单中心mCRPC-VM患者的基因突变特征,其高频率突变基因为TP53和AR,其中肝转移患者的AR和FOXA1基因突变频率高于非肝脏转移患者;高频突变基因的类型以错义突变为主;与SU2C-PCF数据库中mCRPC患者相比,本院mCRPC-VM患者的PTEN突变频率明显降低。但本研究存在一定的缺陷:(1)由于panel的设定限制,并非所有患者完成ETS、KMT2、KMT2D等SU2C-PCF数据库中高频率突变基因的检测。在这个方面上不能很好地进行匹配对比。(2)样本量较小,可能造成一定的偏倚。
