性腺发育不同阶段野生瓯江凤鲚肌肉营养成分的分析与评价
2021-07-17周朝生柯爱英郑伊诺胡忠键刘志坚郭安托
胡 园 周朝生 朱 洁 柯爱英 郑伊诺 吴 越 胡忠键 刘志坚 郭安托
(1. 浙江省海洋水产养殖研究所, 温州 325005; 2. 浙江省近岸水域生物资源开发与保护重点实验室, 温州 325005;3. 宁波大学, 宁波 315211; 4. 温州市渔业技术推广站, 温州 325003)
凤鲚(Coiliamystus)隶属于鲱形目(Clupeiformes), 鳀科(Engraulidae), 鲚属, 又称凤尾鱼、烤籽鱼、籽鲚, 主要分布于中国、朝鲜、日本和印度尼西亚沿海海域, 具有短距离溯河洄游产卵的繁殖习性, 繁殖期为5—8月[1]。作为低营养层次鱼类, 凤鲚主要以滤食水体中的浮游动物为生。目前国内外已有关于凤鲚生物特征[2,3]、资源分布状况[4—7]、繁殖与摄食习性[8,9]等的系列研究, 部分研究还对刀鲚和凤鲚肌肉营养成分进行了分析[10—12], 但瓯江凤鲚性腺发育规律及营养成分随性腺发育的动态变化特征尚未见报道[13,14]。掌握性腺发育规律是进行凤鲚人工繁殖的基础, 而了解其营养成分是科学指导合理膳食的前提, 因此本研究分析了不同性腺发育阶段野生瓯江凤鲚的性腺发育特征和肌肉营养成分, 以期为进一步开展瓯江凤鲚人工养殖实践等提供科学依据。
1 材料与方法
1.1 试验材料
2019年4—5月从浙江省温州市瓯江河口洄游鱼类产卵场水域(28°03′91″, 120°59′92″至27°92′11″,120°91′29″)采集繁殖期野生雌性和雄性凤鲚作为实验材料。每周采集样品30—60尾, 试验鱼体态均完好无损, 无伤病。将所有样本打上标签, 经冰鲜保存后带回实验室, 保存于−80℃冰箱中待用。
1.2 生物学指标测定
样本于–4℃解冻后, 用吸水纸擦去体表残留的水分, 在实验室低温条件下解剖, 分别辨别雌雄及其性腺成熟度, 并进行卵巢和精巢发育的形态学和组织学分期(分别对应性腺发育Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期和Ⅴ期)。对雌雄各性腺发育时期的个体进行体重、体长、性腺重量和全长指标的测定(精度分别为0.1 cm和0.01 g)。对鱼体进行解剖, 从腹腔两侧分离出性腺并称重, 按以下公式计算其性腺发育系数(Gonadosomatic index,GSI)=(性腺重/总体重)×100。
1.3 营养成分含量测定
仪器Labcono冷冻干燥器, 烘箱, 电子天平,EL-104马弗炉, 日立L-8900氨基酸分析仪, Varian 450-GC型气相色谱仪(美国瓦力安公司), Eppendorf移液器, Milestone ETHOS1微波消解系统, BUCHI凯氏定氮仪K-360, 漩涡混合仪, SB-5200DT超声波清洗机等。
试验方法将性腺发育相同时期的野生雌性和雄性风鲚(各10尾)肌肉混合后, 利用真空冷冻干燥机进行干燥, 干燥处理后的样品置于–20℃冰箱保存, 用于营养成分分析。
基本营养成分测定水分测定采用恒温常压干燥法(GB 5009.3-2010), 粗蛋白测定采用微量凯氏定氮法(GB 5009.5-2010), 粗脂肪测定采用索氏抽提法(GB/T 14772-2008), 灰分测定采用马弗炉灼烧法(GB 5009.4-2010)。
氨基酸的测定样品经酸(6 mol/L HCl)水解后,依据GB/T 5009.124-2003方法在日立L-8900高速氨基酸分析仪对风鲚进行17种氨基酸含量的测定。依据GB/T 18246-2000方法用高效液相色谱仪对风鲚进行色氨酸含量的测定。
脂肪酸的测定样品采用GB 5009.168-2016方法, 使用气相色谱仪测定脂肪酸组成, 各脂肪酸相对含量的确定采用面积归一化法。
1.4 营养品质评价方法
将所测得必需氨基酸换算成每克蛋白质中氨基酸毫克数, 根据FAP/WHO(粮食与农业组织/世界卫生组织)1973年建议的氨基酸评分标准模式(mg/g N)[15]和全鸡蛋白质的氨基酸模式(mg/g N)分别按以下公式计算氨基酸评分(AAS)、化学评分(CS)[16]:
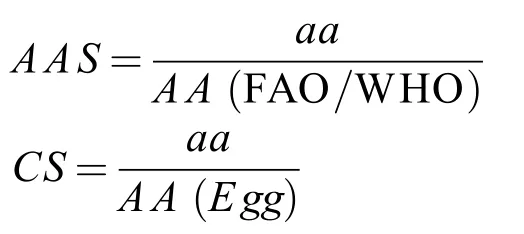
式中,aa为实验样品的必需氨基酸含量(mg/g N);AA(FAO/WHO)为FAO/WHO评分标准模式中同种氨基酸含量(mg/g N),AA(Egg)为全鸡蛋蛋白中同种氨基酸含量(mg/g N),n为比较的必需氨基酸个数,A、B、C···I为凤鲚肌肉蛋白质的必需氨基酸含量(mg/g N), AE、BE、CE···IE为全鸡蛋蛋白质的必需氨基酸含量(mg/g N)。
1.5 数据处理
数据处理采用统计分析软件SAS 9.1和Excel 2010对实验结果进行统计分析, 所有方差计算均为单因素分析(One-Way ANOVA), 结果以平均值±标准差(Means±SD)表示,P<0.05为差异显著。
2 结果与讨论
2.1 不同性腺发育阶段野生瓯江凤鲚的生物学指标及性成熟系数变化
野生瓯江凤鲚雌、雄鱼性腺发育过程中生物学指标见表1和表2。随着野生瓯江凤鲚性腺发育(Ⅰ—Ⅴ期), 雌性个体全长(19.63±1.15)—(23.40±1.54) cm, 体长(19.63±1.15)—(20.84±1.44) cm, 体重(28.70±1.83)—(49.23±7.18) g, 性腺重0—5.50 g; 雄性个体全长(15.93±0.83)—(19.96±1.55) cm, 体长(14.38±0.80)—(18.05±1.46) cm, 体重(12.25±1.58)—(25.04±5.86) g, 性腺重0—(1.24±0.40) g。在凤鲚性腺发育过程中,GSI的分析发现, 雌鱼性腺发育系数为0—(22.68±3.48)%, 雄鱼性腺发育为0—(5.07±1.68)%。
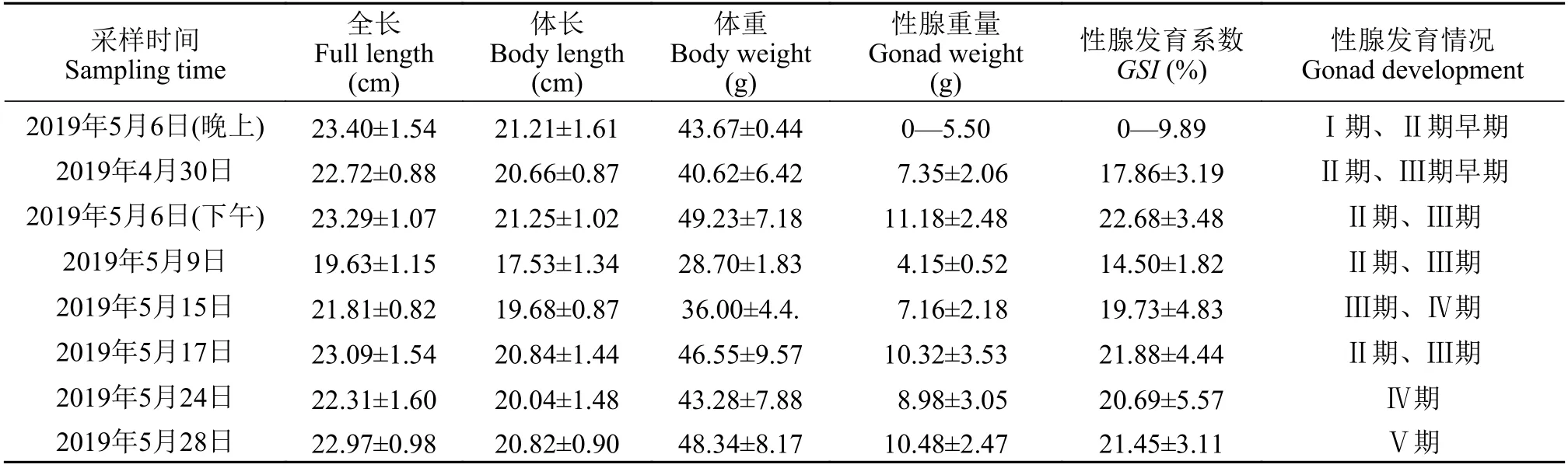
表1 不同性腺发育阶段野生瓯江雌性凤鲚的生物学指标测定Tab. 1 Basic information of female C. mystus in Oujiang River at different gonad development stages (n=30)
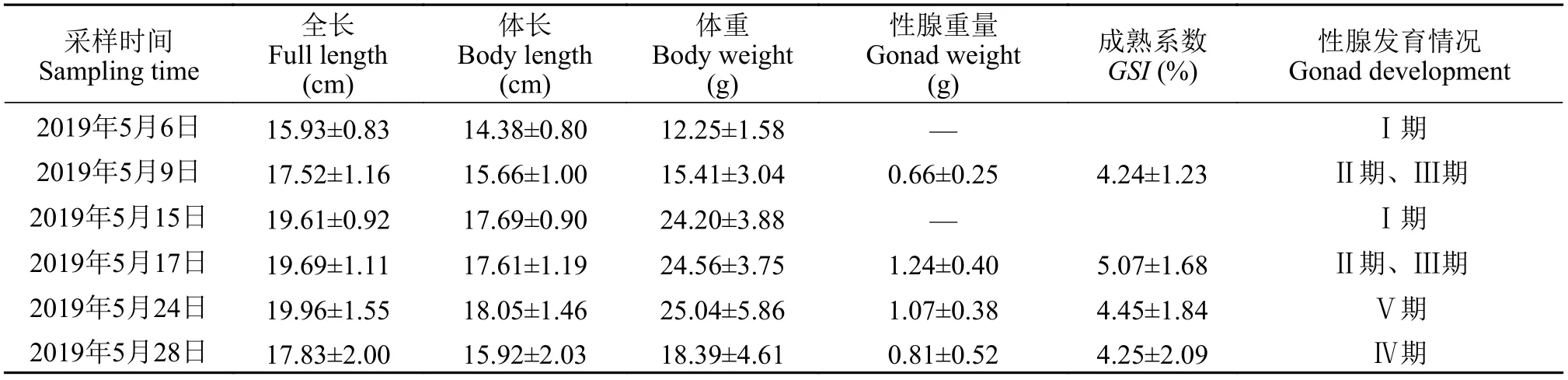
表2 不同性腺发育阶段野生瓯江雄性凤鲚的生物学指标测定Tab. 2 Basic information of male C. mystus in Oujiang River at different gonad development stages (n=30)
2.2 不同性腺发育阶段野生瓯江凤鲚肌肉基本营养成分分析
不同性腺发育阶段野生瓯江凤鲚肌肉的水分、粗蛋白、粗脂肪及灰分基本营养成分, 结果见表3。从雌鱼卵巢发育Ⅰ—Ⅴ期的过程中, 凤鲚肌肉中水分含量呈上升趋势, 为(78.77±0.62)%—(81.34±0.39)%。而从雄鱼精巢发育Ⅰ—Ⅴ期的过程中, 凤鲚肌肉中水分含量呈下降趋势, 为(81.57±0.35)%—(76.47±0.28)%。

表3 不同性腺发育阶段野生瓯江凤鲚肌肉一般营养成分比较(干质量, n=3)Tab. 3 Comparison of Nutritional components in muscle of C.mystus in Oujiang River at different gonad development stages(Dry weight, n=3)
在野生瓯江凤鲚雌鱼卵巢发育Ⅰ—Ⅴ期的过程中, 凤鲚肌肉中脂肪含量显著下降趋势, 为(15.60±0.30)%—(6.62±1.02)%, Ⅲ期的凤鲚肌肉中脂肪含量低于Ⅱ但差异不显著, 其他发育时期的下降结果均显著(P<0.05)。而野生瓯江凤鲚雄鱼精巢从发育Ⅰ—Ⅴ期的过程中, 凤鲚肌肉中脂肪含量显著上升趋势, 为(8.52±0.73)%—(20.56±1.38)%, 每一发育时期的上升结果均显著(P<0.05)。
鱼类主要以脂肪和蛋白质作为能量来源, 凤鲚肌肉中蛋白质含量变化与脂肪含量变化呈相反的趋势, 从野生瓯江雌鱼卵巢发育Ⅰ—Ⅴ期的过程中,凤鲚肌肉中蛋白质含量呈现显著上升趋势, 为(78.77±0.67)%—(86.16±0.86)%。而野生瓯江凤鲚雄鱼精巢从发育Ⅰ—Ⅴ期的过程中, 凤鲚肌肉中蛋白质含量呈显著下降趋势, 为(86.68±0.88)%—(74.78±0.35)%, 每一发育时期的下降结果均显著(P<0.05)。此外, 野生瓯江雌、雄凤鲚在性腺发育过程中灰分含量呈单峰型分布, Ⅰ—Ⅲ期呈上升趋势, Ⅲ—Ⅴ期下降。
2.3 不同性腺发育阶段野生瓯江凤鲚肌肉氨基酸组成与评价
不同性腺发育阶段野生瓯江凤鲚肌肉中均可检测出18种氨基酸, 其中含8种人体必需氨基酸(EAA)、2种半必需氨基酸(HEAA)和8种非必需氨基酸(NEAA)。由表4可知, 在野生瓯江凤鲚雌鱼卵巢发育Ⅰ—Ⅴ期过程中, 肌肉中的各个氨基酸含量呈上升趋势, 总氨基酸含量呈显著上升趋势, 为(72.55±1.79)%—(84.26±1.71)%, 与雌鱼肌肉粗蛋白的含量变化趋势一致。由表5可知, 在野生瓯江凤鲚雄鱼精巢发育Ⅰ—Ⅴ期过程中, 肌肉中的各个氨基酸含量均呈下降趋势, 总氨基酸含量显著下降趋势, 为(83.27±1.17)%—(75.29±1.05)%, 与雄鱼肌肉粗蛋白的含量变化趋势一致。
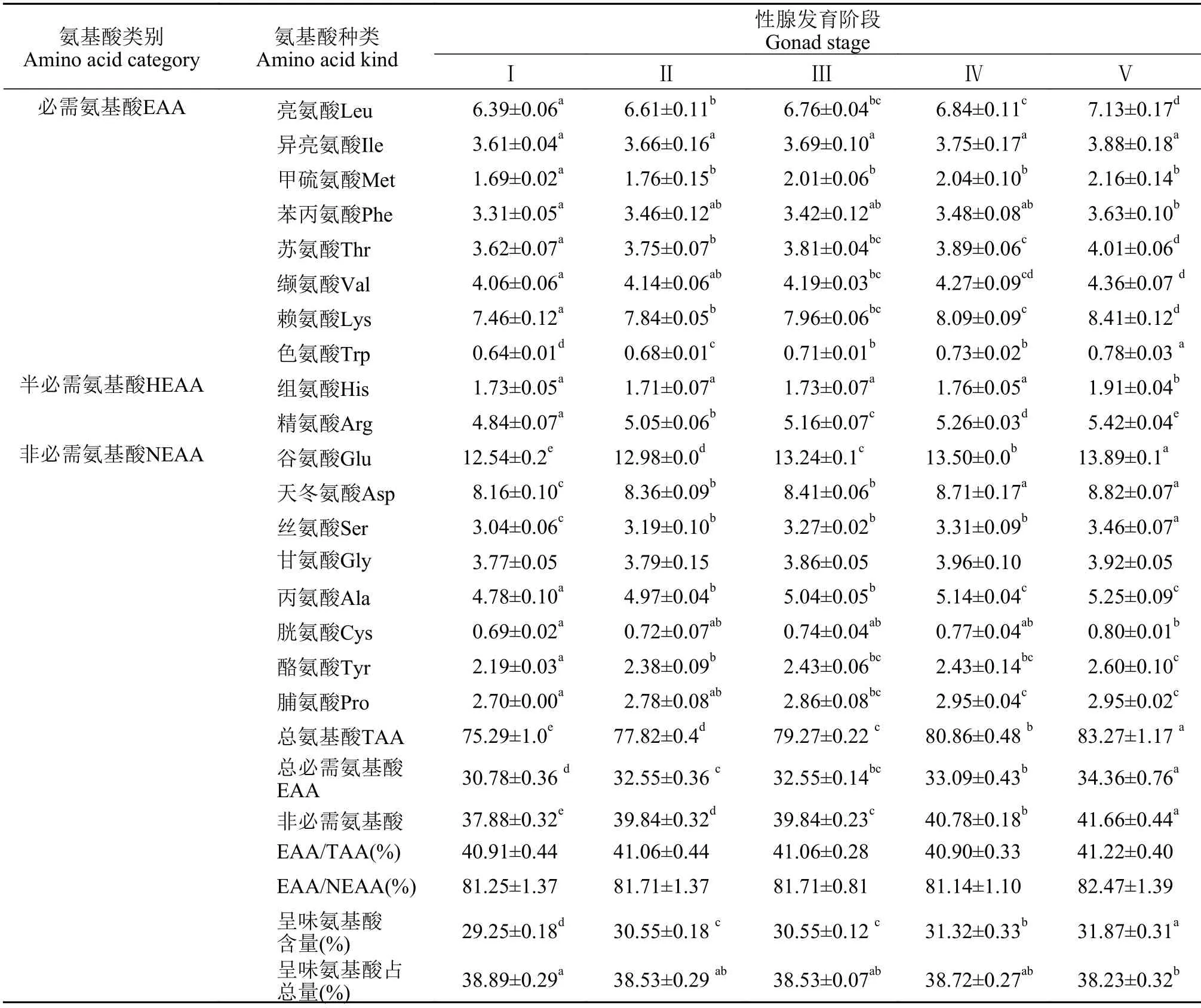
表4 不同性腺发育阶段野生瓯江凤鲚雌鱼肌肉氨基酸组成与含量(%干重)Tab. 4 The amino acid components in muscles of female C. mystus in Oujiang River at different gonad development stages (% Dry weight)

表5 不同性腺发育阶段野生瓯江凤鲚雄鱼肌肉氨基酸组成与含量(%干重)Tab. 5 The amino acid components in muscles of male C. mystus in Oujiang River at different gonad development stages (% Dry weight)
不同性腺发育阶段的野生瓯江凤鲚肌肉氨基酸组成无太大变化, 雌鱼肌肉EAA/TAA为(37.88±0.32)%—(41.66±0.44)%, EAA/NEAA为(81.14±1.10)%—(82.47±1.39)%; 雄鱼肌肉EAA/TAA为(40.30±0.69)%—(40.94±0.29)%, EAA/NEA为(79.24±2.70)%—(81.37±1.03)%。鱼肉味道的鲜美程度与鲜味氨基酸(谷氨酸Glu、天冬氨酸Asp、甘氨酸Gly和丙氨酸Ala)的组成和含量有关, 鲜味氨基酸占氨基酸总量的百分比越大, 味道也就越鲜美。野生瓯江凤鲚肌肉4种鲜味氨基酸含量高低顺序依次分别为谷氨酸>天冬氨酸>丙氨酸>甘氨酸。在野生瓯江凤鲚雌鱼卵巢发育Ⅰ—Ⅴ期过程中, 肌肉中呈味氨基酸的百分含量均呈上升趋势, 为(29.25±0.18)%—(31.87±0.31)%, 肌肉中呈味氨基酸占总量百分含量为(38.23±0.32)%—(38.89±0.29)%。在野生瓯江凤鲚雄鱼精巢发育Ⅰ—Ⅴ期中, 肌肉中呈味氨基酸含量呈下降趋势, 为(32.06±0.25)%—(28.22±0.62)%, 肌肉中呈味氨基酸含量占总量的百分含量为(38.06±0.39)%—(38.90±0.12)%。
蛋白质的营养评价要从“质“和“量”两个角度来考虑, 不仅要考虑到含量的高低, 还要考虑到蛋白质的吸收、消化程度及氨基酸的组成模式。不同发育阶段野生瓯江凤鲚肌肉的蛋白质营养价值评分见表6, 按照AAS和CS标准, 不同性腺发育阶段的野生瓯江雌、雄凤鲚肌肉中第一限制性氨基酸均为色氨酸, 肌肉第二限制性氨基酸均为甲硫氨酸(Met)和胱氨酸(Cys)。氨基酸评价系数和化学评分值随着凤鲚雌鱼卵巢发育(Ⅰ—Ⅴ期)整体呈上升趋势; 而随着雄鱼精巢发育(Ⅰ—Ⅴ期)整体呈下降趋势。
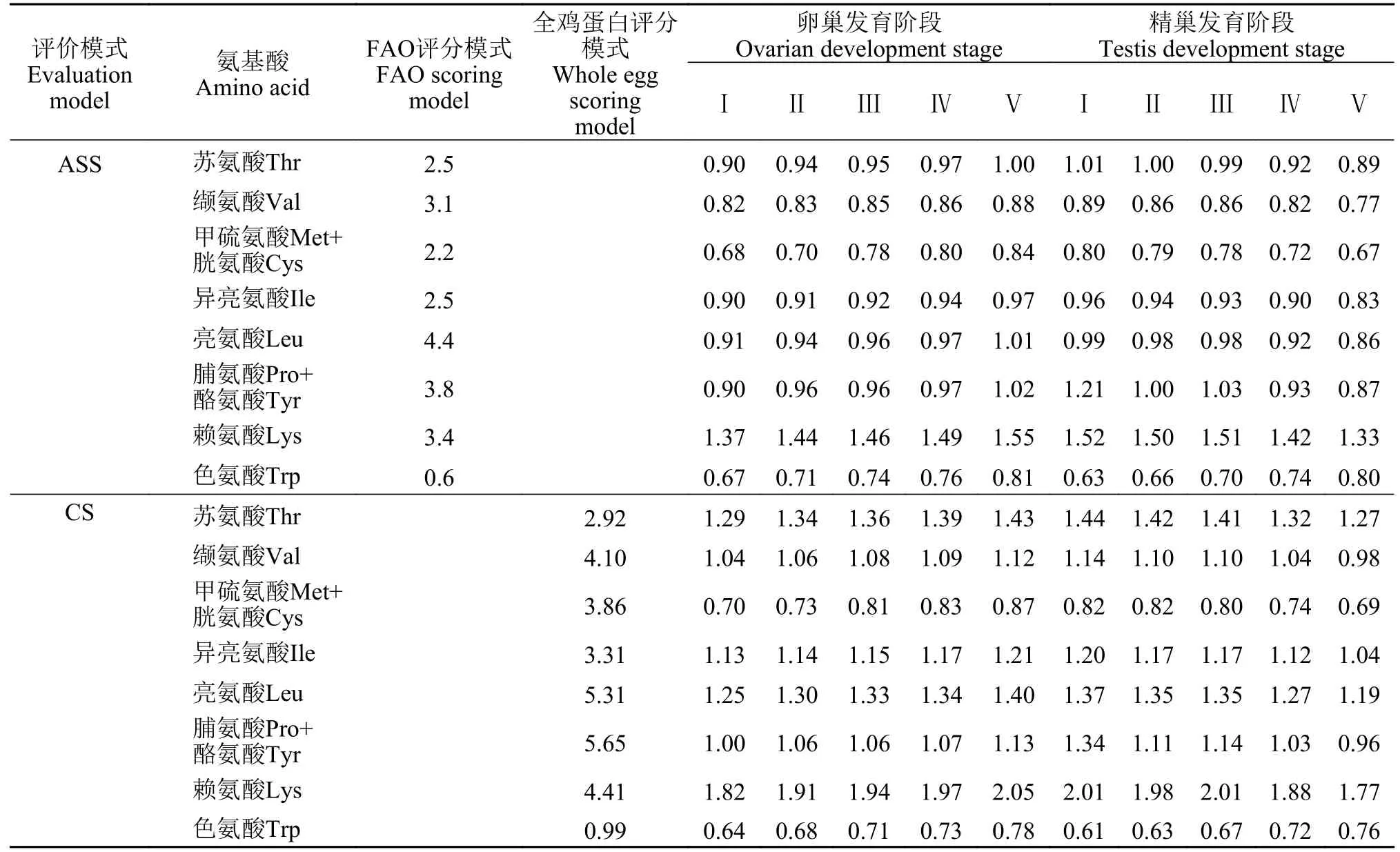
表6 不同性腺发育阶段野生瓯江凤鲚雌、雄鱼肌肉蛋白质营养价值评分Tab. 6 Protein nutrition value score in muscles of female and male C. mystus in Oujiang River at different gonad development stages
2.4 不同性腺发育阶段野生瓯江凤鲚肌肉脂肪酸组成
不同性腺发育阶段野生瓯江凤鲚雌鱼肌肉有相同种类的脂肪酸共25种, 其中饱和脂肪酸(Satu-rated fatty acid, SFA)11种, 占脂肪酸总量的44.50%—54.42%, 自Ⅰ—Ⅴ期上升了9.39%; 单不饱和脂肪酸(Unsaturated fatty acid, UFA)5种, 占脂肪酸总量的35.47%—45.93%, 自Ⅰ—Ⅴ期下降了10.46%; 多不饱和脂肪酸(Polyunsaturated fatty acid, PUFA)9种,占脂肪酸总量的7.99%—13.32%, 自Ⅰ—Ⅲ期上升了5.33%, 而自Ⅲ—Ⅴ期下降了2.85%。由图1可知,不同性腺发育阶段凤鲚雌鱼肌肉脂肪酸含量关系为∑SFA>∑MUFA>∑PUFA。

图1 性腺发育不同阶段凤鲚雌鱼肌肉的脂肪酸含量Fig. 1 The fatty acid components in muscles of of female C.mystus in Oujiang River at different gonad stages
性腺发育不同阶段的野生瓯江凤鲚雄鱼肌肉有相同种类的脂肪酸共23种, 其中∑SFA10种, 占脂肪酸总量的42.02%—48.92%, 自Ⅰ—Ⅴ期下降了6.90%; ∑UFA4种, 占脂肪酸总量的32.76%—44.74%,自Ⅰ—Ⅴ期上升了11.97%; ∑PUFA9种, 占脂肪酸总量的13.48%—18.88%, 自Ⅰ—Ⅴ期下降了5.38%。由图2可知, 不同性腺发育阶段凤鲚雄鱼肌肉脂肪酸含量关系为∑SFA>∑MUFA>∑PUFA。
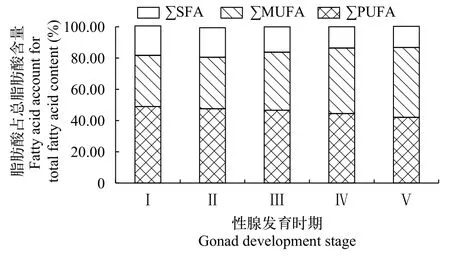
图2 不同性腺发育阶段野生瓯江凤鲚雄鱼的脂肪酸含量Fig. 2 The fatty acid components in muscles of of male C. mystus in Oujiang River at different gonad development stages
由图3和图4可知, 性腺发育不同阶段的野生瓯江凤鲚肌肉SFA中主要以C14∶0(肉豆蔻酸)、C16∶0(棕榈酸)和C18∶0(硬脂酸)为主, 雌鱼三者含量在3.42%—42.89%, 雄鱼三者含量在3.03%—48.97%。凤鲚雌鱼在Ⅰ—Ⅴ期的发育过程中, ∑SFA含量呈上升趋势, 其中肌肉C14∶0和C16∶0含量呈显著上升趋势(P<0.05), 而C180无明显的改变。凤鲚雄鱼精巢发育Ⅰ—Ⅴ期过程中, ∑SFA含量呈下降趋势, 其中肌肉C14∶0、C16∶0和C18∶0含量下降趋势明显。
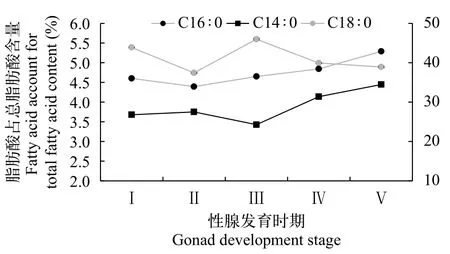
图3 不同性腺发育阶段野生瓯江凤鲚雌鱼肌肉主要饱和脂肪酸含量Fig. 3 The main saturated fatty acids contents in the muscle of female C. mystus in Oujiang River at different gonad development stages
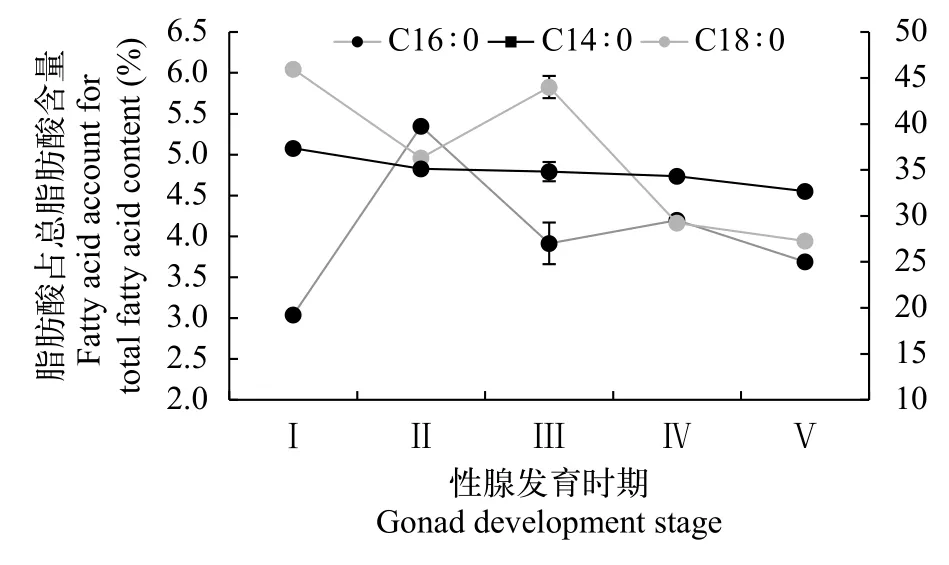
图4 不同性腺发育阶段野生瓯江凤鲚雄鱼肌肉主要饱和脂肪酸含量Fig. 4 The main saturated fatty acids contents in the muscle of male C. mystus in Oujiang River at different gonad development stages
由图5可知, 性腺发育不同阶段的野生瓯江凤鲚的肌肉MUFA中主要以C16∶1(棕榈烯酸)和C18∶1n9c(油酸)为主, 雌鱼二者含量在4.75%—38.38%, 雄鱼二者含量在4.78%—35.71%。凤鲚雌鱼在Ⅰ—Ⅴ期的发育过程中, ∑MUFA含量呈下降趋势, 其中肌肉含量较高的C18∶1n9c含量呈显著下降(P<0.05), 而C16∶1呈波动状态。在凤鲚雄鱼精巢发育Ⅰ—Ⅴ期过程中, ∑MUFA含量呈上升趋势, 其中肌肉含量较高的C18∶1n9c含量呈显著上升(P<0.05), 而C16∶1呈波动状态。
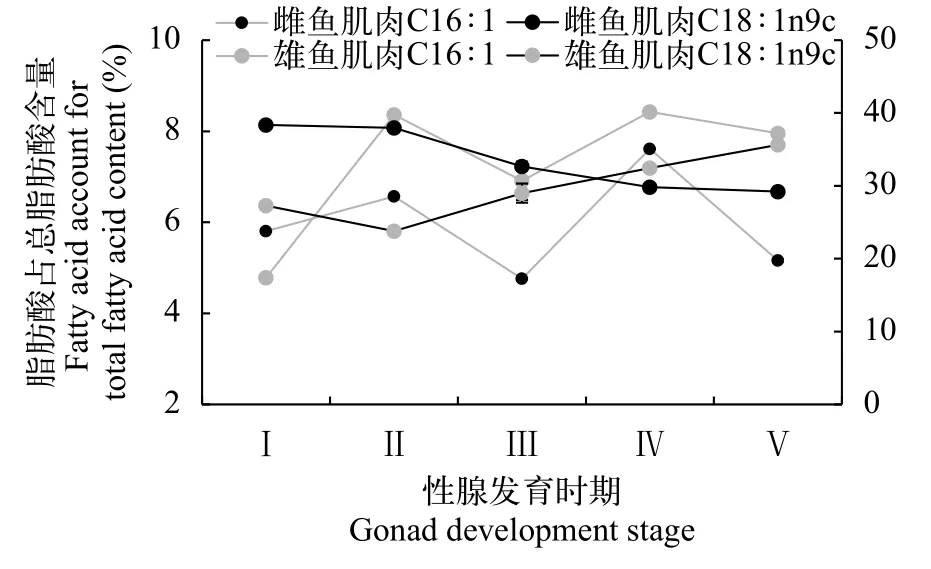
图5 不同性腺发育阶段野生瓯江凤鲚野生瓯江凤鲚肌肉主要饱和脂肪酸含量Fig. 5 The main unsaturated fatty acids contents in the muscle of C.mystus in Oujiang River at different gonad development stages
由图6可知, 性腺发育不同阶段的野生瓯江凤鲚肌肉PUFA中主要以C20∶5n3(二十碳五烯酸,EPA)和C22∶6n3(二十二碳六烯酸, DHA)为主, 雌鱼二者含量在2.25%—8.85%, 雄鱼二者含量在4.12%—12.39%。凤鲚雌鱼在Ⅰ—Ⅴ期的发育过程中, ∑PUFA含量自Ⅰ—Ⅲ期呈上升趋势, 而自Ⅲ—Ⅴ期呈下降趋势, 其中肌肉C22∶6n3含量趋势一致, 而C20∶5n3含量随着Ⅰ—Ⅳ期的发育呈显著上升趋势而Ⅴ期下降。在凤鲚雄鱼精巢发育Ⅰ—Ⅴ期过程中, ∑PUFA含量呈下降趋势, 其中肌肉C22∶6n3含量趋势一致, 著性下降(P<0.05), 而C20∶5n3含量呈波动状态。
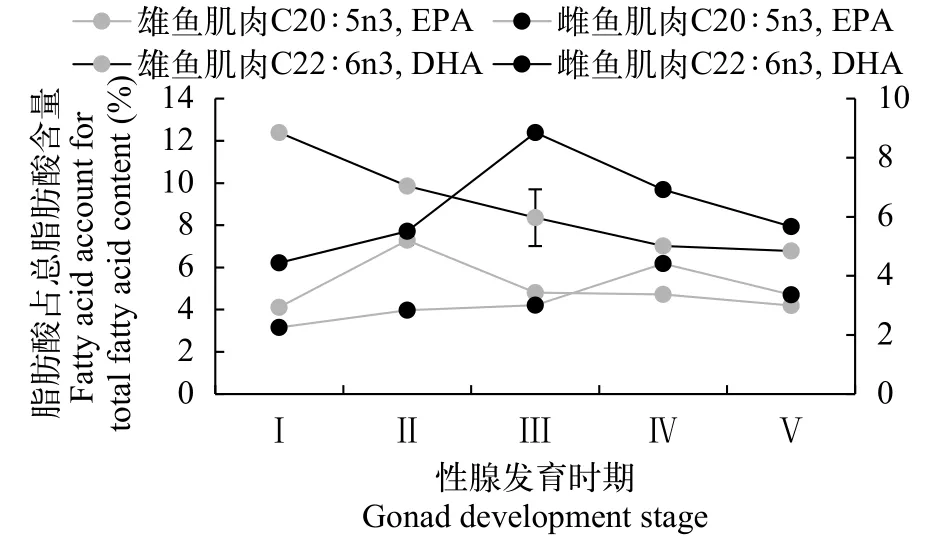
图6 不同性腺发育阶段野生瓯江凤鲚主要多不饱和脂肪酸含量Fig. 6 The main Polyunsaturated fatty acid contents in muscles of of male C. mystus in Oujiang River at different gonad development stages
3 讨论
3.1 不同性腺发育阶段野生瓯江凤鲚的性成熟系数变化规律
性腺发育系数(GSI)是衡量鱼类性腺生长、发育的数量指标之一。GSI的变化能够直接反映鱼类性腺的生长和发育情况[17], 性腺成熟系数越高, 性腺发育程度越成熟[18]。在野生瓯江凤鲚性腺发育Ⅰ—Ⅴ期中, 雌、雄鱼性成熟系数整体呈现上升趋势。单独从平均值来看, 凤鲚主要性腺发育时期卵巢的GSI值是精巢GSI值的5倍, 而且同龄雌鱼的体质量[(28.70±1.87)—(49.23±7.18) g]大于雄鱼凤鲚[(12.25±1.58)—(25.04±5.86) g], 说明在性腺发育不同阶段不仅雌鱼的生长速度要明显快于雄鱼, 而且雌鱼的性腺发育要明显快于雄鱼。此发现的结果可能原因是雌雄鱼性腺发育差异, 如太平洋鳕在繁殖期间摄食明显减少, 雌性鱼类卵巢发育所需要的能量主要由肝脏提供, 并用于卵黄蛋白合成,HSI(Hepatosomatic index, 肝体指数)和GSI之间存在密切关系。而雄性鱼类的HSI未呈明显的季节变化[19]。松江鲈鱼性腺发育过程中雌鱼进入Ⅴ期后GSI显著升高, 而雄鱼因其不存在卵黄蛋白合成的问题,GSI会呈现与雌鱼完全相反的趋势[20]。
3.2 不同性腺发育阶段野生瓯江凤鲚雌雄鱼肌肉营养组成的变化规律及比较
水分是动物体组成比例最大的组成部分, 动物体内水分含量波动趋势在一定程度上可以反映出整体代谢水平[21]。凤鲚雌鱼肉中水分含量从Ⅰ—Ⅴ期不断增加, 在Ⅴ期达到水分含量最高(81.34±0.39)%显著高于Ⅰ期(78.77±0.62)%(P<0.05), 预示着在性腺发育过程中鱼体代谢强度不断增强。而凤鲚雄鱼肉中从Ⅰ—Ⅴ期不断减少, 在Ⅴ期达到水分含量最低(76.47±0.28)%显著低于Ⅰ期(81.57±0.35)%(P<0.05)。这说明野生瓯江凤鲚雌鱼在进入生殖后期逐渐减少摄食的阶段, 能量主要来源前期积累的肝糖原, 用于卵黄积累提高整体代谢水平。长江刀鲚(Yangtze RiverCoilia ectenes)鱼肉中水分含量在Ⅱ—Ⅴ期不断增加, 在Ⅴ期达到最高, 预示着在性腺发育过程中鱼体代谢强度不断增强[21]。
脂肪积累的程度将是决定鱼类开始生殖洄游的关键因素, 这些脂肪将提供它们在以后的生殖洄游期间性腺发育、基础代谢及洄游所需的能量等一切需要[22—24]。在野生瓯江凤鲚雌鱼卵巢发育Ⅰ—Ⅴ期的过程中, 凤鲚肌肉中脂肪含量呈现显著下降趋势(P<0.05), 肌肉中蛋白质含量呈显著上升趋势(P<0.05)。吴利红等[25]研究表明凤鲚和刀鲚雌鱼在性腺发育早期躯干部都聚集了91%以上的体内脂肪。长江刀鲚进入河口以后不再进食, 而是依靠体内积累的能量(脂肪)完成整个生殖洄游导致鱼肉中脂肪含量的逐渐下降[26]。这说明短距离溯河洄游产卵繁殖习的性凤鲚, 体内大部分脂肪用于性腺发育, 躯干脂肪很快消耗的现象。
蛋白质营养价值主要取决于必需氨基酸的种类、数量和组成比例。在野生瓯江雌、雄凤鲚性腺发育(Ⅰ—Ⅴ期)过程中, 肌肉EAA/TAA分别为(37.88±0.32)%—(41.66±0.44)%、(40.30 ±0.69)%—(40.94±0.29)%, 肌肉EAA/NEEA分别为(81.14±1.10)%—(82.47±1.39)%、(79.24 ±2.70)%—(81.37±1.03)%。根据FAO/WHO的理想模式, 质量较好的蛋白质其组成的氨基酸EAA/TAA为40%左右, EAA/NEAA则在60%以上[27]。长江口凤鲚群体肌肉和卵巢必需氨基酸占氨基酸总量比例为40.06%和42.89%[12]。不同性腺发育阶段野生瓯江凤鲚雌、雄鱼肌肉氨基酸组成无太大变化, 说明不同性别及发育阶段的野生瓯江凤鲚肌肉组织的氨基酸组成较为恒定, 反映了物种氨基酸组成的保守性[28]。此外, 性腺发育不同阶段雌、雄凤鲚肌肉中含量较高的氨基酸为Glu、Asp和Lys, 而Trp、His和Cys含量较低, 这含量特征与凤鲚肌肉和刀鲚、湖鲚肌肉中的含量基本一致[13]。
野生瓯江凤鲚雌鱼肌肉中呈味氨基酸含量随着性腺发育(Ⅰ—Ⅴ期)呈增加趋势[(29.25±0.18)%—(31.87±0.31)%](P<0.05), 雄鱼肌肉中呈味氨基酸含量随着性腺发育(Ⅰ—Ⅴ期)呈下降趋势[(32.06±0.25)%(28.22±0.62)%](P<0.05)。野生与养殖长江刀鲚、海水刀鲚及太湖刀鲚的呈味氨基酸含量丰富, 海水刀鲚39.81%, 野生长江刀鲚39.74%, 养殖长江刀鲚39.31%, 太湖刀鲚38. 57%[29—31]。
蛋白质营养价值的高低取决于必需氨基酸的含量和组成的比例, 氨基酸评分(AAS)和化学评分(CS)从不同的角度反映了蛋白质构成和利用率的关系。一种营养价值较高的食物蛋白质所含的必需氨基酸种类不仅要齐全, 而且必需氨基酸之间的比例也是适宜, 最好能与人体需要相符合, 这样必需氨基酸吸收最完全, 营养价值最高。两种评分模式都是Lys的值最高, 野生瓯江凤鲚雌鱼肌肉Lys营养价值评分为1.37—2.05; 野生瓯江凤鲚雄鱼肌肉Lys营养价值评分为1.33—2.01。
生殖营养学是水生动物营养学研究中的重点研究领域之一[32,33], 脂肪酸营养已成为鱼类生殖营养学研究中的热点之一, 特别在鱼类生殖调控方面具有重要的生理作用[34], 组织中重要脂肪酸如DHA和EPA含量高低能直接影响鱼类的繁殖性能或繁殖力[35]。在野生瓯江凤鲚精巢发育Ⅰ—Ⅴ期中, ∑SFA含量呈显著性下降趋势, 其中主要的脂肪酸C14∶0、C16∶0和C18∶0趋势一致。C16∶0在美国西鲱雌性亲鱼[36]和淡水鳗(Anguillaspp.)[37]卵巢发育过程中发挥着机体能量代谢、转移和利用的重要作用。在野生瓯江凤鲚精巢发育Ⅰ—Ⅴ期中∑MUFA含量呈显著性下降趋势, 其中主要的脂肪酸C18∶1n9c趋势一致。这说明MUFA被认为是优先被分解为机体提供能量的脂肪酸[38], 其中2种主要脂肪酸在瓯江凤鲚生殖洄游过程中主要的供能脂肪酸。长江刀鲚[39]和日本鳗鲡[40]雌性个体MUFA的C16 ∶1和C18∶1在生殖洄游过程中的性腺发育和基础代谢有很大关系。太平洋鲱在性腺发育前期作为能量代谢主要成分C18 ∶1n-9含量较高, 而繁殖期耗尽了C18∶1n-9的储备并优先转移用于合成卵巢相关物质和能量代谢[36]。野生瓯江凤鲚雌鱼肌肉脂肪酸种类高于雄鱼, 野生瓯江凤鲚雌鱼肌肉DHA呈先上升(Ⅰ—Ⅲ期)后下降(Ⅲ—Ⅴ期)趋势,推测可能的原因是在性腺发育过程中, 机体会先合成使其产生、积累在鱼肉中, 产卵时转移至卵巢供产卵所需, 影响卵子质量、排卵和胚胎发育具有重要影响。野生雌性沙丁鱼(Saradina melamosticta)卵细胞的MUFAs和PUFAs的含量高度依赖于肌肉脂肪酸的贮存[41]。美洲沙鱼(Alos asapidissima)在卵巢发育过程中, 肌肉大量的EPA、DHA和ARA向卵巢转移[42]。长江下游雌性刀鲚生殖洄游过程中脂肪酸与繁殖活动关系密切, 肌肉中 C18∶1n9c下降了86.36%, 卵巢中则增加了2.62 倍; 肌肉中 DHA含量减少了 2.6 倍, 而卵巢中却增加了近 3 倍[39]。美国西鲱[31]雌性亲鱼卵巢发育过程(Ⅱ—Ⅵ期)肝脏、肌肉DHA下降而卵巢DHA含量上升, 而EPA含量保持相对稳定。野生瓯江凤鲚雄鱼肌肉DHA含量呈下降趋势, 下降了45%。Baeza等[43]饲料中EPA和DHA在欧洲鳗鲡雄鱼亲鱼性腺发育过程中调节雄激素的合成, 特别是精子最后的成熟阶段。
