草鱼TP53INP1基因的克隆及微囊藻毒素对其表达的影响
2021-07-17阮记明梁惜梅林长高隗黎丽
刘 林 周 颖 阮记明 梁惜梅 林长高 何 丽 隗黎丽
(江西农业大学动物科学技术学院, 南昌 330045)
肿瘤蛋白p53诱导核蛋白1(Tumor protein 53-induced nuclear protein 1,TP53INP1)是p53的靶基因, 与肿瘤发生和进展有密切关系[1]。TP53INP1在1990年末先后被3个不同的实验室独立鉴定并报道,最早是在小鼠胸腺中发现, 当时命名为胸腺表达酸性蛋白(Thymus-expressed acidic protein,TEAP)[2],随后Tomasini等[3]在患胰腺炎的小鼠(Mus musculus)中发现该蛋白, 并将其命名为应激诱导蛋白(Stress-induced protein,SIP), 同年, Okamura等[4]发现p53在细胞损伤反应中可诱导一种蛋白大量表达,并将其命名为p53依赖损伤诱导核蛋白1(p53-dependent damage-inducible nuclear protein 1,p53DINP1)。2002年, 人类基因组基因命名委员会提出将TEAP、SIP和p53DINP1统一命名为TP53INP1。
尽管鱼类TP53INP1基因序列在NCBI数据库中已有登录, 但没有相关的文章对其分子结构、组织分布及多克隆抗体等进行研究, 尤其是缺少环境污染物对其表达影响的相关研究。微囊藻毒素(Microcystins, MCs)是淡水富营养化过程中最常见的蓝藻毒素, 在中国、美国及其他许多国家的水体中都检测到不同水平的MCs污染[5—7]。MCs结构的变体多达100余种, 其中微囊藻毒素-LR (Microcystin-LR, MC-LR)是目前研究最多、毒性最强、危害最严重的一种MCs[8]。目前, 已有大量研究表明, MCs可能是潜在的致癌物[9], 越来越多的流行病学研究也表明, 饮用水中MC-LR的污染与人类肝癌的发生密切相关[10]。根据报道可知MCs促进肿瘤的机制与抑制蛋白磷酸酶(PP1和PP2A)有关[11], 而原癌基因的过表达和抑癌基因的抑制可能与肿瘤发生发展也有关[9], TP53INP1作为一个与肿瘤的发生发展有密切关系的蛋白, 研究MC-LR对TP53INP1蛋白表达的影响将有助于进一步提高对MC-LR毒性及其潜在的致癌性的认识[12]。
本研究在前期对草鱼(Ctenopharygodon idella)转录组测序的基础上[13], 采用cDNA末端快速克隆技术(RACE), 对草鱼TP53INP1基因进行克隆, 构建pET32a-TP53INP1原核表达载体, 表达TP53INP1融合蛋白, 同时, 制备了草鱼TP53INP1蛋白多克隆抗体, 并采用Western blot研究了草鱼TP53INP1蛋白在MC-LR胁迫下的表达变化, 以期为进一步研究TP53INP1蛋白在MC-LR致鱼类毒性机制中的作用提供理论基础。
1 材料与方法
1.1 实验试剂
间氨基苯甲酸乙酯甲烷磺酸盐(MS-222)购于Sigma公司, RNA提取试剂盒为Invitrogen公司产品,用于RACE扩增的cDNA反转录试剂盒Super SMARTTMPCR cDNA Synthesis Kit及进行RACE扩增的SMARTTMcDNA Amplication Kit试剂盒购于Clontech公司, 逆转录试剂盒RevertAidTMFirst Strand cDNA Synthesis Kit及荧光定量PCR的SYBR Green Real-time PCR Master Mix购于Promeaga公司, 限制性内切酶EcoR Ⅰ和XhoⅠ购自NEB公司, 凝胶纯化回收试剂盒、Taq酶、T4 DNA连接酶、Maker等购自TaKaRa公司, Bradford蛋白定量试剂盒、SDSPAGE所需试剂及组织蛋白抽提试剂盒等购自北京索莱宝, PVDF膜(0.22 μm)为Millipore公司产品;HRP标记山羊抗兔IgG购自生工生物工程有限公司,GAPDH(兔抗)购于武汉赛维尔生物科技有限公司,其他试剂如氯仿、无水乙醇和异丙醇等为中国国药分析纯产品。
1.2 方法
草鱼TP53INP1基因cDNA全长的克隆根据转录组测序数据获得的草鱼TP53INP1基因序列,利用Primer Premier 5.0设计中间片段扩增引物(TP53INP1-MF: 5′-ATGTTCCAGAGGTTCACC-3′,TP53INP1-MR: 5′-TCAGTAGTTGTACTGCCT-3′)。分离健康草鱼肝脏, 采用Super SMARTTMPCR cDNA Synthesis Kit反转录试剂盒合成cDNA模板,随后用该模板进行PCR扩增, 进行胶回收和测序,比对分析获得草鱼TP53INP1中间序列。再根据这一序列设计5′RACE扩增引物(RC5-1: 5′-GGCC TTCGCTAGATAA-3′, RC5-2: 5′-GCCTTGCACC TAGATA-3′, RC5-3: 5′-ATCCACTCATCGTCC TCC-3′)和3′RACE扩增引物(RC3-1: 5′-GAGCAG ACCAAGAACGTCCGCC-3′, RC3-2: 5′-CTGTC TCGCAACGCCCTTCGCC-3′), 按照SMARTTMcDNA Amplication Kit说明书推荐的反应体系及反应条件进行5′ RACE和3′RACE扩增, 分别获得5′和3′末端序列, 再与中间序列拼接得到全长cDNA序列。
草鱼TP53INP1基因序列分析及系统发育树的构建生物信息学在线工具分析草鱼TP53INP1基因。在NCBI(ORF finder, https://www.ncbi.nlm.nih.gov/orffinder/)上查找开放阅读框, 蛋白质理化性质在http://us.expasy.org/tools/protparam.Html上进行分析, 信号肽预测和跨膜结构分别在http://www.cbs.dtu.dk/services/SignalP-4.1和http://www.sbg.bio.ic.ac.uk/phyre2/上进行分析, 结构域在http://www.ebi.ac.uk/interpro/search/sequence-search上进行分析, PEST序列在http://emboss.bioinformatics.nl/cgi-bin/emboss/epestfind上进行分析。系统发育树则采用Mega7.0软件的NJ法进行构建, 在建树之前氨基酸序列的比对用ClustalW1.81软件。
草鱼TP53INP1基因的组织表达特征分析分别取5尾健康草鱼[体重: (650±131.53) g; 体长: (38.24±2.53) cm; 约24月龄], 通过尾静脉采血, 分离肝脏、脾脏、肠道、体肾、头肾、心脏、皮肤、肌肉、鳃和脑提取RNA, 采用RevertAidTMFirst Strand cDNA Synthesis Kit进行反转录。根据获得的草鱼TP53INP1基因设计荧光定量引物(F: 5′-TCAAC GAGAAGGAGGAGGACGA-3′, R: 5′-CAGAGAG GAGCAGGAGGAGCAG-3′), 使用quantitative Realtime PCR (qRT-PCR)方法检测草鱼TP53INP1在不同组织中的表达水平。qRT-PCR采用CFX96 Touch™Real-Time PCR Detection System, 15 μL反应体系包括: 7.5 μL SYBR Green Real-time PCR Master Mix,2.0 μL cDNA模板(10倍稀释), 上下游引物各0.3 μL(10 μmol/L)和4.9 μL ddH2O。反应程序为: 95℃变性3min; 95℃ 10s, 58℃ 15s, 72℃ 20s, 40个循环后,72℃延伸5min。以草鱼β-actin(F: 5′-CACTGTGC CCATCTACGA-3′, R: 5′-CCATCTCCTGCTC GAAGTC-3′)作为内参基因进行校正, 采用2−ΔΔCt法计算TP53INP1基因的相对表达量。
草鱼TP53INP1原核表达载体构建及多克隆抗体制备选择重组表达蛋白表达载体pET-32a,对载体和TP53INP1的序列的限制性酶切位点进行分析, 选择EcoR Ⅰ和XhoⅠ作为载体构建的连接位点, 在TP53INP1的141—242aa这段序列内设计添加EcoR Ⅰ和XhoⅠ限制性酶切位点(下划线标出)的引物 (F: 5′-CGGAATTCAGCCCTCGTCAACGAC CA-3′, R: 5′-CCGCTCGAGGTAGTTGTACTGCC TCTG-3′)。目的片段与pMD18-T连接, 转化大肠杆菌DH5α, 随机挑选菌落送生工生物工程(上海)股份有限公司测序验证。提取测序正确的pMD18-TTP53INP1和pET-32a载体质粒, 分别用EcoR Ⅰ和XhoⅠ双酶切, 琼脂糖凝胶电泳检测, 酶切产物经纯化后, 将TP53INP1连接至pET-32a载体, 将连接产物pET-32a-TP53INP1转化至BL21中, 挑选阳性菌落再次测序验证, 获得pET-32a-TP53INP1原核表达载体。将测序正确的菌液继续培养, 加入0.8 mmol/L异丙基硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranosidem, IPTG)在37℃诱导4h, 将诱导完的菌液用超声波破碎, 分离上清与沉淀, 进行SDS-PAGE分析, 然后将从上清获得的蛋白进行纯化。随后通过皮下注射纯化的重组蛋白免疫新西兰兔子, 共免疫4次(分别于第1、第12、第26和第40天注射), 兔子于第一次免疫76d后采血获得抗血清, 抗血清用pET-32a-TP53INP1作为抗原亲和纯化, 随后将获得的抗体按1∶1000稀释进行抗体特异性检测分析, 剩余的抗体置于–80℃保存备用。
微囊藻毒素对草鱼TP53INP1蛋白的影响购买的健康草鱼[体重: (22.13±2.17) g; 体长: (12.09±1.33) cm, 约5月龄] 在实验室暂养2周后分组注射MC-LR, 剂量分别为25、75和100 μg MC-LR/kg BW, 对照组每尾草鱼经腹腔注射等量的0.80%的生理盐水。在注射MC-LR 96h后, 分别从实验组和对照组中各取3尾鱼分离肝脏提取蛋白。蛋白样品经12% SDS-PAGE电泳后, 采用电转移系统转移至PVDF膜(Millipore)上, 于5%的脱脂牛奶中封闭2h。加入1∶1000稀释的一抗[上述制备的TP53INP1抗体或内参兔多抗GAPDH(武汉博士德生物工程有限公司)], 4℃孵育过夜。次日将膜取出后, 用TBST(武汉塞维尔生物科技有限公司)洗涤3次(每次10min), 然后在1∶3000倍稀释的HRP标记山羊抗兔的二抗 (武汉塞维尔生物科技有限公司) 中孵育, 再次用TBST洗涤3次(每次10min), 采用ELC(武汉塞维尔生物科技有限公司)化学发光法检测并拍照。采用AlphaEase FC软件对蛋白条带进行定量分析。
1.3 数据分析
实验数据均以平均值±标准差表示, 并采用One-way ANOVA (SPSS 16.0)进行分析, 统计学显著性水平设定P<0.05表示差异显著。
2 结果
2.1 草鱼TP53INP1基因全长cDNA序列特征分析
克隆获得草鱼TP53INP1基因全长1154 bp, 包括5′非编码区和3′非编码区, 分别为179和216 bp, 开放阅读框(Open reading frame, ORF)为759 bp, 其在GenBank上的登录号为MG797689。对其编码氨基酸序列预测分析, 发现草鱼TP53INP1编码252个氨基酸, 属于β类型, 分子量为27.72 kD, 理论等电点为5.13。采用signalP4.1和InterPro在线分析表明草鱼TP53INP1蛋白质没有信号肽和跨膜结构。使用Epestfind在线软件预测分析发现草鱼TP53INP1蛋白存在4个PEST结构(Poor), 得分低于阈值(5.0), 分别位于14—39、53—79、101—125和125—142aa处。
2.2 草鱼TP53INP1氨基酸同源性与系统进化分析
草鱼TP53INP1氨基酸序列与鲤形目鲤科的鱇浪白鱼(Anabarilius grahami)相似性和一致性分别达到了99%和98%, 与斑马鱼(Danio rerio)的相似性和一致性分别达到了93%和96%, 与人(Homo sapiens)和小鼠TP53INP1 α型的相似性分别达到了63%和58%、与β型的相似性分别为59%和55%。
构建的系统进化树结果(图1)显示, 草鱼TP53INP1与鱼类的TP53INP1的β类型聚为一大支, 哺乳动物TP53INP1的α和β类型聚为一支。其中, 草鱼TP53INP1蛋白与鱇浪白鱼的TP53INP1亲缘关系最近。

图1 TP53INP1的系统进化树Fig. 1 Phylogenetic analysis of TP53INP1
2.3 草鱼TP53INP1基因组织分布特征分析
qRT-PCR分析发现TP53INP1基因在所有检测的组织中均有表达(图2), 在肝脏中的表达量最为丰富, 其次为血液和肠道等, 在头肾中表达量相对较低。TP53INP1基因在肝脏中的表达量相对于头肾表达量的倍数为27.83, 显著高于在头肾中的表达量(P<0.05), 此外,TP53INP1基因在血液(22.04倍)、肠道(20.81倍)、心脏(16.56倍)、肌肉(16.50倍)和鳃(13.64倍)中的表达量也显著高于在头肾中的表达量(P<0.05)。

图2 草鱼TP53INP1基因在不同组织中的表达Fig. 2 The expression of TP53INP1 gene in different tissues of grass carp
2.4 草鱼TP53INP1融合蛋白的表达与纯化
SDS-PASGE检测分析, 发现在39 kD左右位置产生目的蛋白条带(图3)。再通过可溶性分析, 发现该蛋白在上清中表达, 也可以包涵体的形式存在。上清经过标签纯化后, 获得的蛋白浓度为3 mg/mL。

图3 草鱼TP53INP1重组蛋白的表达及纯化Fig. 3 Expression and purification of the recombinant TP53INP1 in grass carp
2.5 草鱼TP53INP1多克隆抗体的免疫鉴定
采血收集血清, 获得草鱼TP53INP1的多克隆抗体,进行Western blot分析, 得到1条约39 kD的条带与预期蛋白大小一致, 表明本研究获得的草鱼TP53INP1多克隆抗体具有一定的特异性(图4)。
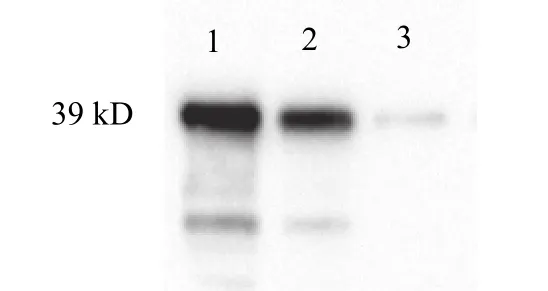
图4 Western blot检测草鱼TP53INP1多克隆抗体的特异性Fig. 4 The specificity of anti-TP53INP1 polyclonal antibody by western blot
2.6 微囊藻毒素-LR对草鱼肝脏TP53INP1蛋白表达的影响
Western blot检测发现草鱼TP53INP1蛋白在100 μg MC-LR/kg BW剂量组中显著抑制, 其他剂量组也有不同程度的抑制(图5A)。以AlphaEase FC软件对蛋白条带进行分析发现, 对照组、25 μg MC-LR/kg BW剂量组、75 μg MC-LR/kg BW剂量组和100 μg MC-LR/kg BW剂量组中TP53INP1蛋白相对于内参蛋白GAPDH的表达量分别为0.59倍、0.57倍、0.44倍和0.07倍, 其中, TP53INP1蛋白在100 μg MC-LR/kg BW剂量组中的表达相对于对照组中的表达差异显著(P<0.05; 图5B)。

图5 微囊藻毒素-LR对草鱼肝脏TP53INP1蛋白表达的影响Fig. 5 The effect of MC-LR on the expression of liver TP53INP1 protein from grass carp
3 讨论
TP53INP1由Okamura等[2]在小鼠的胸腺中首次发现并报道后, 其他学者进一步研究发现,TP53INP1基因被选择性剪切后, 有2种转录本, 可编码2种不同蛋白异构体, 分别为TP53INP1α和TP53INP1β(分子量分别为18和27 kD)[3]。根据结构和分子量分析可知, 本研究获得的TP53INP1基因属于β类型。但有研究表明, α和β类型TP53INP1在功能上差别不大[14]。TP53INP1氨基末端部分包含一个异常的PEST序列, 具有短寿命的蛋白质的特征[3,4]。PEST序列是指富含脯氨酸(P)、谷氨酸(E)、丝氨酸(S)和苏氨酸(T)残基。根据PEST序列假说, 含有该序列的蛋白质在细胞内可能通过由蛋白体或钙蛋白酶介导的途径进行降解, 因此胞内半衰期较短[15]。采用Epestfind在线软件预测时, 有效的PEST结构依据分值高低可分为PEST motif(Symbols)、Potential(+++++)和Poor(00000)三类, 草鱼TP53INP1的PEST序列的预测结果显示其存在4个Poor PEST, 即不存在明显的PEST结构, 这与哺乳动物的TP53INP1的特征不太一致[3,4]。但与Ex-PASy在线序列分析工具(http://www.expasy. ch/tools/protparam.html) 分析的结果比较吻合, 其预测结果显示TP53INP1在哺乳动物中的半衰期为30h, 在酵母和大肠杆菌中的半衰期分布大于20h和10h, 不稳定指数为66.33, 这说明TP53INP1在草鱼中具有稳定的胞内结构。
分析TP53INP1在不同组织中的分布特征发现,该基因在草鱼中广泛表达, 在肝脏、血液、肠道、心脏、肌肉和鳃等组织中表达比较丰富, 而在头肾等其他组织中表达较低。这与TP53INP1在哺乳动物中的组织表达分布不太一致, Tomasini等[3]研究发现TP53INP1基因在健康大鼠胸腺、心脏和睾丸表达丰富, 而在胰腺和胃中表达低, 这可能与不同的物种有关。
TP53INP1蛋白在肿瘤中的作用与肿瘤类型相关, 其既能促进肿瘤的发生发展, 也能抑制肿瘤细胞的增殖[1]。但更多的研究证明TP53INP1是一个抑癌蛋白, 可抑制肿瘤的发展, 如有研究发现TP53INP1蛋白表达缺失可引起其他促肿瘤过程,如肝脏细胞中诱导上皮细胞间质转型和肿瘤干细胞[16], 因此, TP53INP1蛋白的表达在肿瘤细胞中可能发挥肿瘤抑制功能。TP53INP1蛋白在大多数肿瘤组织中表达会下调, 如在人类的食管癌[17]和胃癌[18]等中表达降低。最近有研究表明, TP53INP1蛋白在人类的肝癌组织中表达也明显下降, 并建议将TP53INP1蛋白作为诊断肝癌的一个指标[1]。在我们先前对斑马鱼的研究发现, TP53INP1蛋白在MCLR染毒6h后, 其在肝脏中表达明显上调, 随着时间的延长, 其表达逐渐下降[19]。本研究通过实验室制备的TP53INP1蛋白多克隆抗体, 采用Western blot检测分析经MC-LR诱导96h后的草鱼肝脏蛋白, 发现TP53INP1蛋白在25和75 μg MC-LR/kg BW剂量组表达变化不明显, 但在100 μg MC-LR/kg BW剂量组中的草鱼肝脏TP53INP1蛋白明显下调, 这与转录组测序的结果也是一致的(未发表数据), 但TP53INP1蛋白是否与MC-LR促进了肝癌的发生从而导致其表达下降还需要进一步的实验进行验证。研究抑癌基因表达的变化, 有助于提高对MCLR毒性及其潜在的致癌性的认识[12], 因此, 今后对TP53INP1蛋白与MC-LR诱导肿瘤产生的关系及调控机制还需进一步研究。
