三华李果坯发酵液中腐败真菌分离鉴定、相关抑菌剂效价评定及发酵工艺优化
2021-07-17黄志钰沈雪玉陈珣琳郭卓钊
黄志钰,沈雪玉,陈珣琳,郭卓钊,黄 苇,*
(1.华南农业大学食品学院,广东广州 510642;2.广东正一品生物科技股份有限公司,广东广州 515638)
三华李作为华南地区特色优质水果[1],具有维生素、有机酸和氨基酸等多种营养成分[2],是广式蜜饯凉果的主要原料之一。然而,鲜果采后由于自身带有大量的细菌、霉菌和酵母菌而不耐贮藏。导致水果采后腐败的常见微生物有青霉属(Penicilliumspp.)、炭疽菌属(Colletotrichumspp.)、链格孢属(Alternariaspp.)、褐腐菌属(Moniliniaspp.)、毛霉属(Mucorspp.)以及根霉属(Rhizopusspp.)等[3]。此外不同地区的水果优势腐败菌也不同。黄月[4]从新鲜三华李果表面分离出4 株优势腐败菌,分别为汉逊德巴利氏酵母、巴斯德毕赤酵母、胶红酵母以及枝孢霉菌。
传统广式蜜饯凉果加工常采用高盐硫藏工艺,以低成本保藏的三华李果坯作为原料,保证生产周年进行,但容易出现果坯硫残超标、废液污染环境等问题[5−7]。为了改善现状,有研究者以乳酸菌作为发酵菌种,进行了三华李果坯发酵保藏工艺的研究[8−9]。然而该工艺尚不完善,发酵液表面容易出现白色菌膜,导致果坯软烂、产生异味等发酵异常的情况。
添加抑菌剂是防止食品腐败变质的常用方法。山梨酸及其钾盐是公认的安全高效食品抑菌剂,能较好地抑制霉菌、酵母菌及好氧型细菌的生长繁殖[10]。二甲基二碳酸盐能在常温和低温环境中发挥较强的杀菌作用,对酵母菌杀灭作用强于细菌和霉菌,安全性高[11−13]。纳他霉素作为食品中最常用的天然抑菌剂,具有广谱抗真菌性,已获得广泛应用[14−15]。由于不同抑菌剂的抑菌效力不同,且单一抑菌剂具有局限性,故在实际生产中,常采用多种抑菌剂复配使用,通过协同作用来提高抑菌效力[16]。
本文在前人研究基础上,分析导致三华李果坯乳酸菌发酵异常的原因,从发酵液中分离并鉴定导致发酵异常的优势腐败菌,并有针对性的选择山梨酸、纳他霉素和二甲基二碳酸盐为抑菌剂,评价它们对优势腐败菌及接种用乳酸菌的抑菌活性,利用响应面法优化发酵工艺参数,解决三华李果坯发酵效果不稳定的问题。
1 材料与方法
1.1 材料与仪器
新鲜三华李 购于广州市天平架水果批发市场;MRS 培养基、马铃薯葡萄糖琼脂(PDA)培养基、马铃薯葡萄糖水(PDB)培养基 广东环凯微生物科技有限公司;2×Taq PCR Master Mix 广州天一辉远基因科技有限公司;树脂天青,纯度90% 上海麦克林生化科技有限公司;山梨酸、纳他霉素、二甲基二碳酸盐 食品级,广州新如荣生物科技有限公司;无水葡萄糖 分析纯,山东祥瑞药业有限公司;氯化钠 分析纯,广州化学试剂厂。
Thermal Cycler2720 PCR 仪 赛默飞世尔科技(中国)有限公司;SYQ-DSX-280B 手提式压力蒸汽灭菌锅 上海申安医疗器械厂;DYY-6C 电泳仪北京六一生物科技有限公司;Gel DocTM XR+紫外分析仪 伯乐生命医学产品(上海)有限公司;SWCJ-1F 单人双面净化工作台 苏州净化设备有限公司;ZTHZ-103B 恒温培养摇床、LRH 生化培养箱上海一恒科学仪器有限公司;MJ30 透反射显微镜广州市明美光电技术有限公司。
1.2 实验方法
1.2.1 三华李果坯发酵工艺 选取7~8 成熟的新鲜三华李果,洗净表面杂质,沥水待用。在发酵罐中以果:水(质量比)=1:1.8 混合,按水重加入1.8%的无水葡萄糖,1.7%的氯化钠,2%的复合菌液(植物乳杆菌:干酪乳杆菌:肠膜明串珠菌=3:1:8)[17],室温(25~37 ℃)密封发酵30 d。由于不同批次的三华李果携带初始微生物数量不定,在该工艺下,容易出现发酵异常的情况。
1.2.2 三华李发酵液中优势腐败真菌的分离纯化从发酵异常的三华李发酵液中均匀取样,按10 倍系列稀释至10-4,分别取100 μL 发酵原液及各稀释梯度发酵液在PDA 固体培养基上涂布,28 ℃培养2~3 d,进行菌落形态的观察,用接种环挑取优势单菌落在新的PDA 固体培养基上进行划线分离纯化,至少纯化三代,得到纯种菌株。
1.2.3 显微镜观察 在载玻片上滴一滴无菌水,挑取少量纯化单菌落均匀涂抹于载玻片,经酒精灯火焰固定后,在显微镜下观察菌株形态。
1.2.4 优势腐败真菌的分子鉴定 真菌分子鉴定方法由广州天一辉远基因科技有限公司提供并稍加修改,具体步骤如下:
1.2.4.1 DNA 的提取 将分离纯化待鉴定的菌株接种于液体PDB 培养基中。28 ℃活化2 d,离心取0.5 g 菌体,选择十六烷基三甲基溴化铵(CTAB)法提取待鉴定菌株的基因组DNA。
1.2.4.2 PCR 扩增反应体系及程序 对所得基因组DNA 的ITS 区域进行PCR 扩增。PCR 反应总体积为30 μL,其中引物浓度为10 mmol/L,ITS1:TCCGTA GGTGAACCTGCGG,ITS4:TCCTCCGCTTATTG ATATGC,各1 μL,2×PCR Mix 15 μL,模板DNA 1 μL,双蒸水12 μL。PCR 反应条件,95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,共35 个循环,最后72 ℃延伸5 min。
1.2.4.3 PCR 产物检测 PCR 反应结束后,用1%琼脂糖凝胶电泳分析。使用凝胶成像系统拍照保存。
1.2.4.4 PCR 产物测序与结果分析 PCR 扩增后的产物由广州天一辉远基因科技有限公司进行测序。将测序后的结果放入NCBI 基因库中进行同源序列比对,并用MEGA 7.0 软件进行菌株系统发育树的构建。
1.2.5 三种抑菌剂对优势腐败真菌抑菌效价的评定
1.2.5.1 菌悬液的制备 在卢小菊等[18]的方法上加以修改,将1.2.4 中鉴定得到的优势腐败真菌分别接种于PDB 液体培养基中,摇床28 ℃,150 r/min,活化培养2 d,使菌液浓度为108CFU/mL 左右备用。
1.2.5.2 抑菌剂处理 将抑菌剂山梨酸、纳他霉素和二甲基二碳酸盐配制成溶液,在超净台用无菌0.22 μm 滤膜过滤后备用。
1.2.5.3 牛津杯法测定抑菌效力 在赵国群等[19]方法上加以改进,抑菌剂溶液浓度配制为10 mg/mL。在温度约为45 ℃的半固体PDA 培养基中接入1.2.5.1活化好的菌液,使得PDA 培养基中菌液浓度稀释为106CFU/mL 左右,缓慢混匀后倒在固体PDA 培养基表面。待含菌培养基凝固后,用移液枪吸取200 μL抑菌剂加入牛津杯中,用相应抑菌剂溶剂做阴性对照,28 ℃培养48 h,用游标卡尺测量抑菌圈直径。用MRS 培养基培养发酵所用乳酸菌,37 ℃生长48 h,其他操作相同。每种抑菌剂试验重复3 次。
1.2.5.4 最小抑菌、杀菌浓度的测定 在CLSI[20]即美国临床和实验室标准协会(Clinical and Laboratory Standards Institute)制定的药敏M07-A9 版标准上稍加修改,采用微量二倍稀释法测定MIC 和MBC 值。
取适量显色剂刃天青用三级水配制成0.1%母液,过0.22 μm 无菌滤膜待用。在无菌PDB 培养基中加入经过滤的显色剂溶液,使其在PDB 培养基中终浓度为0.01%[21]。取96 孔无菌细胞培养板,用多通道移液枪在每孔中加入100 μL 含有显色剂的PDB培养基。在96 孔板顶行的第一个孔中加入100 μL抑菌剂溶液,与培养基混匀后从顶部孔吸取100 μL转移到顶行的下一个孔,制备2 倍连续稀释液,除无菌空白对照孔外,所有孔均加入100 μL 的待测菌液,每个浓度设置3 个平行。每个孔中约有5×105CFU/mL的供试菌。其中两行微孔分别加入等量抑菌剂溶剂作为阳性对照,无菌PDB 培养基为阴性对照。
96 孔板经28 ℃培养48 h,观察每孔颜色变化。无微生物生长的孔呈蓝色,有少量微生物生长的孔呈淡粉色,大量微生物生长的孔呈淡黄色或白色。96 孔板中试验孔呈蓝色,表明腐败真菌生长受到抑制,试验孔对应的最小抑菌剂浓度为该抑菌剂对供试菌的MIC 值。从呈蓝色有抑菌作用的试验孔中分别取100 μL 混合液涂布于无菌PDA 平板,28 ℃培养48 h 后观察菌落生长情况。以平板上无菌落生长的最低抑菌剂浓度为该抑菌剂对供试菌的MBC值。本试验重复3 次。
1.2.5.5 联合抑菌活性测定 根据MIC 测定结果,采用棋盘稀释法(checkerboard method)测定三种抑菌剂两两联合使用对优势腐败真菌的抑制情况,如图1所示。

图1 棋盘稀释法加抑菌剂示意图Fig.1 Schematic diagram of bacteriostatic agent added by checkerboard dilution method
取无菌96 孔细胞培养板,用移液枪在第1~8 列沿Y 轴方向从上到下每列孔依次加入:2 MIC、MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC、1/32 MIC、0 的A 抑菌剂溶液50 μL,在第1~8 行沿X 轴方向从左至右每行孔中依次加入2 MIC、MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC、1/32 MIC、0 的B 抑菌剂溶液50 μL,将两种抑菌剂溶液混匀后,在上述孔中加入100 μL 含有显色剂刃天青的供试菌液,使得每孔菌液浓度约为5×105CFU/mL,加盖混匀,置于培养箱中28 ℃培养48 h 后,观察每孔颜色变化。山梨酸、纳他霉素和二甲基二碳酸盐溶液按上述方法两两配对,对每种菌重复3 次试验。
FICI 指数计算公式为,FICI 指数=(A 联用时的MIC/A 单独时的MIC)+(B 联用时的MIC/B 单独时的MIC)。用部分抑菌浓度指数(fractional inhibitory concentration index,FICI)对棋盘稀释法结果进行评价[22]。判定标准为当FICI≤0.5,是协同作用;0.5
1.2.6 响应面试验 参照黄月[4]和李媛[17]山梨酸和纳他霉素用量,结合本文联合抑菌试验结果,在国标GB 2760-2014 最大允许添加量条件下,以山梨酸(A)、纳他霉素(B)和二甲基二碳酸盐(C)添加量为自变量,发酵液中霉菌酵母活菌数为响应值,利用Design Expert 8.0.6 软件设计3 因素3 水平的Box-Behnken 实验,实验设计见表1。
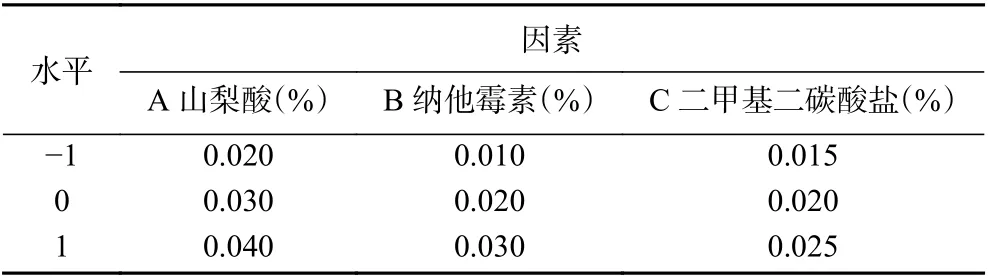
表1 Box-Behnken 试验因素水平设计表Table 1 Box-Behnken test factors level design table
1.3 数据处理
每组试验进行3 次重复,试验数据由SPSS 16.0 软件处理,利用Design Expert 8.0.6 软件进行响应面实验设计和分析。
2 结果与分析
2.1 三华李发酵液中优势腐败真菌的分离纯化
本文从接种乳酸菌发酵异常的发酵液中均匀取样,经PDA 平板涂布、划线分离培养和菌落形态观察,共得到3 株代表性显著的优势菌株,分别编号为C2、6H7、6H8,菌落形态如图2所示。从图2a 中可知,C2 菌株在PDA 培养基上的形态表现为菌落呈球形突起,白色,边缘整齐,表面光滑、湿润。6H7 菌株菌落形态(图2b)在PDA 培养基上表现为圆形,乳白色,边缘整齐有菌丝,表面光滑、湿润。6H8 菌株(图2c)在PDA 培养基上菌落呈现近圆形,乳白色,边缘不整齐,表面光滑、湿润,符合真菌菌落形态特征。

图2 发酵液中优势腐败真菌的菌落形态Fig.2 Colony morphology of dominant spoilage fungi in fermentation broth
2.2 显微镜观察结果
将分离纯化得到的3 株优势腐败真菌培养在PDA 固体培养基上,用接种环挑取少量单菌落均匀涂于载玻片,用显微镜观察菌体形态。如图3a 所示,C2 菌株细胞形态主要为椭圆形,多为出芽繁殖。6H7 菌株(图3b)细胞形态为椭圆形,也呈出芽繁殖。6H8 菌株(图3c)细胞形态多为椭圆形,出芽繁殖,有些细胞粘连呈串珠状结构。符合酵母菌的判断标准。

图3 优势酵母菌镜检下的细胞形态(×800)Fig.3 Cell morphology of dominant yeasts under microscope(×800)
综上所述,可以推断出从发酵液中分离纯化得到的3 株优势腐败真菌为酵母菌。
2.3 优势腐败真菌的分子鉴定
2.3.1 PCR 产物检测 以引物ITS1/ITS4 对3 株优势腐败真菌的基因序列进行PCR 扩增,采用1%琼脂糖凝胶电泳验证。从图4可以看出,每个菌株均出现一条大小在500~750 bp 左右的特异性扩增条带,且条带较为明亮,表明引物选择正确,目的基因得到扩增,PCR 扩增产物符合测序标准。
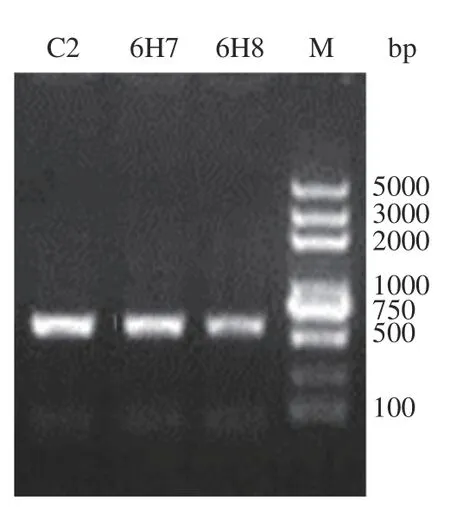
图4 优势腐败真菌PCR 扩增产物琼脂糖凝胶电泳结果Fig.4 Agarose gel electrophoresis results of PCR amplification products of dominant spoilage fungi
2.3.2 PCR 产物测序结果分析 将3 株腐败真菌的PCR 产物测序结果在GeneBank 的BLAST 上进行比对分析,通过供试菌株在NCBI 上同源性的比对结果,利用MEGA 7.0 软件构建系统发育树。由图5可知,C2 菌株与Candida stellimalicolaFM180552.1在同一支,且序列相似度为95%,结合菌落形态特征,C2 菌株被鉴定为Candida stellimalicola。由图6可知,6H7 菌株与Pichia kudriavzevii的相关序列在同一分支,序列相似度高达100%,对比菌落形态,6H7 菌株被鉴定为Pichia kudriavzevii。由图7可知,菌株6H8 与Pichia occidentalisKY849376.1 在同一支,序列相似度为100%,参考菌落形态特征,6H8 菌株被鉴定为Pichia occidentalis。
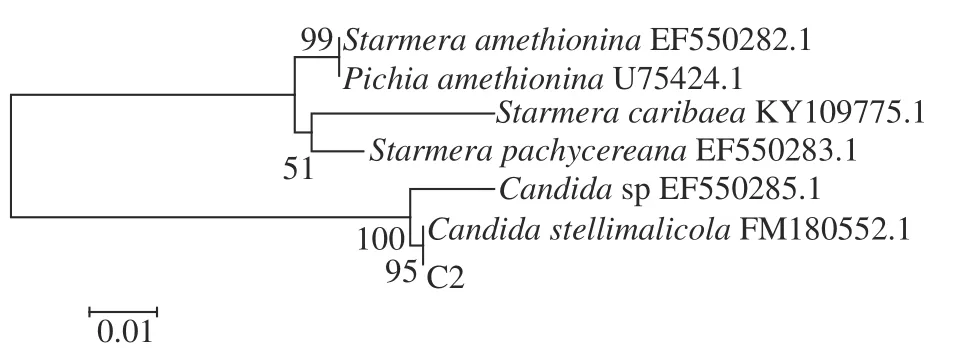
图5 基于C2 菌株ITS 序列及其相似菌株的系统发育树Fig.5 Phylogenetic tree based on the ITS sequence of C2 strain and its similar strains

图6 基于6H7 菌株ITS 序列及相似菌株的系统发育树Fig.6 Phylogenetic tree based on the ITS sequence of 6H7 strain and similar strain

图7 基于6H8 菌株ITS 序列及相似菌株的系统发育树Fig.7 Phylogenetic tree based on ITS sequence of 6H8 strain and similar strains
综上所述,通过分离鉴定可知,导致腐败的优势真菌为3 株酵母菌,其中C2 菌株为假丝酵母亚种(Candida stellimalicola),6H7 菌株为库德里阿兹氏毕赤酵母(Pichia kudriavzevii),6H8 菌株为西方毕赤酵母(Pichia occidentalis)。
2.4 三种抑菌剂抑菌效价的评定
为优选对腐败菌具有强抑制作用,但对接种乳酸菌不会产生不良影响的抑菌剂,进行以下试验。
2.4.1 牛津杯法测定抑菌效力 表2为3 种抑菌剂对6 株供试菌的牛津杯抑菌结果。当抑菌剂浓度在10 mg/mL 时,二甲基二碳酸盐对发酵用的干酪乳杆菌有一定的抑制效果,抑菌圈直径为(10.45±0.11)mm,山梨酸和纳他霉素对干酪乳杆菌没有抑制作用。3 种抑菌剂对发酵用植物乳杆菌和肠膜明串珠菌无抑制作用,对致腐酵母菌抑制作用明显,其中二甲基二碳酸盐对C2 和6H7 菌株抑制效果较好,抑菌圈直径分别为(25.35±0.36)mm 和(24.21±0.74)mm。纳他霉素对6H8 菌株抑制效果好,抑菌圈直径为(26.71±1.00)mm。山梨酸对C2 菌株抑制效果好,抑菌圈直径为(20.80±0.71)mm。

表2 不同抑菌剂对供试菌的抑菌效力Table 2 Antibacterial efficacy of different antibacterial agents on the tested bacteria
综合来看,3 种抑菌剂对3 株致腐酵母菌的抑制效果良好,二甲基二碳酸盐虽然对干酪乳杆菌略有抑制作用,但不会影响整体发酵的正常进行。3 种抑菌剂均可应用于抑制发酵液中致腐酵母菌的生长繁殖。
2.4.2 最小抑菌、杀菌浓度的测定 采用微量二倍稀释法测定3 种抑菌剂对3 株腐败酵母菌MIC 及MBC 值,结果如表3~表5所示。山梨酸(表3)对3 株供试菌的抑制效果由强到弱依次为:C2≥6H7=6H8。从表4中可以得知,仅需3.91~7.81 μg/mL 的纳他霉素溶液就能抑制腐败酵母菌的生长,当溶液浓度达到31.25 μg/mL 时可以完全杀死供试菌,说明对3 株腐败酵母菌的抑制和杀死能力极强。而二甲基二碳酸盐(表5)对供试菌抑制效果较弱,其浓度需在125~250 μg/mL 时才有抑制作用,只有达到20~40 mg/mL 时,二甲基二碳酸盐才能完全杀死致腐酵母菌。这可能与初始菌液浓度和二甲基二碳酸盐易分解的性质有关。
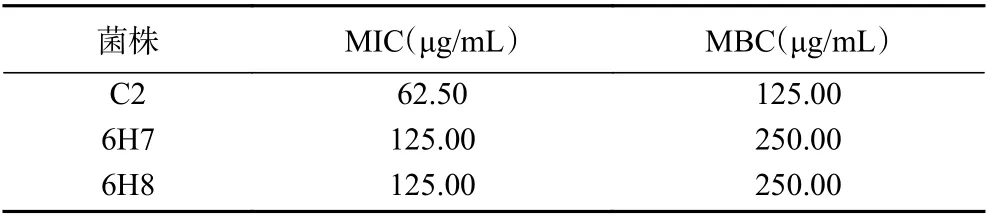
表3 山梨酸对腐败酵母菌的MIC 和MBC 值Table 3 MIC and MBC values of sorbic acid on spoilage yeast

表4 纳他霉素对腐败酵母菌的MIC 和MBC 值Table 4 MIC and MBC values of natamycin on spoilage yeast

表5 二甲基二碳酸盐对腐败酵母菌的MIC 和MBC 值Table 5 MIC and MBC values of dimethyl dicarbonate on spoilage yeast
2.4.3 联合抑菌活性测定 以FICI 指数来判定抑菌活性[22],指数越小协同作用越强。由表6可知,山梨酸和纳他霉素复配后C2 和6H8 菌株的FICI 指数均为0.53,表现出部分协同或相加作用,6H7 菌株FICI 指数为0.50,表现出协同作用。通过表7可知,山梨酸与二甲基二碳酸盐复配后的C2 和6H8 菌株的FICI 等于或小于0.50,表现出协同作用,6H7 菌株FICI 为0.53,表现出部分协同或相加的作用。而从表8中可以看出,纳他霉素与二甲基二碳酸盐复配后对3 株供试菌的FICI 指数均较大,C2 和6H7菌株的FICI 接近1,协同抑菌作用较弱,说明两者的联合抑菌效果一般。
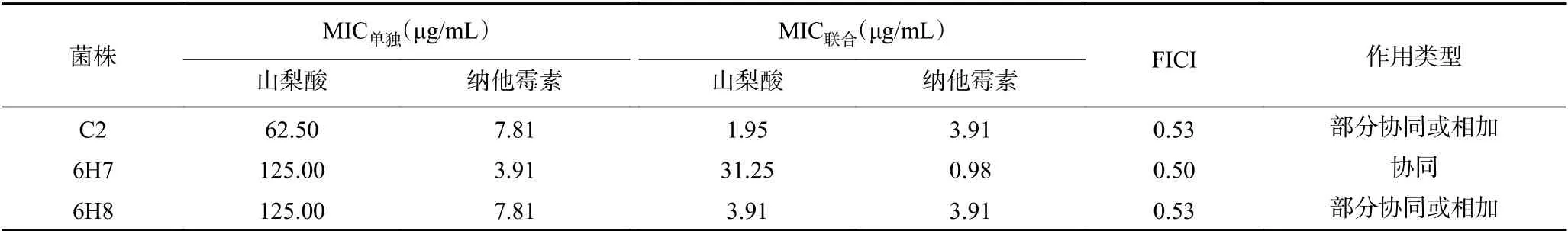
表6 山梨酸与纳他霉素对三株供试酵母菌联合抑菌的结果Table 6 The combined antibacterial results of sorbic acid and natamycin on the three tested yeasts

表7 山梨酸与二甲基二碳酸盐对三株供试酵母菌联合抑菌的结果Table 7 The combined antibacterial results of sorbic acid and dimethyl dicarbonate on the three tested yeasts
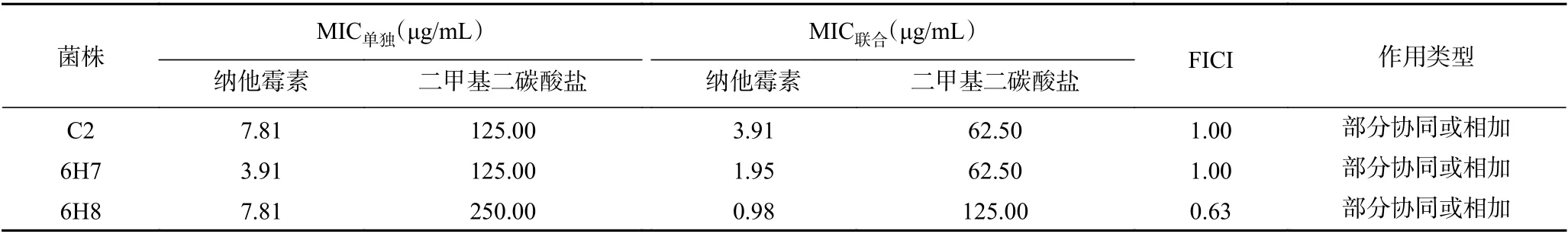
表8 纳他霉素与二甲基二碳酸盐对三株供试酵母菌联合抑菌的结果Table 8 The combined antibacterial results of natamycin and dimethyl dicarbonate on the three tested yeasts
综合以上结果可知,三种抑菌剂复配使用能在较低浓度下(低于各自MIC,具体数据见表6~表8),对3 株致腐酵母菌起到协同或部分协同的作用,更好地抑制腐败酵母菌的生长繁殖。
2.5 响应面优化发酵工艺
2.5.1 响应面试验设计及结果分析 以发酵液中添加的山梨酸(A)、纳他霉素(B)和二甲基二碳酸盐(C)的质量浓度为自变量(按果重百分比计),发酵30 d后发酵液中霉菌酵母活菌数为响应值,建立3 因素3 水平中心组合试验设计,以优选复配抑菌剂用量,结果如表9所示。
利用Design Expert8.0.6 软件对表9进行多元回归拟合分析。通常微生物指标测定存在一定误差,得到的模型回归决定系数相对较低,故利用软件对回归模型进行优化。设发酵30 d 发酵液中霉菌酵母活菌数为Y,得到回归方程为:

表9 响应面方案设计及试验结果Table 9 Response surface scheme design and test results
Y=4.60−0.18A+0.14B−0.34C−0.093AB+0.63AC−0.14BC+0.38A2−0.48B2+0.34C2+0.33A2B+0.72A2C。对该回归模型进行方差分析,结果如表10所示。
从表10可以看出,该模型显著(P<0.05),失拟项P=0.3280>0.05 不显著,回归模型决定系数R2=0.9740,说明方程对该试验拟合程度良好。试验变异系数CV=4.84%,模型重现性较好。综上所述,可以用该模型对发酵30 d 后三华李果发酵液中霉菌酵母活菌数进行分析与预测。

表10 回归模型方差分析Table 10 Analysis of variance of regression model
2.5.2 最佳抑菌剂组合浓度验证试验 利用Design Expert 8.0.6 软件得出最佳抑菌剂复配浓度为:山梨酸质量浓度0.040%,纳他霉素质量浓度0.010%,二甲基二碳酸盐质量浓度0.015%,在此条件下,预测发酵30 d 后三华李果发酵液中霉菌酵母活菌数为3.141 lg CFU/mL。进行3 次验证实验,测得发酵液中霉菌酵母活菌数为3.212 lg CFU/mL,与预测值相比,相对误差为2.26%,说明可以用该模型优化的参数进行抑菌剂的复配。
由前期实验可知,发酵30 d 后,三华李发酵液中霉菌酵母活菌数超过107CFU/mL 数量级时,发酵液表面会产生白色菌膜。在添加优选复配抑菌剂后,发酵液中霉菌酵母活菌数能控制在103CFU/mL 左右,发酵正常无白色菌膜产生。
3 讨论与结论
新鲜水果表面通常携带大量微生物,在温湿度适宜的条件下,容易导致腐败变质。适当的加工保藏方法,能够延长果品的食用期限,并增添风味。李媛等[8]用复合乳酸菌发酵保藏三华李果,已取得了一定的效果,但存在发酵不稳定、腐败微生物生长难控制的情况。本文从发酵30 d 的表面长出白色菌膜的三华李异常发酵液中分离出3 株优势腐败酵母菌,分别为假丝酵母亚种(Candida stellimalicola),库德里阿兹氏毕赤酵母(Pichia kudriavzevii)和西方毕赤酵母(Pichia occidentalis)。石明杨[23]从沙果和桃子中分离得到能够耐受低pH 的菌株,鉴定为毕赤酵母属的Pichasp.。钟小廷等[24]研究也发现毕赤酵母属是引起泡菜“生花”的主要微生物。敖晓琳等[25]对“生花”的四川泡菜中的微生物进行分离,鉴定得到的3 株腐败酵母菌分别为P.manshurica、P.kudriavzevii和C.tropicalis,并且发现前两种菌在发酵过程中会产生腐败味。张瑜等[26]发现引起发酵蔬菜表面形成膜醭的菌种包括近平滑假丝酵母、光滑假丝酵母和粗壮假丝酵母。可以看出酵母菌是导致泡菜表面“生花”的主要微生物,结果与本文相似。结合朱寒冰、Cassanego等[27−28]的研究可知,这些酵母属于氧化性酵母,适度生长对发酵制品影响不大,但大量生长会在发酵制品表面出现成片或成碎花状的白膜,产生白膜的发酵产品有异味,同时这些酵母会分解果蔬中的果胶物质,消耗其中的糖类,导致发酵果蔬软化腐烂,最终不能食用[26,29]。
三华李鲜果采收后,由于运输储藏的条件较差、时间较长等问题,可能导致果表面的初始腐败菌数量较多,在发酵液中接入常量的乳酸菌无法完全杀灭及抑制腐败菌的生长,导致发酵液表面产生白色菌膜等问题。发酵前处理如紫外、臭氧和高温杀菌可以降低腐败菌的数量和发酵异常的风险,但通过前期预实验表明,紫外线、臭氧杀菌处理在增加工序的同时杀菌效果不太理想,对于大规模果坯加工来说,成本较高;高温杀菌会造成果坯变软,不利于完整果形的保持。故本文采取分离鉴定腐败菌,并针对性添加抑菌剂的方式来改善原有工艺,实施起来更为方便。本文利用牛津杯实验得知,3 种抑菌剂均对3 株腐败酵母菌产生显著的抑菌圈,仅二甲基二碳酸盐对发酵所用干酪乳杆菌有轻微的抑制作用,说明3 种抑菌剂可以用于抑制发酵液中腐败酵母菌生长而不影响正常发酵。通过微量二倍稀释法可知,纳他霉素对3株致腐酵母菌有极强的抑制和杀死能力,3.91~7.81 μg/mL 就能抑制腐败酵母菌的生长,浓度达到31.25 μg/mL 时可以完全杀死腐败酵母菌;二甲基二碳酸盐对三种腐败酵母菌的MIC 为125~250 μg/mL。李东等[30]研究发现1.0~5.0 mg/kg 的纳他霉素溶液能够抑制多数酵母的生长。Sánchez-Rubio 等[31]研究表明二甲基二碳酸盐对市售的一种脱醇红葡萄酒中腐败菌粘红酵母和酿酒酵母的MIC 为200 mg/kg,研究结果与本文相似,均表明合适的抑菌剂能在低浓度下对酵母菌起到抑制作用。
抑菌剂复配使用能够发挥协同作用,增强抑菌效力[16]。本文利用棋盘法研究了3 种抑菌剂两两联合使用对3 株致腐酵母的抑制作用,其中山梨酸与纳他霉素联合作用于6H7 菌株的FICI 为0.50;山梨酸与二甲基二碳酸盐联合作用于C2 和6H8 菌株的FICI 分别为0.50 和0.38,均表明抑菌剂联合使用确有协同作用;根据以上结果,利用响应面法优化三华李果坯发酵过程的防腐工艺,得到复配抑菌剂参数为:在发酵液中按果重添加质量浓度为0.040%山梨酸,0.010%纳他霉素和0.015%二甲基二碳酸盐,室温密封发酵30 d 后,发酵液中霉菌酵母活菌数为3.212 lg CFU/mL,远低于旧工艺发酵液中霉菌酵母活菌数,发酵液表面无白膜生长,果坯硬度高、无异味,工艺简单有效、效果稳定。
