贝类致敏原抗原表位及交叉反应的研究进展
2021-07-17李梦思韩天娇曹敏杰刘光明
桓 霏,云 肖,李梦思,韩天娇,刘 萌,杨 阳,曹敏杰,刘光明,*
(1.集美大学食品与生物工程学院,福建厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,厦门市海洋功能食品重点实验室,福建厦门 361021)
食物过敏(Food allergy)是由免疫球蛋白(Immunoglobulin,Ig)E 介导的速发型超敏反应,其发病迅速,临床症状多样,病情严重时甚至会出现休克或死亡,成为各国政府和公众广泛关注的食品安全问题之一。调查统计表明,英国食物过敏发病率为19.2%[1]、美国为10.9%[2]。过去的几十年里,发展中国家患病率呈现上升趋势,其中,中国过敏性疾病发病率从3.5%上升至7.7%[3],而中国儿童的自报食物过敏率高达8.4%[4]。流行病学调查发现,贝类是引起美国居民过敏的第三大常见食物(16.1%),仅次于花生(23.1%)和坚果(21.6%)[5],法国儿童的贝类过敏发病率达5.5%[6];而在中国、新加坡和泰国等亚洲国家,贝类则是引起食物过敏的主要原因[7],中国香港地区的贝类过敏占食物过敏疾病总发生率的35%左右[8]。贝类(Shellfish)包括甲壳类及软体类[9],其风味鲜美,营养价值高,是人们最喜爱的水产品之一。不同于牛奶、鸡蛋等好发于婴幼儿的致敏食物,由贝类引起的食物过敏好发于成人,容易引起皮肤红肿、鼻炎、哮喘等症状[10]。
食品致敏原指的是能够诱导机体产生IgE 抗体并与之结合,进一步激活机体免疫系统,从而引发食物过敏症状的物质[10]。抗原表位是致敏原中决定抗原特异性的特殊化学基团,是致敏原发挥功能作用的基础[11]。根据自身结构不同,抗原表位可分为线性表位和构象表位。线性表位是指一级结构上连续的,可与抗体特异性结合的一类短肽,主要用重叠肽技术确定[12]。构象表位指在一级结构上不连续,但其经过进一步的盘曲折叠,在三级结构上相互靠近而形成的特异性结合位点,噬菌体展示技术则是构象表位分析的有力工具[11]。
研究发现贝类致敏原的抗原表位与物种间交叉反应性有明显的相关性,不同贝类物种间具有相同或相似的抗原表位为其交叉反应提供基础[13]。食品致敏原有特定的空间结构及抗原表位,利用不同加工方法或脱敏技术处理会破坏致敏原的空间结构或抗原表位,从而影响致敏性。大多数贝类都需经过加热后摄食,故热加工技术被广泛应用于消减贝类致敏性。但由于热加工主要通过破坏致敏原构象表位而影响致敏原致敏性,对线性表位影响较小,因此非热加工方法如酶法交联、超高压、辐照等被应用于贝类食品的加工消减[14]。本文介绍了贝类致敏原及抗原表位、交叉反应性及致敏性消减等领域的研究进展。
1 贝类常见致敏原及抗原表位
目前报道的贝类主要致敏原有原肌球蛋白(Tropomyosin,TM)、精氨酸激酶(Arginine kinase,AK)、次要致敏原肌质钙结合蛋白(Sarcoplasmiccalcium-binding protein,SCP)、肌球蛋白轻链(Myosin light chain,MLC),以及新型致敏原磷酸丙糖异构酶(Triosephosphate isomerase,TIM)、细丝蛋白C(Filamin C,FLN c)等[9]。
1.1 原肌球蛋白
TM 作为肌钙蛋白的复合物存在,参与机体肌肉收缩,是无脊椎动物中的一种泛致敏原,也是贝类的主要致敏原之一[15]。TM 的相对分子质量为34~40 kDa,约由281 个氨基酸组成,等电点为4.5,其三级结构是由两个相同的α螺旋构型的多肽链相互缠绕而形成的超螺旋结构[16]。
甲壳类水产品中TM 的相关研究已较为广泛,1981年,TM 首次被鉴定为褐虾(Penaeus aztecus)的一种致敏原[17],随后在斑节对虾(Penaeus monodon)[18]、克氏原螯虾(Procambarus clarkii)[19]、雪蟹(Chinopecetes opilio)[20]等物种中陆续被发现。相对于甲壳类动物而言,软体类致敏原的研究较少,Masaru 等[21]鉴定TM 为太平洋牡蛎(Crassostrea gigas)的主要致敏原,除此之外,有学者克隆了北太平洋鱿鱼(Todarodes pacificus)[22]、华贵栉孔扇贝(Chlamys nobilis)和翡翠贻贝(Perna viridis)[23]等软体类动物的基因序列,发现与甲壳类TM 有较高的同源性。
重叠肽技术被广泛应用于鉴定致敏原线性表位,Ayuso 等[24]合成褐虾TM 的46 条肽段,结合血清学验证并鉴定出5 个线性表位。Zhang 等[25]鉴定了秀丽白虾(Exopalaemon modestus)TM 的5 个线性表位。除此之外,Ayuso 等[26]分析得到凡纳滨对虾(Litopenaeus vannamei)TM 的5 个线性表位。Leung等[12]利用OBOC(One-bead-one-compound)技术鉴定刀额新对虾(Metapenaeus ensis)TM 的6 个线性表位。Liu 等[27]利用噬菌体展示技术筛选得到拟穴青蟹(Scylla paramamosain)TM 的8 个线性表位及7 个构象表位。目前软体动物致敏原的研究尚未丰富,其抗原表位大多数都由预测得到,国内外陆续有学者采用生物信息学软件预测章鱼(Octopodidae vulgaris)[28]、太平洋牡蛎[29]TM 的抗原表位。已报道的贝类TM 构象表位见表1,线性表位定位见图1。图中不同颜色的横线表示不同物种间TM 的抗原表位,横线重合处越多表明表位的保守性也越高,通过对已报道的TM 抗原表位的整理分析,发现AA45-55、AA80-110、AA254-263 为贝类TM 抗原表位的保守区域。
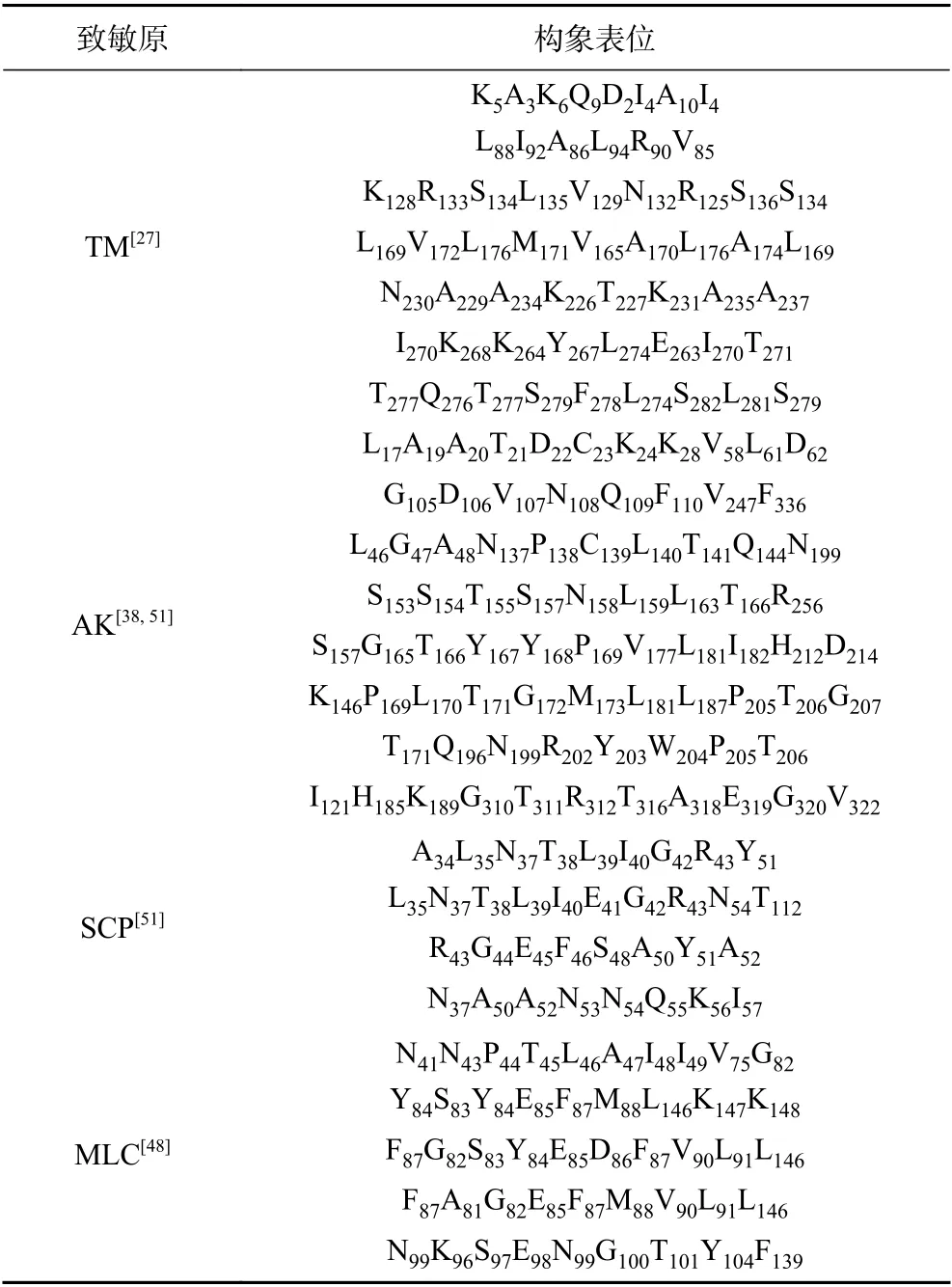
表1 贝类四种常见致敏原的构象表位Table 1 Conformational epitopes of four commonly shellfish allergens

图1 贝类TM 线性表位定位[12,24−29]Fig.1 Linear epitopes location of shellfish TM[12,24−29]
1.2 精氨酸激酶
AK 是一种广泛存在于无脊椎动物体内的磷酸原激酶,可调节能量代谢[30],由359 个氨基酸残基组成,分子量为40 kDa 左右,等电点为6.0,其空间结构包含一个N 端的α螺旋结构域和C 端的α-β结构域[31]。
甲壳类水产品中,雪蟹、克氏原螯虾等物种中的AK 相继被鉴定报道[32],同时凡纳滨对虾[33]、拟穴青蟹[34]等物种中AK 的晶体结构也已经被解析。在软体动物中,仅有少量AK 被报道,Shen 等[35]首次在章鱼中发现AK,采用生物信息学软件预测结果表明,在章鱼及虾、蟹等甲壳类物种中AK 一级序列的同源性达到54%左右,此外,预测结果也表明二者的三级结构高度相似。
作为贝类中的主要致敏原,AK 的抗原表位也陆续被鉴定报道。利用重叠肽技术,Mao 等[36]得到拟穴青蟹AK 的3 个线性表位。Ayuso 等[37]鉴定了凡纳滨对虾AK 的8 个线性表位;Yang 等[38]利用噬菌体展示等技术得到拟穴青蟹AK 的4 个线性表位及8 个构象表位。Fu 等[39]利用生物信息学分析软件结合免疫组学方法验证了中国对虾(Penaeus chinensis)AK 的线性表位。其他软体动物中,有研究预测得到章鱼AK 的线性表位[35]。已报道的贝类AK 构象表位见表1,线性表位定位见图2。不同物种间AK 的抗原表位相似度较高,且其主要分布在α 螺旋及β 折叠部分,其中AA113-156 处的表位高度保守,该区域对AK 发挥致敏性的重要性值得深入研究。太平洋牡蛎AK 的酶动力学性质已见报道,但其免疫学特性未见研究,而AK 作为泛致敏原,在软体类动物中可能为潜在致敏原,因此其在软体动物中的致敏性有待研究。

图2 贝类AK 线性表位定位[35−39]Fig.2 Linear epitopes location of shellfish AK[35−39]
1.3 肌质钙结合蛋白
SCP 是存在于无脊椎动物肌肉和神经组织的EF 手性钙离子缓冲蛋白,分子量约为20 kDa,等电点为 4.6 左右,在无脊椎动物体内起调节肌肉收缩的功能。
Shiomi 等[40]采用盐析法、阴离子交换色谱法结合反相高效液相色谱法从斑节对虾中分离纯化出20 kDa致敏原SCP。随后在日本对虾(Penaeus japonicus)、美国螯龙虾(Homarus americanus)、粉虾(Pandalus eous),克氏原螯虾[41]中也分别检测到SCP,与已报道的甲壳类SCP 序列同源性超过80%。Hu 等[42]重组表达了拟穴青蟹SCP,并发现其理化性质和免疫学特性与天然SCP 相似,青蟹SCP 与其他甲壳类水产品SCP 存在明显的交叉反应性。在软体动物中,Han 等[43]纯化了葡萄牙牡蛎(Crassostrea angulata)SCP,并发现其与太平洋牡蛎同源性较高。
通过重叠肽技术,Ayuso 等[37]鉴定了凡纳滨对虾SCP 的3 个线性表位。Morii 等[44]合成斑节对虾SCP 中的18 个重叠肽,结合血清学研究表明,斑节对虾SCP 线性表位对致敏性的影响较小。学者们发现SCP 主要以构象表位为主,同样地,通过噬菌体展示技术,Yang 等[51]等人也在拟穴青蟹SCP 中相继鉴定出了6 个构象表位。此外,国内学者预测得到克氏原螯虾SCP 的3 个线性表位[41]。已报道的贝类SCP 构象表位见表1,线性表位见图3。从线性表位角度来看,凡纳滨对虾及克氏原螯虾SCP 抗原表位的保守性较低,但由于贝类中关于SCP 抗原表位的研究较少,仍无法全面探究其表位的保守性。
1.4 肌球蛋白轻链
MLC 是肌球蛋白大分子复合体的一部分,构成功能型肌肉蛋白结构,通过EF 手型结构域结合Ca2+,对热较稳定,在强酸和强碱性条件下也具有良好的稳定性[45]。
Ayuso 等[46]首次从凡纳滨对虾中纯化出MLC,免疫组学方法验证其有IgE 结合活性。克氏原螯虾[45]、拟穴青蟹[47]也有鉴定出MLC,且有研究表明,贝类过敏患者对MLC 的识别率达到50%以上[37],仅次于主要致敏原TM,因此需要全面鉴定贝类其他物种间MLC,进一步解释其丰度较低但致敏率较高的原因。
在MLC 抗原表位研究方面,有学者预测得到克氏原螯虾MLC1 有4 个构象表位和3 个线性表位,而MLC2 则有1 个构象表位和3 个线性表位[48]。Yang等[48]通过噬菌体展示技术鉴定克氏原螯虾MLC1的5 个构象表位,拟穴青蟹中预测得到7 个MLC 线性表位并通过肥大细胞脱颗粒等实验鉴定了5 个关键的表位区域[47]。在凡纳滨对虾中也预测到MLC的线性表位[37]。已报道的贝类MLC 构象表位见表1,线性表位见图4。
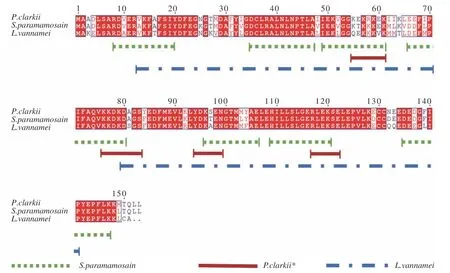
图4 贝类MLC 线性表位定位[37,47-48]Fig.4 Linear epitopes location of shellfish MLC
1.5 新型致敏原
除了以上常见致敏原以外,随着国内外学者对食物过敏的重视,越来越多的新型贝类致敏原也陆续被发现。
Lee 等[49]发现凡纳滨对虾中63 kDa 的组分可特异性结合对虾过敏患者的血清,随后该蛋白被鉴定为丙酮酸激酶。Yang 等[50]首次从章鱼中分离鉴定出28 kDa 的新型致敏原TIM,随后,甲壳类中的TIM 也被鉴定[51]。
虽然大部分已被鉴定报道的过敏原分子量均较低,但鉴定为过敏原与蛋白质的分子量之间并没有显著相关性。Yang 等[52]从克氏原螯虾中发现并鉴定90 kDa 组分的新型致敏原FLN c;此外,Suzuki 等[53]从皱纹盘鲍中纯化出100 kDa 左右的组分,经鉴定为副肌球蛋白,与TM 表现出较高的序列同源性。
国内学者普遍通过生物信息学软件来分析预测新型致敏原的抗原表位,章鱼TIM 的8 个线性表位、克氏原螯虾FLN c 的9 个线性表位及10 个构象表位[52]相继被报道。此外,也有学者采用噬菌体展示技术确定了章鱼TIM 的1 个构象表位[50];拟穴青蟹TIM 的5 个线性表位以及3 个构象表位区域[51]。由于贝类水产品致敏原结构、抗原表位等方面的研究尚不系统,这些新型致敏原是否具有共同的结构特征和抗原表位也尚未可知,进一步的深入探究对于过敏性疾病的防控和治疗具有重要意义。
2 贝类致敏原的交叉反应性及加工消减
2.1 贝类致敏原的交叉反应
研究表明,约有38%的受试者对甲壳类过敏,其中14%的人同时对甲壳类及软体类过敏[54],说明贝类间存在较高的交叉反应,尽管这一临床现象被普遍关注,但相关原因的研究还略有不足。
已有的研究表明贝类过敏原是甲壳类动物和其他物种间存在交叉反应的基础,其高度保守的氨基酸序列可能是交叉反应的主要原因。临床病例报道由于意外接触尘螨、昆虫等,贝类过敏患者出现了严重的临床症状,其主要原因是尘螨等与贝类中TM具有高度的序列同源性,其中对虾与尘螨TM 的氨基酸序列相似度为81%,与蟑螂的氨基酸序列相似度为82%。TM 是引起无脊椎动物间交叉反应的泛致敏原,其在甲壳类动物中具有高度保守的氨基酸序列,同源性高达91%~100%[55]。此外,与TM 相似,AK 的氨基酸序列也较为保守,甲壳类及软体动物间AK 氨基酸序列同源性达55%左右,这也是AK在无脊椎动物间存在较高的交叉反应的主要原因[56]。同样地,研究表明虾夷扇贝(Mizuhopecten yessoensis)、斑节对虾和凡纳滨对虾等均可特异性结合葡萄牙牡蛎中的SCP 多克隆抗体,其主要原因是这些软体动物中的SCP 同源性达到了50%~96%[43]。
同时,也有证据表明具有相似的IgE 表位可能是贝类及无脊椎动物间出现较高交叉反应的分子基础。在图1~图4中定位的贝类主要致敏原的表位中,发现除SCP 外,贝类致敏原的抗原表位均高度保守,这可能是贝类物种间交叉反应性发生率较高的原因。此外,Nugraha 等[57]在鉴定出的97 个虾TM的IgE 结合表位中,进一步识别出了22 个甲壳类动物、软体动物、蟑螂和螨虫共有的表位,这为解释贝类食品广泛存在的交叉反应提供了新思路一个新的角度新思路。Yang 等[48]发现克氏原螯虾MLC 与白蚁、蟑螂、蚕蛹等无脊椎动物的抗原表位区域保守性高,可能存在明显的交叉反应性。此外,主要结构相似或具有相同的构象表位也可能是引起不同家族过敏原出现交叉反应的原因之一。克氏原螯虾中非同族新型致敏原TIM 与FLN c 可识别相同的过敏原多克隆抗体,具有明显的交叉反应性,二者氨基酸序列同源性较低,但经噬菌体展示技术识别出其具有相同的抗原表位区域,且二者在空间结构上存在一定的相似性[50]。当前对软体动物中的新型过敏原研究较少,其交叉反应性仍有待深入。
2.2 贝类致敏原的加工消减
基于致敏原序列同源性和表位的研究,加工定向消减贝类食品致敏性逐渐成为国内外研究的热点。常用的定向改造致敏原的方法,包括酶法交联、美拉德反应等,已陆续被应用于不同致敏原的脱敏。
酶法交联,主要是酶催化使致敏原与致敏原之间或致敏原与其他蛋白之间发生交联,从而将致敏原的抗原表位隐藏在蛋白内部,降低致敏原的致敏性[58]。Liu 等[59]将辣根过氧化物酶与拟穴青蟹TM交联,发现两种酶交联产物均可改善小鼠的致敏症状,显著降低其体内的特异性IgE 水平;其主要原因是添加的酶可通过影响蛋白的结构形态,改变抗原的递呈方式,诱导致敏小鼠产生对TM 的口服耐受性,因而改变交联产物的致敏性。Yuan 等[60]发现谷氨酰胺转胺酶可改变刀额对虾TM 的空间结构,定向修饰抗原表位,进而有效降低虾TM 的致敏性。Fei 等[61]采用外加酪氨酸酶的方式,结合免疫组学与蛋白质组学方法对拟穴青蟹AK 进行了酶法交联,交联产物的二级结构发生改变,表面疏水性增强,通过小鼠模型验证发现其致敏性较天然AK 明显降低。
美拉德反应是食品加工过程中普遍存在的一种现象,主要是指氨基酸残基与还原糖在一定温度下发生的非酶褐变[62]。Zhang 等[63]发现TM 与葡萄糖在37 ℃经糖化反应18 h 后,致敏原α-螺旋含量大幅下降,且赖氨酸的含量降低了55%左右,致敏原结构的改变致使其致敏性显著降低。Han 等[64]发现阿拉伯糖可定向修饰拟穴青蟹TM 的IgE 表位上关键氨基酸(K112、R125、R133),进而减缓小鼠的过敏症状,降低TM 的致敏性。Hu 等[42]等研究表明,拟穴青蟹SCP 与木糖在100 ℃下的混合产物,经N 端糖基化定向修饰抗原表位后,其与血清IgE 的特异性结合能力显著降低。除此之外,由于MLC、TIM、FLN c 等致敏原起步较晚,其致敏性消减方面研究未见报道。
致敏原与体内IgE 的特异性结合是引起机体食物过敏的主要原因,抗原表位决定了致敏原与IgE 的结合能力[1]。修饰或破坏致敏原结构及其抗原表位是降低贝类食物致敏性的关键,可定向消减致敏原致敏性的加工方法的探究势在必行。
3 贝类致敏原研究的发展趋势
国内外学者针对贝类致敏原的鉴定、抗原表位的识别、交叉反应和致敏性消减的加工方式等研究均取得了一定的进展。但相比于其它致敏食物,关于贝类致敏原及致敏性的相关研究仍需深入。首先,目前针对贝类致敏原的研究主要集中在丰度较高的甲壳类致敏原TM、AK 中,而研究表明贝类中丰度低的致敏原如MLC 等,也有较高的致敏率,故应加强对软体动物致敏原及次要致敏原的研究。其次,已报道的常用表位鉴定方式,效率低、且成本高,而近几年OBOC 及生物信息学预测结合免疫学鉴定方式具有高效可靠等特点,可期广泛应用于致敏原表位鉴定。同时,基于致敏原序列同源性及表位相似性,深入探究贝类食品致敏原之间及其与其它无脊椎动物之间的交叉反应性,进一步完善贝类食品致敏原广泛存在交叉反应性的原因。最后,探究多种不同的加工方式联用,定向修饰贝类食品致敏原,以期在保留食物营养成分的前提下,最大程度降低或者消除食物致敏性,以丰富我国低致敏性食品市场。
