不同土地利用方式下土壤腐殖质作为胞外电子穿梭体的持续能力分析
2021-07-17檀文炳
余 红, 范 萍, 檀文炳, 张 颖*
1.中国环境科学研究院, 国家环境保护地下水污染模拟与控制重点实验室, 北京 100012
2.南昌大学资源环境与化工学院, 江西 南昌 330031
土壤腐殖质是由植物和微生物残体分解的中间产物重新组合形成的有机聚合物,是土壤有机物的主要组成部分. 在厌氧条件下,溶解与固相颗粒状的腐殖质都可能会接受来自厌氧微生物呼吸产生的电子[1-2]. 腐殖质的微生物还原过程会涉及将电子转移到腐殖质中的醌基团和其他具有氧化还原活性官能团以及腐殖质中的络合金属[3-6]. 还原后的腐殖质既可以作为厌氧微生物呼吸链中的电子供体[7],又可以将电子转移到土壤中溶解性较差的Fe(Ⅲ)氢氧化物和Fe(Ⅲ)氧化物矿物质[1,8-9],从而在微生物还原Fe(Ⅲ)过程中充当电子穿梭体的角色[10]. 此外,还原后的腐殖质还可以将电子转移到各类有机与无机污染物中[11],从而影响其分解和转化,这在土壤污染修复方面具有重要意义.
当土壤处于间歇性缺氧环境时,腐殖质作为微生物呼吸链的电子受体会对其他末端电子受体的还原产生竞争性地抑制[12]. 由此推测,当土壤处于间歇性曝气环境后,被微生物还原的腐殖质会被氧气重新氧化,从而恢复腐殖质在后续间歇性缺氧的土壤环境中充当电子受体的能力,这使其他末端电子受体的还原继续被抑制. 土壤腐殖质电子穿梭体功能并非持续恒定,其具有一定“寿命”,目前很少有研究涉及土壤腐殖质电子穿梭体功能的持续能力,即土壤腐殖质的电子循环能力. 如果土壤腐殖质的电子穿梭能力在这些间歇性缺氧和曝气的环境中能够保持很好的稳定性,这对降低土壤CH4和N2O等温室气体的排放将起到十分重要的作用[13-14].
尽管之前有很多研究在化学或电化学的还原与氧气重新氧化的循环周期试验中,证明了腐殖质在接受电子和供给电子上具有很强的可逆性[4,14-15],实际上,腐殖质并不是通过化学或电化学的途径获得电子,而是通过与微生物相互作用接受电子,因此,采用化学或电化学的还原方法并不能真实反映土壤腐殖质作为胞外电子穿梭体的持续能力. 此外,土地管理和土地利用方式影响陆地生态系统中天然有机物和腐殖质的降解和转化[16],进而影响土壤腐殖质的内在化学结构[17-20]. 因此,不同的土地管理和土地利用方式对土壤腐殖质电子转移能力会产生重大影响[21-25],但是否对土壤腐殖质作为胞外电子穿梭体的持续能力产生影响至今仍不清楚. 为此,该研究选取水稻地、葡萄园和杨梅园的土壤,通过微生物还原和氧气重新氧化的循环周期试验模拟真实存在的间歇性缺氧-曝气循环过程,分析不同土地利用方式下土壤腐殖质作为胞外电子穿梭体的持续能力及其影响因素,以期为深入理解土壤腐殖质的氧化还原动力学行为与土壤有机碳循环及温室气体形成过程之间的关系提供理论依据.
1 材料与方法
1.1 研究区域概况
研究区位于江苏省常州市武进农业土壤示范基地(31°33′N~31°34′N、119°59′E~120°01′E),主要种植水稻、葡萄和杨梅等. 该区地处北亚热北带向北温南带过渡的气候区域,属湿润季风气候. 气候特征是四季分明、雨热同步、光照充足. 年均气温为15.8 ℃,年均降水量为1 092 mm,全年日照总时数为 1 940 h. 区域土壤类型主要为黄棕壤和红壤,成土过程的特点是强烈的黏化与轻微的富铝化.
1.2 土壤腐殖质化学结构特征分析
1.2.1土壤样品采集
2013年8月在研究区选择分布面积大且具有代表性的水稻地、葡萄园和杨梅园的土壤,3种土地利用方式下施肥耕作等管理方面存在明显差异. 每种土地利用方式下选取3个采样点,采集表层(0~20 cm)土壤. 土壤样品取回后立即进行冷冻干燥,去除其中的植物根系残体等杂物,保存备用. 土壤理化性质见表1.
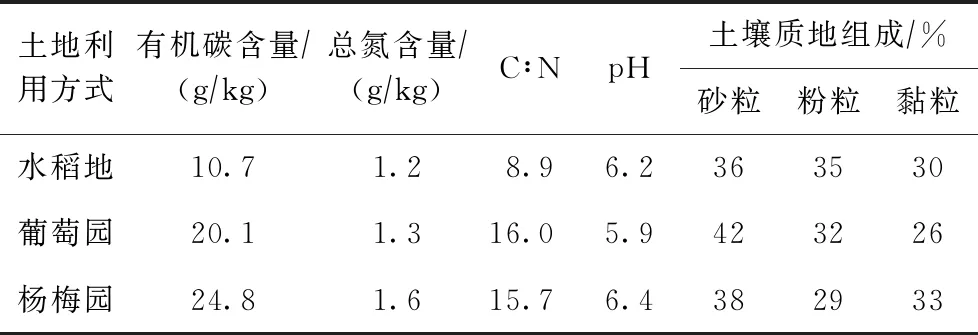
表1 试验土壤的理化性质
1.2.2土壤腐殖质的提取、纯化与溶液制备
土壤腐殖质的提取和纯化:根据国际腐殖质学会的标准化程序提取土壤腐殖质的胡敏酸(HA)和富里酸(FA)[26]. 简言之,将萃取剂与样品质量比设为10∶1,通过溶液(0.1 mol/L NaOH水溶液和0.1 mol/L Na4P2O7的1∶1混合物)来提取土壤样品. 将悬浮液在充入氮气的封闭玻璃瓶中于25 ℃下机械摇动24 h. 每个样品重复提取3次. 用6 mol/L HCl将提取物酸化至pH为1,然后5 000 r/min下离心提取物,提取的腐殖质会分离成HA(沉淀)和FA(上清液)两部分. 将HA悬浮在0.1 mol/L HCl和0.3 mol/L HF的溶液中以除去矿物杂质并透析直到氯离子被去除. 将FA用吸附树脂XAD-8纯化,并使碱性洗脱液通过阳离子交换树脂.
腐殖质溶液的配置:将HA和FA干样加到去离子水中,用0.1 mol/L NaOH溶液调节pH至8,使HA和FA充分溶解后,用0.1 mol/L HCl溶液调节pH至6,再用0.45 μm纤维素滤膜过滤,最后稀释至100 mg/L胡敏酸碳或富里酸碳的溶液,备用.
1.2.3异化铁还原菌微生物富集培养试验
采用两种异化铁还原菌ShewanellaoneidensisMR-1(S.oneidensisMR-1)与Shewanellaputrefaciens200(S.putrefaciens200),将纯种微生物接种至100 mL的微生物培养基(胰蛋白胨10 g/L,酵母膏5 g/L,NaCl 10 g/L,pH=7.2)中,置于25 ℃振荡培养箱培养12 h,得到108cells/mL的菌液浓度[27].
1.3 腐殖质作为胞外电子穿梭体的循环周期试验
根据已有试验方案[28]开展循环周期试验. 采用异化铁还原菌微生物(S.oneidensisMR-1或S.putrefaciens200)对腐殖质溶液(40 mL)进行接种,加入5 mmol/L的乳酸钠溶液作为微生物的碳源及无机盐营养液,充入N2保持厌氧状态,25 ℃振荡培养箱培养24~36 h后测定腐殖质的微生物还原容量. 具体步骤:取培养后的腐殖质溶液5 mL,加入到5 mL 5 mmol/L的柠檬酸铁溶液〔(Fe(Ⅲ)Cit)〕反应12 h以充分氧化腐殖质,过滤后利用邻菲罗啉法测定滤液中还原生成的Fe(Ⅱ)含量,从而得出腐殖质的第1次循环周期微生物还原容量. 向剩余腐殖质溶液中充入高纯O2,以重新氧化被微生物还原后的腐殖质,然后重复第1次循环周期微生物还原容量的测定步骤,测定腐殖质的第2次循环周期微生物还原容量. 按照同样的方法测定腐殖质的第3次循环周期微生物还原容量. 该研究中腐殖质的微生物还原容量用来表征电子供给能力(EDC),第3次与第1次循环周期EDC的比值可用于评估腐殖质作为胞外电子穿梭体的持续能力(ESC),采用式(1)计算.
(1)
式中:ESC为腐殖质作为胞外电子穿梭体的持续能力,%;EDCRed1、EDCRed3分别为第1次、第3次循环周期的电子供给能力,mmol/mol(以单位碳的电子当量计).
1.4 荧光光谱分析及其平行因子分析
荧光光谱采用荧光光度计〔Hitachi F-7000型,日立(中国)有限公司〕进行测定. 激发光源为150 W氙弧灯,光电倍增管电压为700 V,信噪比>110,扫描速率为12 000 nm/min,激发和发射单色仪的狭缝宽度均为10 nm,响应时间设置为自动. 激发波长(λEx)范围为200~450 nm,增量为5 nm;发射波长(λEm)范围为280~550 nm,增量为5 nm. 三维荧光光谱的平行因子分析是采用带有DOMFluor工具箱的MATLAB R2100a软件进行模拟,具体程序编写与操作步骤见文献[29]. 对于微生物厌氧还原后的HA和FA溶液样品,需预先进行离心(10 000 r/min)以去除溶液中微生物,并采用元素分析仪(Multi N/C 2100型,德国耶拿分析仪器股份公司)测定TOC浓度,调节所有样品的TOC浓度一致以保证荧光强度不受HA或FA浓度的影响,然后再进行荧光光谱分析.
2 结果与讨论
2.1 土壤腐殖质电子供给能力在微生物还原-O2氧化循环周期中的波动特征
该研究通过定量分析土壤HA和FA在3个S.oneidensisMR-1/S.putrefaciens200厌氧还原-O2氧化循环周期中EDC的变化特征来分析土壤腐殖质作为胞外电子穿梭体的持续能力,结果如图1所示. 从图1可以看出,不管是HA还是FA,二者的电子供给能力在各循环周期中均表现出相同的变化规律,在经过第1次48 h微生物厌氧还原后其电子供给能力显著提高,而当利用O2对还原的样品进行第1次氧化后其电子供给能力呈降低趋势,这种波动特征在第2次和第3次微生物厌氧还原-O2氧化循环周期中也得到了很好的体现,说明土壤HA和FA在微生物与电子受体〔Fe(Ⅲ)Cit〕之间起到了电子穿梭体的作用,且这种作用具有一定的持续性. HA和FA的电子穿梭体功能与充电电池相类似,被微生物厌氧还原后的状态相当于电池的充电状态,而被O2重新氧化后的状态则相当于电池的放电状态〔见图1(a)〕. 充电电池经过多次充电放电之后其最大充电量就无法达到原来的水平,与之类似,HA和FA经过多次还原氧化之后其潜在的电子供给能力也会有所降低.
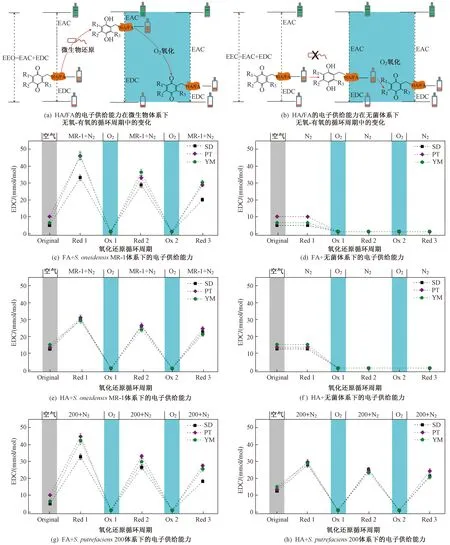
注:EAC为电子接受能力,EEC电子转移量. SD、PT和YM分别为水稻地、葡萄园和杨梅园. Original表示初始状态,Red 1、Red 2和Red 3分别表示第1次、第2次和第3次还原,Ox 1和Ox 2分别表示第1次和第2次氧化. MR-1+N2、200+N2和N2分别表示S. oneidensis MR-1、S. putrefaciens 200和无菌体系. 下同.
微生物厌氧还原后HA和FA的电子供给能力随循环周期呈逐渐降低的趋势,说明HA和FA作为电子穿梭体的功能会呈逐渐下降趋势. 然而也有研究表明,评判这种电子供给能力的大小还需要考虑提供电子给微生物的乳酸盐的丰富程度[30],这就需要在循环周期的后期及时补充乳酸盐,以保证微生物在代谢过程中有持续的电子来源. 同时测定微生物厌氧还原后HA和FA的电子接受能力(EAC),以更好地判断HA和FA作为电子穿梭体的持续能力. 如果腐殖质的电子供给能力和电子接受能力的总和在整个循环周期中都没有产生明显波动,就可以断定HA和FA作为电子穿梭体的功能具有可持续性,因为腐殖质电子供给能力与电子接受能力的总和是由腐殖质中具有氧化还原活性的官能团水平所决定的. Klüpfel等[12]研究发现,HA和FA从微生物厌氧还原到O2重新氧化的过程,氧化还原电位发生了较大变化,但就单一比较微生物厌氧还原后或O2重新氧化后的HA和FA的氧化还原电位,不同样品之间差异不大,均集中在一个很窄的范围内,说明HA和FA的微生物厌氧还原过程是一个由乳酸盐驱动的动力学过程.
该研究在微生物厌氧还原-O2氧化的循环周期中对HA和FA提纯后进行三维荧光光谱分析,并采用平行因子分析法识别出HA[25]和FA中的4个荧光组分(见图2),其中组分C1、C2和C3为类胡敏酸或类富里酸组分,C4为类蛋白物质. 基于上述4个荧光组分计算得到类胡敏酸和类富里酸组分(C1、C2和C3)占全荧光组分的百分比,结果如图3所示. 从图3可以看出,除极个别样品外,大部分样品的HA和FA氧化还原官能团含量在整个循环周期中没有发生显著变化,表明被微生物厌氧还原后HA和FA的电子供给能力随循环周期的进行呈逐渐降低的趋势与腐殖质氧化还原官能团的变化无关,而可能与乳酸盐被逐渐消耗导致后期供应不足有关,这也间接地为HA和FA作为电子穿梭体具有较好的可持续性提供了有力证据.
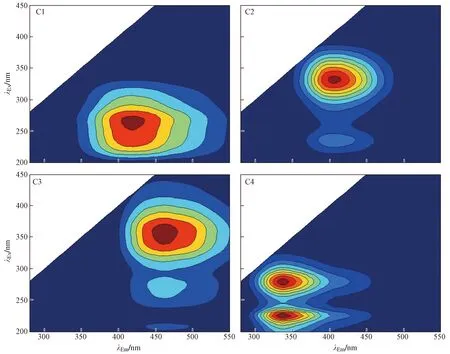
图2 土壤FA中平行因子分析鉴定出的4个荧光组分

图3 微生物体系下HA/FA中类胡敏酸和类富里酸荧光组分(C1、C2和C3)在全荧光组分中的占比在3个连续无氧-有氧循环周期中的变化
在微生物还原-O2氧化的循环周期中,HA和FA初始的电子供给能力高于经过O2重新氧化后的电子供给能力〔见图1(c)(e)(g)(h)〕,表明初始的HA和FA没有被充分氧化,仍保存有一定的本底还原容量,也表明空气对HA和FA的氧化不如纯O2对HA和FA的氧化那么彻底. 由此可见,HA和FA的潜在电子供给能力需要经过纯O2的彻底氧化才可以得到体现. 3次微生物厌氧还原后HA和FA的电子供给能力在不同样品之间表现出较大波动,而在两次O2重新氧化后HA和FA的电子供给能力在不同样品之间却比较集中(见图1),这也进一步说明了从微生物厌氧还原到O2重新氧化的过程中HA和FA的电子得到了彻底释放. 另外,还有一种可能存在的机制是,即使HA和FA没有被O2彻底氧化,但由于其中氧化还原活性官能团的失效而导致无法释放电子,这在以Fe(Ⅲ)Cit为电子受体时的情况中也是如此.
2.2 两种微生物体系下土壤腐殖质作为胞外电子穿梭体持续能力的比较
在S.oneidensisMR-1和S.putrefaciens200两种微生物体系下,HA和FA的电子供给能力在整个循环周期中呈规律性的变化特征,经微生物厌氧还原后电子供给能力增加,而经O2重新氧化后又恢复至初始水平(见图1),表明两种微生物都可以很好地在这种间歇式的缺氧和曝气的环境中生存. HA的电子供给能力在S.oneidensisMR-1和S.putrefaciens200两种微生物体系下没有明显差异,而杨梅园土壤中FA在第2次和第3次微生物厌氧还原后的电子供给能力表现为S.oneidensisMR-1体系显著高于S.putrefaciens200体系(P<0.05)(见图4),表明在S.oneidensisMR-1体系下腐殖质具有更强的电子穿梭体功能. 尽管S.oneidensisMR-1和S.putrefaciens200都能适应兼气性环境,但在土壤、湿地、海洋与湖泊沉积物等环境中S.oneidensisMR-1比S.putrefaciens200具有更广泛的分布[31-33],表明S.oneidensisMR-1在间歇性缺氧和曝气的环境中具有更强的适应能力和生存策略. 该研究中S.oneidensisMR-1和S.putrefaciens200都是在相同浓度的乳酸盐条件下进行,但S.oneidensisMR-1可能对碳源乳酸盐具有更高的利用效率,导致其体系下腐殖质表现出更高的电子穿梭体功能.S.putrefaciens200可能具有较低的乳酸盐利用效率,导致其将腐殖质作为新陈代谢的碳源,这可能使HA和FA中部分氧化还原活性官能团失效,进而导致腐殖质作为电子穿梭体的功能减弱.

注: 不同小写字母表示HA或FA的电子供给能力在S. oneidensis MR-1和S. putrefaciens 200微生物体系下差异显著(P<0.05).
尽管S.oneidensisMR-1和S.putrefaciens200对还原后HA和FA的电子供给能力会产生不同的影响机制,但还原后HA和FA的电子供给能力随循环周期进行所产生的降幅在S.oneidensisMR-1和S.putrefaciens200两种微生物体系下并没有明显差异,表明两种微生物与土壤腐殖质之间的电子传递机制是相同的. 由于纳米导线机制通常是在微生物无法接触到电子受体的情况下才被诱导产生[34-35],但该研究中采用的电子受体HA和FA都是溶解性的,与微生物具有良好的接触机会,因此,S.oneidensisMR-1和S.putrefaciens200两种微生物可能主要是通过直接电子传递的机制将细胞内代谢产生的电子传递给电子受体HA和FA. 间歇性的曝气会对微生物的生长产生影响,但S.oneidensisMR-1和S.putrefaciens200两种微生物之间直接电子传递机制的一致性却没有发生改变,说明两种微生物在直接电子传递机制上可能是由相同或同源的外膜蛋白在起作用,这种外膜蛋白主要由OmcA和MtrC构成[36].
2.3 HA和FA作为胞外电子穿梭体的持续能力的比较
由表2可知,HA初始的电子供给能力强于FA,说明在空气条件下HA能够保存更多有还原态的官能团. 通常情况下,HA的分子量和有机碳密度均大于FA[22,37],HA的结构中羧基碳的含量低于FA[38],HA的这种特征会保证其中的氧化还原活性官能团处于较掩蔽位置,从而使其较难被空气所氧化. 然而,当经过第1次微生物厌氧还原后,所有土壤样品中HA的电子供给能力却明显弱于FA(见表2),说明FA中含有更多的能够被微生物还原的氧化还原活性官能团,而分子量较大的HA,尽管可能含有更多的氧化还原活性官能团,但由于大部分处于掩蔽位置,从而使其无法被微生物所接触,这也间接地说明了微生物与土壤腐殖质之间的电子传递过程主要是通过直接电子传递机制. 当经过第2次微生物厌氧还原后,水稻地土壤样品中HA与FA的电子供给能力无显著差异,经过第3次微生物厌氧还原后的水稻地样品中HA的电子供给能力大于FA(见表2),说明HA和FA作为电子穿梭体的持续能力存在差异,其中HA的持续能力强于FA.
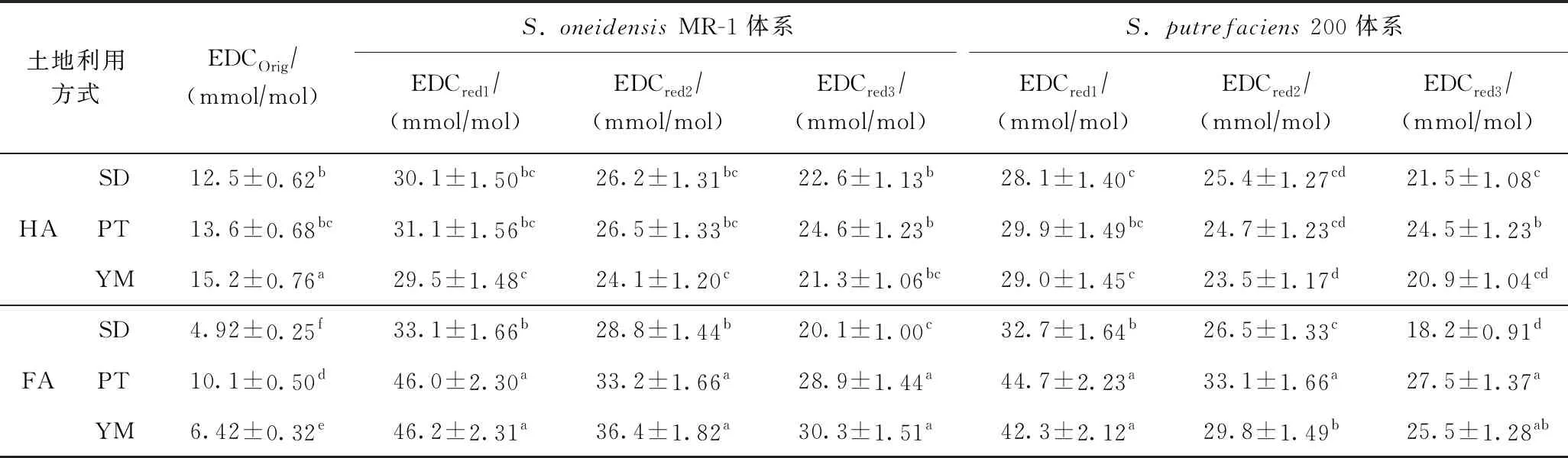
表2 HA与FA经微生物厌氧还原后电子供给能力的比较
进一步对比分析每次经过微生物厌氧还原后HA和FA电子供给能力变化幅度的差异,结果如表3所示. 由表3可知,FA经过第1次微生物厌氧还原(Red 1)后的电子供给能力与初始(Original)电子供给能力的比值(EDCRed1/EDCOrig)大于HA,但FA的EDCRed2/EDCRed1和EDCRed3/EDCRed1(即ESC)均小于HA,说明经过多次微生物厌氧还原后,HA作为胞外电子穿梭体的持续能力明显强于FA. 这种现象说明FA的结构更不稳定,在电子穿梭过程中更容易失效. 实际上,尽管FA的氧化度较高,但其在缺氧和溶液体系中较为稳定,HA则相反. 假设HA和FA电子供给能力的降低是由乳酸盐逐渐被消耗所引起的,说明微生物还原FA比还原HA需要更多的乳酸盐,但无论如何,在乳酸盐-微生物-土壤腐殖质体系下,HA作为胞外电子穿梭体的持续能力明显强于FA. 在真实土壤环境中,微生物的碳源尽管被逐渐消耗,但也会有新碳源的不断输入,从而保证了在微生物生长周期内碳源会处于一个相对平衡的状态[37],这在一定程度上可能会削弱FA和HA作为电子穿梭体的持续能力的差异.
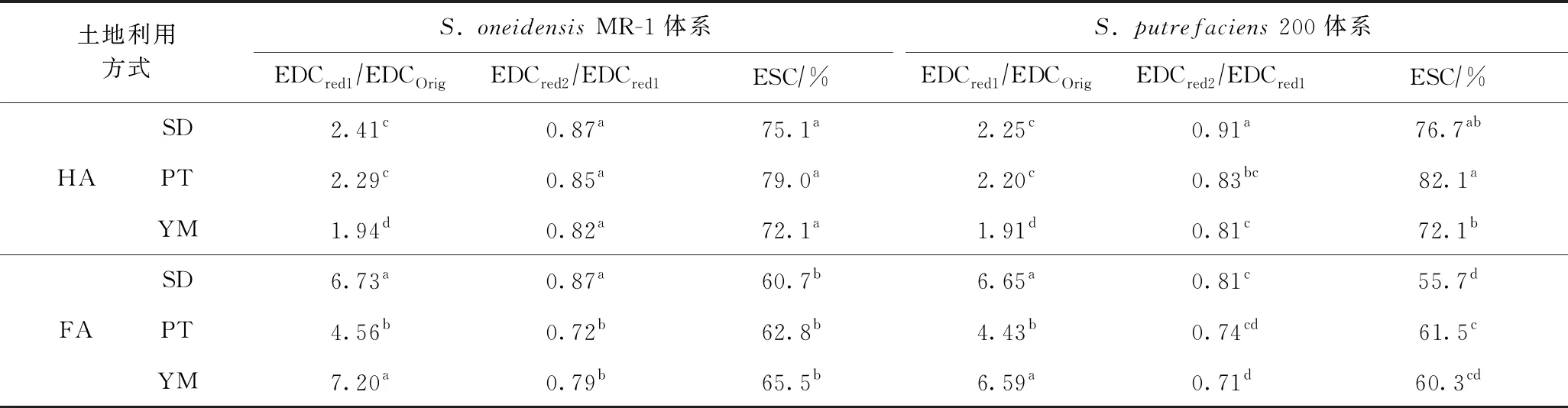
表3 不同微生物体系下厌氧还原后HA与FA电子供给能力相对变化幅度的比较
不同土壤环境条件下HA和FA的形成顺序也存在差异[36,39],从利用土壤腐殖质作为电子穿梭体来促进污染物降解转化的角度来说,可通过一定的环境调控措施形成HA,实现土壤污染物的降解转化. 然而,目前关于土壤腐殖质形成的机制仍不甚清晰,存在很多不同的土壤腐殖质形成学说,不同学说对HA和FA形成的顺序甚至持对立观点[40],因此,弄清土壤腐殖质的形成机制是理解腐殖质环境效应的前提.
2.4 不同土地利用方式土壤腐殖质作为胞外电子穿梭体持续能力的比较
不同土地利用方式之间,土壤中HA初始电子供给能力的波动比较大,而FA初始电子供给能力的波动则相对较为稳定(见图1). 水稻地和果园(葡萄园和杨梅园)土壤具有相同的成土过程,但前者HA和FA的初始电子供给能力明显小于后者(见图1和表2),且杨梅园土壤中HA初始电子供给能力最高,而葡萄园土壤中FA初始电子供给能力最高,表明土地利用方式对土壤HA和FA的初始电子供给能力具有显著影响.
当经过第1次微生物厌氧还原后,水稻地、葡萄园和杨梅园土壤之间HA的电子供给能力差异不大,而水稻地土壤中FA的电子供给能力明显小于葡萄园和杨梅园土壤FA的电子供给能力;经过第2次和第3次微生物厌氧还原后,三者表现出相同的变化趋势,可能是由于负载在FA表面的氧化还原活性官能团含量受控于土壤成土过程和用地类型.
进一步对比分析每次经过微生物厌氧还原后不同土地利用方式下土壤中HA和FA电子供给能力变化幅度的差异,由表3可知,S.oneidensisMR-1体系下,水稻地和葡萄园土壤中HA经第1次微生物厌氧还原后其EDCRed1/EDCOrig明显高于杨梅园,而水稻地和杨梅园土壤中FA的EDCRed1/EDCOrig明显高于葡萄园;水稻地土壤中HA和FA经过第2次微生物厌氧还原后EDCRed2/EDCRed1显著高于葡萄园和杨梅园;而HA或FA经过第3次微生物厌氧还原后EDCRed3/EDCRed1(电子穿梭体的持续能力)在水稻地、葡萄园和杨梅园之间无显著差异.S.putrefaciens200体系下,第1次和第2次微生物还原后的EDCRed1/EDCOrig和EDCRed2/EDCRed1表现出相同的变化趋势. 但是,第3次微生物还原后电子穿梭体的持续能力在3种土地利用方式中表现出不同的趋势,HA作为胞外电子穿梭体的持续能力表现为葡萄园最大,水稻地次之,杨梅园最小;FA作为胞外电子穿梭体的持续能力表现为葡萄园最大,杨梅园次之,水稻地最小. 平均而言,水稻地、葡萄园和杨梅园土壤中HA作为胞外电子穿梭体的持续能力分别为75.9%、80.5%和72.1%,FA作为胞外电子穿梭体的持续能力分别为58.2%、62.2%和62.9%,不同土地利用方式下腐殖质作为胞外电子穿梭体的持续能力有所不同. 这可能是土地利用方式、耕作管理方式和土壤理化性质的不同,引起土壤腐殖质的组成、转化和分解过程不同[21],进而导致不同土地利用方式下土壤腐殖质作为胞外电子穿梭体的持续能力存在差异. 此外,不同土地利用方式引起微生物电子供体碳源驱动的动力学过程不同,也会导致土壤腐殖质作为胞外电子穿梭体的持续能力存在差异.
3 结论
a) 土壤腐殖质在微生物与电子受体铁矿物间的电子传递过程中可以很好地充当胞外电子穿梭体的角色,其持续能力随微生物还原-O2氧化循环周期的变化主要由微生物电子供体碳源驱动的动力学过程所控制.
b) 相对于S.putrefaciens200体系而言,S.oneidensisMR-1体系下土壤腐殖质具有更强的电子穿梭体功能,但土壤腐殖质作为胞外电子穿梭体的持续能力在S.oneidensisMR-1和S.putrefaciens200两种微生物体系下并没有明显差异.
c) 水稻地、葡萄园和杨梅园土壤中HA作为胞外电子穿梭体的持续能力分别为75.9%、80.5%和72.1%,FA作为胞外电子穿梭体的持续能力分别为58.2%、62.2%和62.9%,不同土地利用方式土壤间具有显著差异;同时,HA作为胞外电子穿梭体的持续能力明显强于FA,这可能是由FA结构稳定性较差以及微生物在还原FA过程中电子供体碳源利用效率较低所致.
