BiOAc/BiOX(X=Cl, Br)复合材料的制备及其对混合染料的去除
2021-07-17刘海津王冰杰张亚昆彭建彪
张 慧, 刘海津, 陈 敏, 王冰杰, 张亚昆, 彭建彪, 蒋 凯
河南师范大学环境学院, 黄淮水环境与污染防治教育部重点实验室, 河南省环境污染控制重点实验室, 水处理重点技术国际联合实验室, 河南 新乡 453007
光催化技术因操作简单、能耗低、反应条件温和等优点,在环境污染治理中发挥着重要作用. TiO2是发现最早、最有前景的一种半导体光催化材料. 然而,由于可见光响应差、光生电子空穴复合率高等缺点,其在光催化领域的应用受到了诸多限制[1-4].
卤氧化铋BiOX (X=Cl, Br, I)是近年来广泛研究的Bi基半导体光催化材料. 作为一种三元氧化物,BiOX是Sillen家族中最简单的晶体之一,拥有[Bi2O2]2+层状结构[5-6],便于光生电子空穴对的分离. 与BiOX类似,BiOAc 〔CH3COO(BiO)〕具有同样的[Bi2O2]2+层状结构,且组成简单,除Bi元素外,只有绿色元素C、O和H,但文献中对BiOAc的报道却较少. 2016年,ZHANG等[7]研究发现BiOAc不溶于水或乙酸,首次在乙酸溶液中收集到BiOAc;2017年,HAN等[8]报道了BiOI/CH3COO (BiO)异质结材料,并通过降解罗丹明B (RhB)和甲基橙(MO)来评价其光催化活性; 2019年,JIA等[9]通过离子交换法合成AgI/I-BiOAc光催化材料,并通过甲基紫(MV)、甲基橙(MO)等染料以及双酚A (BPA)来评价其光催化活性;同年,ZHANG等[10]利用溶剂热法合成了BiVO4/CH3COO (BiO)异质结催化剂,在模拟太阳光照射下,对布洛芬等4种难降解有机物进行有效矿化.
随着染料行业的发展,含有不同化学结构的染料废水被集中排放和处理[11]. 离子型染料是染料中的一大类,阳离子染料溶于水后的界面电荷呈正电性,阴离子染料呈负电性[12]. 当2种或多种染料共存时,它们之间可能会产生相互作用,影响其降解过程. 然而,文献中报道的基本上是针对一种离子型染料的降解[13-15],对混合染料的研究鲜有报道.
该研究在室温条件下,以冰乙酸和氧化铋为前驱体,通过化学沉淀法和离子交换法成功合成BiOAc/BiOX (X=Cl, Br)复合材料,利用XRD、SEM、TEM、N2吸附解吸等温线、UV-vis、EIS等手段表征材料的晶体结构、光学性质以及光生电子和空穴复合情况,以阳离子混合染料RhB、亚甲基蓝(MB)〕和阴离子混合染料〔靛红(Isatin)、达旦黄(Titan yellow)〕为目标污染物,考察了不同复合比的BiOAc/BiOX的光催化性能. 同时,利用捕获试验对BiOAc/BiOX光催化体系中的反应活性物种进行检测,并对反应机理进行推测.
1 材料与方法
1.1 试剂与药品
试验所用药品均为分析纯. 其中,氧化铋、对苯醌、RhB和无水乙醇购自国药集团化学试剂有限公司(上海);冰乙酸、氯化钾、乙二醇及异丙醇购自大茂化学试剂厂(天津);氨水来自德恩化学试剂有限公司(天津);草酸铵来自天津市天力化学试剂有限公司;MB购自北京化工厂;靛红和达旦黄从公私合营新中化学厂(上海)得到. 超纯水来自Milli-Q Plus 185水净化系统(上海);去离子水自制.
1.2 催化剂的制备
1.2.1BiOAc花状微球的制备
室温下,以氧化铋和冰乙酸为前驱体,利用化学沉淀法制备BiOAc花状微球[8]. 将1 mmol氧化铋溶解于5 mL冰乙酸中,磁力搅拌使之完全溶解. 此时,悬浮液由黄色变为白色,持续搅拌6 h后静置,形成白色沉淀. 将沉淀中残留的冰乙酸离心去除,并用去离子水和乙醇交替各洗3次,离心,60 ℃下干燥过夜,收集得到白色粉末状材料.
1.2.2BiOAc/BiOX的制备
通过离子交换法和化学沉淀法制备BiOAc/BiOCl复合材料. 在上述制备BiOAc的白色悬浮液中,加入20 mL去离子水使白色悬浮液溶解至澄清,并持续搅拌30 min形成溶液A;将不同质量的KCl溶于20 mL氨水溶液(4 mmol/L),搅拌30 min形成溶液B. 将溶液A逐滴加入溶液B中,搅拌4 h至离子交换反应平衡,将沉淀物分离,用去离子水和乙醇交替各洗3次,60 ℃下干燥过夜,得到白色粉末状材料.
根据加入KCl的量为4、8、12、16和32 mmol,分别命名为BOBCl 2-1、BOBCl 4-1、BOBCl 6-1、BOBCl 8-1和BOBCl 16-1. 将KCl换成KBr,通过同样的方法制备BiOAc/BiOBr.
1.2.3BiOCl的制备
通过溶剂热法合成BiOCl[16]. 首先,配制乙二醇/乙醇混合溶液30 mL(体积比为2∶1);随后,将0.145 g Bi(NO3)3·5H2O加入混合溶液,搅拌30 min形成溶液A;接着,加入0.224 g KCl至溶液A,搅拌30 min形成溶液B. 将溶液B转入100 mL聚四氟乙烯内衬的反应釜中,180 ℃加热6 h. 反应釜冷至室温后,离心并用去离子水和乙醇交替各洗3次,60 ℃下干燥,得到BiOCl.
1.2.4BiOBr的制备
通过溶剂热法合成BiOBr[17]. 将2 mmol的Bi(NO3)3·5H2O 和2 mmol的KBr分别溶于10 mL乙二醇中,磁力搅拌30 min形成溶液A和B. 将溶液A逐滴加入溶液B中,磁力搅拌30 min. 随后将混合溶液转移至100 mL聚四氟乙烯反应釜中,150 ℃下加热8 h,冷却至室温. 离心,去离子水和乙醇交替各洗3次,60 ℃下干燥,得到BiOBr.
1.3 光催化活性和稳定性评价
在光源为5 W LED灯(λ> 390 nm)的多通道光催化仪中(PCX50B,北京泊菲莱科技有限公司),将30 mg材料加入装有50 mL RhB (6 mg/L)和MB(6 mg/L)或者靛红(Isatin,20 mg/L)和达旦黄(Titan yellow,20 mg/L)混合溶液的石英反应瓶中. 在黑暗条件下磁力搅拌一定时间以达到吸附-解吸平衡(转速为400 r/min). 开启光源,在一定的时间间隔提取3 mL 悬浮液,离心后取上清液,在UV-2900分光光度计上于554 nm(RhB)和664 nm(MB)或610 nm(靛红)和410 nm(达旦黄)波长下测吸光度. 降解率计算公式:
η=(C0-C)/C0×100%
(1)
式中:η为降解率,%;C0为吸附前RhB(或MG或靛红或达旦黄)溶液的浓度,mg/L;C为吸附平衡和光照反应过程中的样品浓度,mg/L.
选用催化活性最佳的材料进行重复试验. 每次试验结束后将材料离心分离,用去离子水和乙醇反复清洗表面残留的染料,干燥后进行下一个循环试验.
1.4 材料的表征
通过德国Bruker-D8-AXS衍射仪(XRD)进行晶体结构及物相分析. 利用日本JEOL JSM-6390LV扫描电子显微镜(SEM)和JEOL JEM 2100F高分辨率透射电子显微镜(TEM)观察其微观形貌. 通过EDS(SEM仪器的一部分)表征材料的元素组分. 利用美国Micromeritics ASAP 2020,并根据氮吸附等温线检测比表面积(BET). 以BaSO4为标准,在美国Lambda 950 (UV-vis)上采集样品的紫外可见漫反射光谱. 在CHI660E型电化学工作站(上海辰化仪器公司)上测试材料的电化学性能(EIS),具体条件:以饱和甘汞电极为参比,铂电极为对电极,将0.025 g样品、60 μL全氟磺酸和0.5 mL乙醇溶液混合超声后滴在导电玻璃上做工作电极.
2 结果与讨论
2.1 催化剂的表征分析
2.1.1XRD分析
由图1(a)可见,BiOAc的衍射峰与BiOAc的标准卡片JCPDS NO.14-0800[10]、BiOCl的衍射峰和BiOCl的标准卡片JCPDS NO.06-2049相一致. 当KCl的投加量为4 mmol时,BOBCl 2-1在2θ为25.16°~27.25°范围内出现2个衍射峰,分别与BiOAc的(101)和(102)晶面相对应,但发生少许偏移. 随着KCl的持续增加,这2个衍射峰位置继续发生偏移,并逐渐与BiOCl的(002)和(101)晶面相对应,BiOAc/BiOCl的其他衍射峰也分别与BiOCl的各晶面位置相对应.

图1 BiOAc/BiOCl和BiOAc/BiOBr的XRD图谱
图1(b)中,BiOBr的衍射峰与BiOBr的标准卡片JCPDS NO.09-0393[8,19]相一致. 样品BOBBr 2-1在2θ为24.16°和28.35°处的衍射峰与BiOAc的(101)和(102)晶面对应,但位置略有偏移,可能是BiOAc和BiOBr间存在的作用力所致. 随着KBr量的持续增加,这2个衍射峰的强度逐渐降低并消失. 同时,在对应BiOBr(011)晶面处的衍射峰出现,说明复合物中BiOBr的量在逐渐增加. 另外,不同复合比的BiOAc/BiOBr的其他衍射峰位置分别与BiOBr各晶面相对应. 以上不同比例BiOAc/BiOX衍射峰的变化说明,KCl或KBr已经成功地与BiOAc进行离子交换,生成了相应的复合物.
2.1.2材料的形貌表征
通过SEM对样品的形貌进行观察. BiOAc呈花状微球结构,由50 nm左右的纳米片组装而成〔见图2(a)〕,表面以及边缘比较平滑. 相较于BiOAc,BiOAc/BiOCl〔见图2(b)〕和BiOAc/BiOBr〔见图2(c)〕的片状结构变薄,花状微球结构被破坏,层状纳米片之间有较大的间隙,有利于对污染物的吸附. 图3的能谱图显示,BiOAc/BiOCl复合材料中分布着Bi、O、Cl、和C元素,BiOAc/BiOBr中分布着Bi、O、Br、和C元素,说明二者均为复合物.

图2 BiOAc、BiOAc/BiOCl、BiOAc/BiOBr的SEM图片

图3 BiOAc/BiOCl和BiOAc/BiOBr能谱图
从BiOAc/BiOCl和BiOAc/BiOBr的TEM图(见图4)可以更加清晰地观察到其片状结构,大小为100~200 nm. 在高分辨图谱中,BiOAc/BiOCl中的晶格间距0.188和0.244 nm分别与BiOCl(201)和BiOAc(003)晶面相吻合. BiOAc/BiOBr中的晶格间距0.281和0.277 nm,分别与BiOAc(110)和BiOBr(110)晶面相吻合,进一步表明BiOAc/BiOCl和BiOAc/BiOBr异质结的成功合成.

图4 BiOAc/BiOCl、BiOAc/BiOBr的TEM图片
材料的N2吸附解吸等温线(见图5)显示,BiOAc及BiOAc/BiOCl、BiOAc/BiOBr复合物均为大孔结构. BiOAc、BiOBr和BiOCl的比表面积分别为13.009、10.658和10.286 m2/g,复合后BOBCl6-1的比表面积为9.609 m2/g,略有减小;而BOBBr6-1的比表面积为18.140 m2/g,均大于BiOAc和BiOBr,这也许是BiOAc/BiOBr吸附性能大幅增加的原因之一.

图5 BiOAc/BiOCl和BiOAc/BiOBr的N2吸附解吸等温线
2.1.3UV-vis DRS分析
用紫外可见漫反射(UV-vis DRS)分析样品的光吸收性能和能带结构,结果如图6(a)所示. 与BiOCl相比,所有BiOAc/BiOCl在紫外区的吸收均有所降低. Tauc公式[18]:
αhv=A(hv-Eg)n/2
(2)
式中:α为吸收系数;h为普朗克常数;ν为入射光子频率,Hz;A为常数;Eg是半导体材料的禁带宽度,eV;n与半导体的类型有关,直接带隙半导体的n取值1,间接带隙半导体的n取值2,BiOAc和BiOCl均为直接半导体,所以n均取值为1[8]. 将(Ahν)1/2与hν绘图〔见图7(a)〕,得出BiOAc、BiOCl、BOBCl 2-1、BOBCl 4-1、BOBCl 6-1、BOBCl 8-1和BOBCl 16-1的禁带宽度分别为3.28、3.10、3.22、3.08、3.10、3.14和3.15 eV. 材料的价带和导带位置可以利用式(3)(4)进行计算:
EVB=X-E0+0.5Eg
(3)
ECB=EVB-Eg
(4)
式中:EVB为半导体的价带电势,eV;ECB为半导体的导带电势,eV;X为半导体的电负性,eV;E0为氢电极上自由电子的能量,取值4.5 eV. 根据文献[8,18]可知,BiOAc和BiOCl的电负性分别为6.48和6.65 eV. 因此,BiOAc和BiOCl的EVB分别为3.62和3.7 eV,ECB分别为0.34和0.6 eV.
由图6(b)可见,与BiOBr相比,不同复合比的BiOAc/BiOBr在紫外区的吸收均有降低,但总体上强于BiOAc;且BiOAc/BiOBr的吸收边带与BiOAc相比,均发生了红移,并扩展到400 nm以上. 根据图7(b)和BiOBr的电负性(6.65 eV[8,20]),计算得到BOBBr 2-1、BOBBr 4-1、BOBBr 6-1、BOBBr 8-1和BOBBr 16-1的带隙分别为2.70、2.78、2.62、2.61和2.68 eV,接近BiOBr的带隙(2.71 eV). BiOAc和BiOBr的EVB分别为3.62和3.04 eV,ECB分别为0.34和0.33 eV.
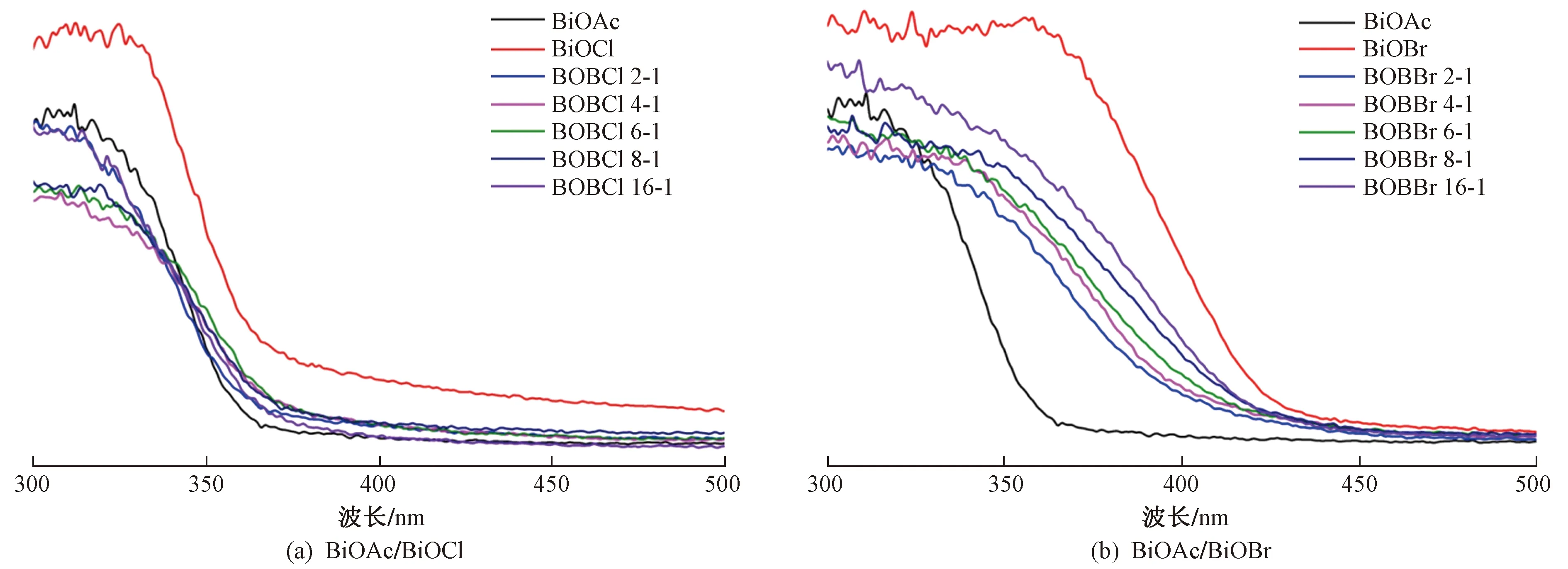
图6 BiOAc/BiOCl和BiOAc/BiOBr的紫外可见漫反射光谱

图7 BiOAc/BiOCl和BiOAc/BiOBr的禁带宽度
2.1.4EIS分析
通过EIS表征材料的光生电子空穴分离情况. 由图8(a)(b)可以明显看到,BiOAc/BiOX复合材料的电化学阻抗均小于BiOAc、BiOCl或BiOBr,说明BiOAc/BiOX中光生载流子传输阻抗低于BiOAc和BiOX[21],证实BiOAc和BiOX异质结的形成可以有效促进光生电子和空穴的分离,从而提高光催化性能.
2.2 污染物降解研究
2.2.1光催化试验
印染废水中通常存在多种染料,因此,以混合染料作为目标污染物比单一染料更有意义. 笔者以阳离子混合染料〔罗丹明B(RhB)和亚甲基蓝(MB)〕以及阴离子混合染料〔靛红(Isatin)和达旦黄(Titan yellow)〕作为目标污染物来评价所制备材料的光催化活性. 各反应体系的吸附平衡时间通过单独的吸附试验确定,这里只给出了吸附平衡时的数据.
从BiOAc/BiOCl对阳离子混合染料中RhB的降解情况〔见图9(a)〕可以看到,光照300 min后,BiOAc对RhB的降解率仅67.2%,BiOCl的降解率为87.3%. 同样条件下,所有BiOAc/BiOCl对RhB的降解率均在90%以上,其中BOBCl6-1的降解率高达97.4%. 从图9(b)的MB的降解曲线可以看出,BiOAc/BiOCl复合材料在避光时,可以更有效地吸附MB分子,其中BOBCl 4-1和BOBCl 6-1的吸附率高达60.7%和61.4%. 开灯后,240 min时BOBCl 6-1对MB的降解效率达95.7%. 而同样条件下,BiOAc和BiOCl对MB的降解率只有5%和75%左右.
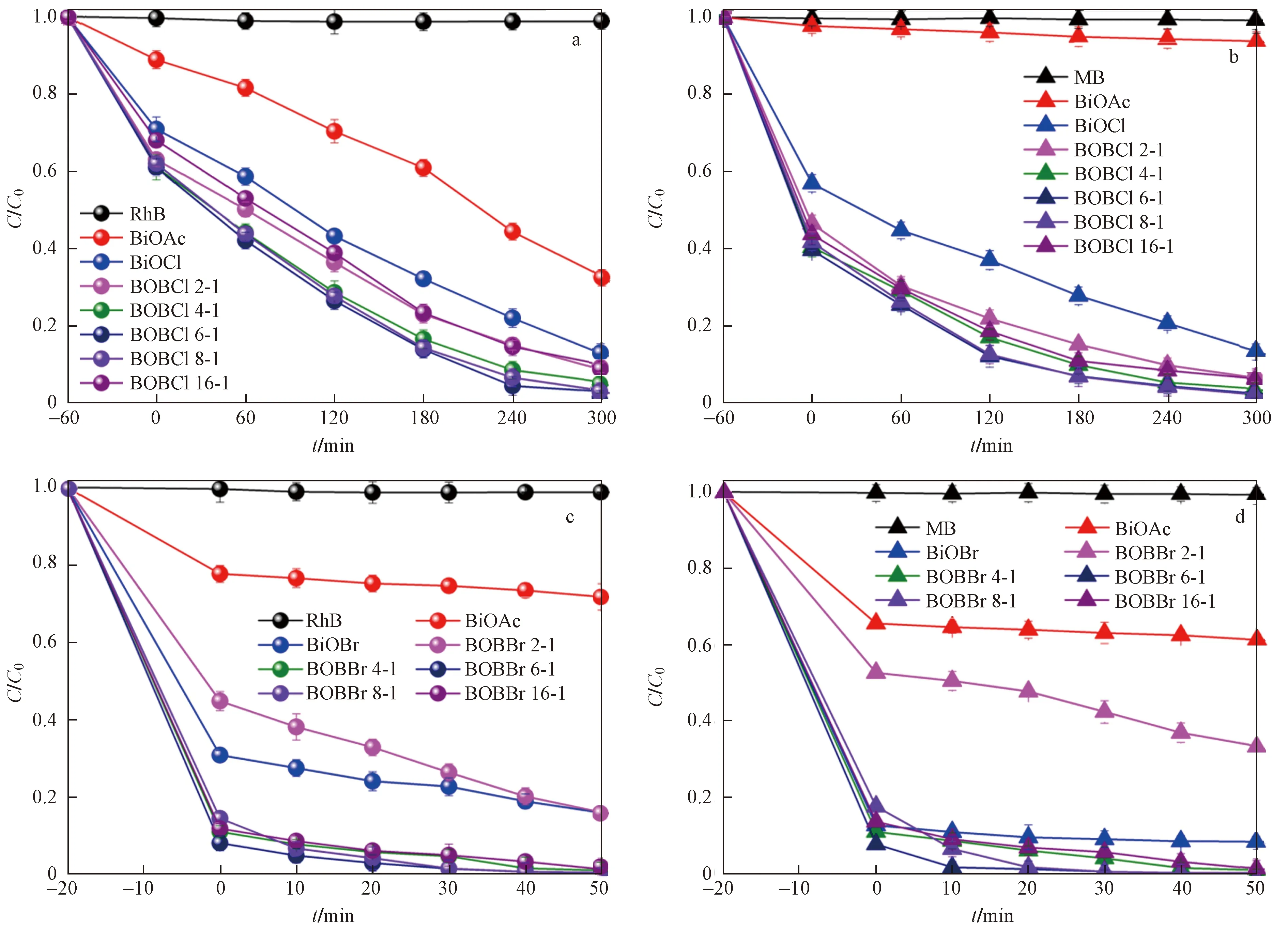
图9 BiOAc/BiOX对阳离子混合染料RhB和MB降解曲线
在BiOAc/BiOBr对阳离子混合染料的降解试验〔见图9(c)(d)〕中,由于BiOBr对RhB和MB的吸附能力较强,BiOAc/BiOBr复合材料比BiOAc/BiOCl对2种染料的吸附能力增加许多,可达90%左右,因此对2种染料的去除也更快速(50 min内)、更彻底(降解率几乎为100%).
从阳离子混合染料降解过程中的紫外吸收光谱图〔见图10(a)(b)〕可以看出,2种阳离子染料的最大吸收峰高度均随时间下降,且吸收峰位置没有发生明显的偏移,表明阳离子混合染料在BiOAc/BiOX异质结催化剂表面得到有效去除. 尤其是BiOAc/BiOBr,对RhB和MB具有极强的吸附能力. 众所周知,污染物在催化材料表面的吸附是进行光催化降解的前提,因此,光催化材料对污染物的吸附越强,污染物在其表面的接触机会越大,越有助于降解的进行.

图10 BiOAc/BiOCl和BiOAc/BiOBr降解阳离子混合染料的紫外吸收光谱
BiOAc/BiOX对阴离子混合染料靛红和达旦黄的降解情况如图11所示. 在BiOAc/BiOCl复合材料中〔见图11(a)〕,BOBCl 6-1展示出最佳的光催化效果,光照120 min后对靛红的降解率达到92.2%. 在BiOX/BiOCl对达旦黄的降解中〔见图11(b)〕,不同复合比的BiOAc/BiOCl的光催化降解率均优于BiOAc,其中,BOBCl 6-1的降解活性达到BiOAc的2.6倍. BiOAc/BiOBr对阴离子混合染料的降解中〔见图11(c)(d)〕,BOBBr 6-1表现出最佳的光催化活性.

图11 BiOAc/BiOX对阴离子混合染料Isatin和Titan yellow降解曲线
从阴离子染料的紫外吸收光谱图(见图12)中可以看到,BiOAc/BiOCl和BiOAc/BiOBr对阴离子混合染料的降解过程中,靛红和达旦黄的吸收峰均呈明显的下降趋势,且吸收峰位置未发生明显偏移,表明BiOAc/BiOX异质结也能有效地去除阴离子混合染料.
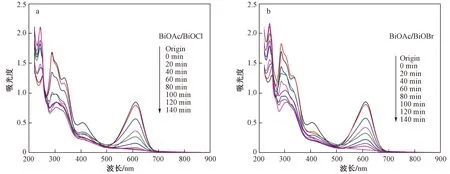
图12 BiOAc/BiOCl和BiOAc/BiOBr降解阴离子混合染料的紫外吸收光谱
通过对比图8~12可知,避光吸附阶段,与阴离子染料(靛红和达旦黄)相比,BiOAc/BiOX能更有效吸附阳离子染料(RhB和MB),说明BiOAc/BiOX对阴阳离子染料的吸附具有一定的选择性,这可能与目标污染物的界面电荷性质及化学结构有关[16]. 研究表明,在半导体界面上有效地吸附污染物,可以增加材料与污染物接触的活性位点,加快活性基团的传输效率,从而提高光催化性能[22].
稳定性是光催化材料性能的一个重要指标. 选取复合材料中性能最好的BOBCl 6-1和BOBBr 6-1进行循环试验,来考察复合材料的稳定性. 由表1可以看出,循环5次后,在相应的反应时间内,BOBCl 6-1对阳离子混合染料RhB和MB的降解率分别从97.4%和95.7%降到91.5%和90.3%;对阴离子染料靛红和达旦黄的降解率分别降低了4.9%和5.5%. BOBBr 6-1对阳离子染料RhB和MB的降解率均保持在90%以上,对阴离子染料靛红和达旦黄的降解率也分别维持在90%和70%左右,这说明该方法合成的BiOAc/BiOX具有良好的催化稳定性.

表1 BiOAc/BiOX循环试验下对染料的降解率
2.2.2TOC去除率
为了探究降解过程中污染物是否被彻底分解,对降解过程的TOC变化进行检测,结果如图13所示. 虽然经过不同时间的光照,BiOAc/BiOX对RhB和MB的降解率均在97%以上,但在同样的光照时间内,TOC去除率只有57%左右〔见图13(a)〕. 不过,TOC去除率仍有继续增加的趋势. 同样,BiOAc/BiOX对阴离子混合染料(靛红和达旦黄)的TOC去除也有类似的滞后现象〔见图13(b)〕,说明染料在光照和催化材料作用下生成了一些有机中间产物,需要更多的反应时间来彻底去除这些有机物.
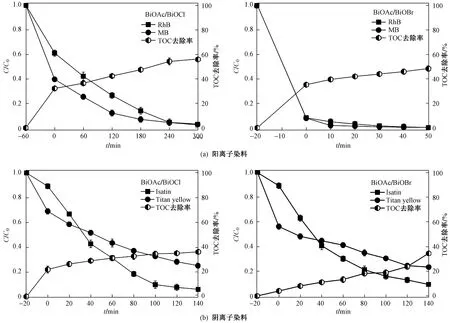
图13 BiOAc/BiOCl和BiOAc/BiOBr对阳离子染料及阴离子染料的降解和TOC去除率
2.3 机理研究
2.3.1活性物种的鉴定
为了检测BiOAc/BiOX在光催化过程中产生的活性物种,进行了自由基捕获试验. 在阳离子和阴离子混合染料中分别加入对苯醌(BQ)、草酸铵(AO)和异丙醇(IPA)来捕获·O2-、h+和·OH自由基[23-25],以阳离子染料RhB和阴离子染料靛红为代表进行数据分析. 在BiOAc/BiOX降解RhB的试验〔见图14(a)〕中,加入IPA后,RhB的降解受到了轻微的抑制;而加入BQ和AO以后,RhB的降解受到显著的抑制. 在BiOAc/BiOX降解靛红的试验中加入IPA后,也出现了类似现象〔见图14(b)〕. 以上结果表明,在BiOAc/BiOX对RhB和靛红的降解过程中,·O2-和h+是主要的活性物种,同时也会有少量的·OH产生. 另外,·O2-和h+对阴阳离子染料的抑制程度并不完全相同,在阳离子混合染料体系中,活性物种作用的大小顺序为h+>·O2->·OH;而在阴离子体系中,活性物种作用的大小顺序为·O2->h+>·OH,这可能是由于RhB和靛红表面所带电荷不同,光催化材料的界面性质也存在差异,与活性物种的反应活性也不尽相同[26].

图14 BiOAc/BiOCl和BiOAc/BiOBr对阳离子染料RhB和阴离子染料Isatin的自由基捕获试验
2.3.2光催化机理
基于上述试验结果,笔者对BiOAc/BiOX(X=Cl, Br)的光催化机理进行了推测〔见图15〕. 当LED灯(λ>390 nm)照射时,BiOAc不能被激发(Eg=3.28 eV),此时,BiOX被激发产生e-和h+,e-从VB跃迁至CB上. 当BiOAc和BiOX复合后,在两者的界面间会形成p-n异质结[9,20],由于n型BiOAc和p型BiOX的费米能级(Ef)存在电势差,为了使二者的费米能级平衡,BiOAc的Ef向下移动,而BiOX的EF向上移动,直至二者的费米能级达到一致[27],此时,位于BiOX中CB上的e-会转移至BiOAc的CB上;同时,光照后的染料分子会发生敏化作用,激发产生的e-也会转移至BiOAc中CB上. 材料表面吸附的溶解氧会被BiOAc中CB上的e-所捕获,产生·O2-和·OH[28-29],而留于BiOX的VB上的h+可直接与污染物发生反应. 这些活性物种(·O2-、h+和·OH),分别与染料分子发生氧化还原反应,最终可能转化为CO2和H2O[30].

图15 BiOAc/BiOCl和BiOAc/BiOBr可能的光催化机理示意
3 结论
a) 通过简单的离子交换法合成不同比例的BiOAc/BiOX(X=Cl, Br)复合光催化剂,该合成方法在室温下进行,步骤简单、节能.
b) 各种表征分析和对阴阳离子混合染料的光催化降解结果显示,BiOAc与一定量的BiOX复合后可以改变BiOAc的光吸收性质和禁带宽度,提高光生电子和空穴的分离效率,对污染物的去除增加. BiOAc/BiOBr与BiOAc/BiOCl相比,对阳离子染料的吸附能力更强,因此表现出更好的去除效果.
c) 自由基捕获试验证明,在阴阳离子染料光催化降解体系中起主要作用的活性物种均为·O2-和h+,但在阳离子染料体系中,h+的作用大于·O2-,而在阴离子染料体系中,·O2-的作用大于h+.
d) BiOAc/BiOX在复合过程中形成了异质结结构,通过光生电子在二者导带间的迁移抑制了光生电子和空穴的复合率,进而提高了光催化性能.
e) BiOAc/BiOX复合材料具有较好的稳定性,可以进行回收和重复使用.
