高分辨率熔解曲线法检测饮用水中两种假单胞菌
2021-07-16周梦诗何利华张建中
岳 苑,周梦诗,徐 娟,李 睿,何利华,赵 飞,张建中,龚 杰
假单胞菌属(Pseudomonasspp.),专性需氧的革兰阴性无芽胞、有荚膜杆菌,呈杆状或略弯。大多数菌的适温为30℃,存在于土壤、淡水、海水中。假单胞菌属中研究最多的是铜绿假单胞菌(Pseudomonasaeruginosa)[1],是伤口感染较常见的一种细菌,能引起化脓性病变。脓汁呈绿色,故又称脓杆菌。广泛分布于自然界(泥土、水、空气和植物)及正常人皮肤、肠道和呼吸道,是临床上较常见的条件致病菌之一[2],且对消毒剂、紫外线、干燥等条件具有很强的抵抗力[3],尤其是在免疫系统受损的患者中[4],能够引起急性肠道炎、脑膜炎、败血症和皮肤炎症等疾病[5]。
现行国家标准 GB 19298-2014《食品安全国家标准 包装饮用水》[6]和GB 8537-2018 《食品安全国家标准 饮用天然矿泉水》[7]都对铜绿假单胞菌有限制要求,说明桶装饮用水被该菌污染后,可能危害消费者的健康[5,8-9]。近年来,铜绿假单胞菌引起的食物中毒的事件时有发生,给消费者带来了食品安全隐患[10]。
国家标准中分离铜绿假单胞菌的方法为传统的生化鉴定方法,鉴定耗时长(7 d左右)、操作步骤繁杂,而且恶臭假单胞菌的菌落形态与部分非蓝绿色铜绿假单胞菌极其相似,难以分辨。除生化鉴定方法外,还有普通PCR法[11-12]和Real-time PCR法[13-14]。普通PCR法比较费时,而Real-time PCR法探针成本较高。高分辨率熔解曲线(High Resolution Melting,HRM)是一种新型基因分型技术,原理在于DNA序列的差异使得熔解温度不同,最终形成不同形态的熔解曲线。该技术通常与实时荧光PCR相结合,能够实时监测温度上升时双链DNA的解链过程[15]。HRM技术无需荧光标记探针,不受突变位点的影响,具有高灵敏度、高通量、操作简单、成本低等诸多优点,目前已在细菌[15-17]、真菌[18-19]、病毒[20-21]、寄生虫[22]的检测等方面显示较强的鉴别能力和优势,并将在其他领域发挥更广泛的作用。本文基于高分辨率熔解曲线的方法,采用一对引物同时鉴别铜绿假单胞菌 (P.aeruginosa)和恶臭假单胞菌 (P.putida),用于包装饮用水的日常检测中。
1 材料与方法
1.1 材 料
1.1.1 菌株与样品 铜绿假单胞菌ATCC27853、铜绿假单胞菌CMCC10104、恶臭假单胞菌CICC20544、肠炎沙门菌CICC21482、单增李斯特菌ATCC19115、阪崎肠杆菌CICC21544、金黄色葡萄球菌ATCC25923、大肠埃希氏菌ATCC25922由宁夏回族自治区食品检测研究院提供。奇异变形杆菌、空肠弯曲菌、阴沟肠杆菌、肺炎克雷伯菌、副溶血性弧菌、白色念珠菌、克柔念珠菌临床分离株由中国疾病预防控制中心传染病预防控制所诊断室提供。
样品购自宁夏银川市兴庆区和金凤区的6家超市,包括桶装饮用水和矿泉水样本共64份。
1.1.2 主要仪器和试剂 ABI QuantStudio 6 flex荧光定量PCR仪(Applied Biosystems);高速离心机(Thermo Fisher);梯度PCR仪(Sensoquest);Premix Ex Taq(Takara);Evagreen(Biotium);细菌基因组 DNA 提取试剂盒(TIANGEN);质粒小提试剂盒(TIANGEN);营养琼脂(北京陆桥技术有限责任公司);布氏肉汤(Oxoid);马铃薯葡萄糖琼脂(广东环凯生物科技有限公司);CN琼脂(广东环凯生物科技有限公司);引物探针由生工生物工程股份有限公司合成。
1.2 方 法
1.2.1 设计引物 本文研究了铜绿假单胞菌和恶臭假单胞菌的基因组序列,在16S rDNA序列中寻找差异性靶序列。序列比对使用 Lasergene SeqMan 软件,设计引物使用Primer Express 3.0软件。实验过程先经过梯度PCR,筛选出能扩增的引物同时确定退火温度。以目标菌和非假单胞菌为模板扩增,选择即无非特异性产物又能够同时鉴别2种目标菌的引物。PCR产物长度为104 bp(图1)。
F: 5′-CTTGCCTTGGATTCAGCG-3′
R: 5′-CTCAGGACGTATGCGGTATT-3′

图1 假单胞菌16S rDNA序列Fig.1 16S rDNA sequence of Pseudomonas spp.
1.2.2 DNA提取 铜绿假单胞菌ATCC27853、铜绿假单胞菌CMCC10104、恶臭假单胞菌CICC20544、肠炎沙门菌CICC21482、单增李斯特菌ATCC19115、阪崎肠杆菌CICC21544、金黄色葡萄球菌ATCC25923、大肠埃希氏菌ATCC25922、奇异变形杆菌、空肠弯曲菌、阴沟肠杆菌、肺炎克雷伯菌接种于营养琼脂,37 ℃培养24 h。空肠弯曲菌接种于布氏肉汤,42 ℃培养24 h。 白色念珠菌和克柔念珠菌接种于马铃薯葡萄糖琼脂,28 ℃培养72 h。按照DNA提取试剂盒说明书提取DNA。
1.2.3 建立反应体系 反应体系为30 μL:2Mix Taqman PCR Master 15 μL、上下游引物各1 μL(10 μmol/L)、Rox Reference DyeⅡ(100×)0.3 μL、Evagreen 20×in Water 1.5 μL、DNA模板2 μL(10~100 ng/μL),ddH2O 9.2 μL。
反应程序:95 ℃10 min;95 ℃15 s,68 ℃40 s, 扩增40个循环。熔解程序:95 ℃ 10 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。所有程序的升降温速度控制在1.6 ℃/s。
1.2.4 特异性试验 在1.2.3的基础上,以2种假单胞菌和其它非目标菌株的基因组DNA为模板进行PCR反应。
1.2.5 灵敏度试验 制备两种目标菌的质粒标准品进行基因拷贝数的测定。将质粒按1.2.2的方法培养后,按照质粒提取试剂盒说明书提取DNA。用上述的反应条件与反应体系进行灵敏度试验。
1.2.6 检测样本 购自银川地区的桶装饮用水和矿泉水样本共64个,按照GB 8538-2016和GB 19298-2014中针对铜绿假单胞菌的检验方法,在无菌条件下将250 mL水样用孔径0.45 μm的滤膜过滤,将滤膜移至CN琼脂上,于36 ℃培养48 h。将滤膜上的菌苔刮下用DNA提取试剂盒提取DNA,进行HRM-Real time PCR扩增,同时使用国标方法进行鉴定,将2种方法的检测结果进行比对。

A 熔解曲线图
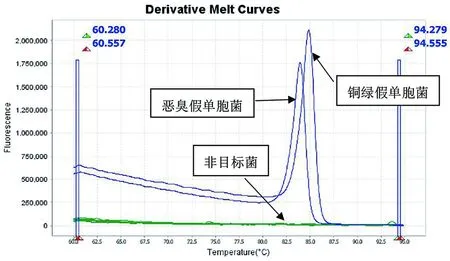
B HRM熔解峰值图
2 结 果
2.1 特异性试验 本方法在单核苷酸熔解的同时检测荧光强度。判断依据是不同Tm值的熔解峰代表不同的假单胞菌,其中Tm值在83 ℃~84 ℃出现熔解峰为恶臭假单胞菌 (Pseudomonasputida);Tm值在84 ℃~85 ℃出现熔解峰为铜绿假单胞菌 (Pseudomonasaeruginosa)。其他12种非目标菌无交叉反应。见图2。
2.2 灵敏度试验 如图3所示,铜绿假单胞菌和恶臭假单胞菌的检测低限分别为41个拷贝数和48个拷贝数。
2.3 检测样本 桶装饮用水和矿泉水样本共64份,按照GB 8538-2016和GB 19298-2014中针对铜绿假单胞菌的检验方法过滤培养后,分别采用HRM-Real time法和国标方法同时进行检测。2种方法检测阳性的结果用16S rDNA扩增后测序,经过 BLAST 比对,选取相似性最高的菌种 16S rDNA 序列,采用最大似然法(MiximumLikelihood) 构建系统发育树,对阳性结果进行验证。结果显示:在64份样本中,用HRM-Real time法检测到铜绿假单胞菌6份、检测到同时含有铜绿假单胞菌和恶臭假单胞菌3份、检测到恶臭假单胞菌2份。国标方法检测到铜绿假单胞菌6份(见表1、图4)。
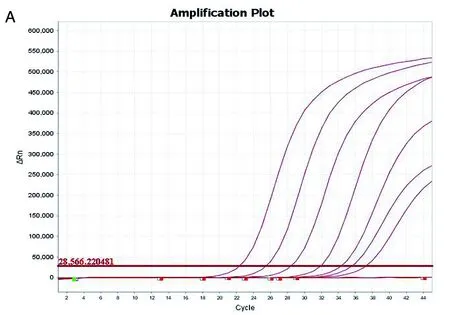
注:由左至右曲线的浓度依次为:4.1×107拷贝数、4.1×106拷贝数、4.1×105拷贝数、4.1×104拷贝数、4.1×103拷贝数、4.1×102拷贝数、4.1×101拷贝数A 铜绿假单胞菌灵敏度试验
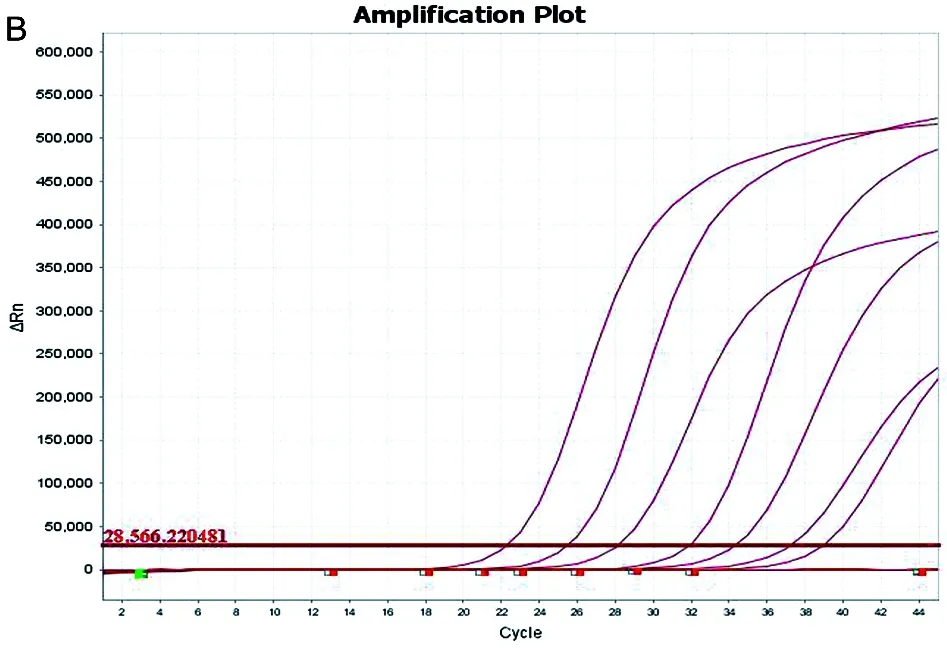
注:由左至右曲线的浓度依次为:4.8×107拷贝数、4.8×106拷贝数、4.8×105拷贝数、4.8×104拷贝数、4.8×103拷贝数、4.8×102拷贝数、4.8×101拷贝数B 恶臭假单胞菌灵敏度试验

表1 样本检测结果Tab.1 Samples test results

注:标号NSJ为本研究鉴定的菌株图4 阳性样品16S rDNA系统进化分析Fig.4 Phylogenetic analysis of 16S rDNA positive samples
3 讨 论
高分辨率熔解曲线分析技术是近年来国际上最新兴起的核酸研究新手段,其核心在于饱和DNA荧光染料的出现。与传统的基于熔融曲线分析的PCR方法相比,HRM不需要昂贵的荧光标记探针,使用闭合管PCR方法,可同时扩增和分析大量样本,无需进一步的人工分离步骤,也无需PCR后的手工分析。这有利于避免在凝胶过程中存在误差,缩短分析时间。
本研究采用高分辨熔解曲线分析技术,由于目的基因序列的差异能够使得双链DNA的Tm值发生变化,导致在升温过程中双链DNA解链时间不同,从而形成不同的熔解曲线。基于这一原理,我们研究了铜绿假单胞菌和恶臭假单胞菌的基因组序列,在16S rDNA序列中寻找差异性靶序列,通过精心设计,从24对引物中筛选出一对特异性引物。从图1可以看出,虽然这2种菌16S rDNA的扩增序列只有7个碱基的差异,但是利用HRM技术依然能够特异地鉴别上述2种目标菌。
本研究的初衷在于在包装饮用水和矿泉水的日常检测中发现,铜绿假单胞菌极少单独存在,一般与恶臭假单胞菌、荧光假单胞菌等一同存在于饮用水中,这就给铜绿假单胞菌的分离鉴定工作带来一定困难,尤其是非蓝绿色产荧光的铜绿假单胞菌,在菌落形态上与恶臭假单胞菌和荧光假单胞菌难以分辨,增加了分离的难度。本文检测的64份样本中6份样本检出铜绿假单胞(蓝绿色菌落),2份样本检出恶臭假单胞(淡黄色菌落),3份样本同时检出铜绿假单胞和恶臭假单胞菌(均为淡黄色菌落)。使用国标方法检测有6个样本测出铜绿假单胞菌,结果与HRM-Real time PCR法的结果一致。由于国标方法只针对铜绿假单胞菌,所以无法对2种检测结果进行统计学分析,但从检测结果可以看出HRM-Real time PCR法的优势。另外,在使用国标方法检测时,个别样本非目标菌的含量较多,过滤后的滤膜在培养24 h后,非目标菌蔓延严重,无法分离出单个菌株进行鉴定,给目标菌的分离带来困难。这类样本的分离有赖于检测人员的经验和技术,结果的准确性很难保证。本研究目前只能用一对引物区分铜绿假单胞菌和恶臭假单胞菌,对于鉴别荧光假单胞菌还需要进一步的研究。
总之,HRM-Real time PCR法所花费的时间和实验过程的繁琐程度远低于国标方法,而且结果准确可靠,说明本研究建立的利用HRM-Real time PCR技术检测2种假单胞菌的方法快速高效,成本低,适用于包装饮用水和矿泉水的日常监测和监管。
利益冲突:无
