牡丹秋季开花过程中生理生化变化及DNA甲基化差异*
2021-07-16刘少丹
袁 雪 袁 涛 刘少丹
(1.北京林业大学园林学院 国家花卉工程技术研究中心 城乡生态环境北京实验室 林木花卉遗传育种教育部重点实验室 花卉种质创新与分子育种北京市重点实验室 北京 100083; 2.洛阳国际牡丹园 洛阳 471011)
牡丹(PaeoniaSect.Moutan)是芍药科(Paeoniaceae)芍药属(Paeonia)牡丹组(Sect.Moutan)植物的统称,原产中国,观赏价值高。绝大多数牡丹品种每年仅春季开花一次,单株花期约7~10天。花期短而集中是牡丹的园林应用中亟待解决的问题之一。原产温带的木本植物有一年多次开花现象,如常春二乔玉兰(Magnoliasoulangeana‘Changchun’)(蒋政等, 2019)、紫薇(Lagerstroemiaindica)(孙晓萍等, 2016)、海棠‘雪球’(Malus‘Snowdrift’)(刘嘉仪, 2017)等。许多牡丹品种有秋发现象,部分品种春秋两季都可开花(陈新露, 2000),培育一年多次开花品种是解决牡丹花期短而集中的方向之一。
赤霉素(GA)能够全部或部分代替低温打破植物芽体休眠(Chandleretal., 1994; Pharisetal., 1985)。赤霉素的种类较多,其中GA3在实际生产中被广泛使用,尤其是在牡丹冬季温室催花中广泛应用。试验证明,GA3具有有效促进芽体休眠解除,提早开花、促进枝叶生长,提高催花成花率、增大花径等作用(张秀新, 2004; 任小林等, 2004; 张文娟, 2005; 迟东明等, 2007)。一年多次开花牡丹当年分化的花芽能不经冬季低温自然萌动并二次开花; GA3处理也被证明能够促进牡丹秋季开花(王荣, 2007; 全璨璨, 2009)。
真核生物中DNA甲基化(DNA methylation)对基因表达有重要的调控作用。植物DNA甲基化模式的改变可以影响植物的花期、育性、花叶形态发育等重要生命活动。Finnegan等(1998)认为,DNA去甲基化可促进提早开花,且这一作用与DNA甲基化水平的降低成正比,低温和去甲基化促进开花的作用是加性的。李波等(2015)和王子成等(2009)的研究也有类似结果: 降低DNA甲基化水平可促进植物芽体休眠的解除、提前萌发和开花; 张涛等(2018)还发现,诱导牡丹DNA甲基转移酶基因PsDRM表达水平下降和DNA去甲基化酶基因PsROS1表达水平增加以降低DNA甲基化水平,可能是外施GA3促进牡丹芽休眠解除的作用方式之一。
本文以洛阳地区稳定的一年二次开花牡丹品种‘户川寒’(Paeoniasuffruticosa‘Togawakan’)为研究对象,对春季正常开花后的植株在秋季(9月中旬)进行脱叶及赤霉素(GA3)、赤霉素抑制剂多效唑(PP333)处理,观察处理后植株形态变化、测定花芽萌动过程中激素及糖分含量变化、分析基因组DNA甲基化敏感扩增多态性(methylation sensitive amplified polymorphism,MSAP),以探究牡丹秋季开花过程中赤霉素和DNA甲基化的作用。
1 材料与方法
1.1 试验材料
在河南洛阳以露地栽培、无病虫害、开花正常、长势优良的40株10年以上生‘户川寒’为试验材料。‘户川寒’为日本品种,在洛阳于4月、11月二次开花,花单瓣型,深红色,雌雄蕊正常(图1)。
1.2 田间处理
2019年9月将同年度4月自然开花后常规养护的试验材料进行分组及处理,每组10株,处理及采样时间见表1。

表1 试验处理及采样时间①Tab.1 The schedule of experimental treatment and sampling
1)对照: 无脱叶、无药剂处理。
2)处理A: 2019年9月16日,全株脱叶(人工摘除全部叶柄及叶片)。
3)处理B: 2019年9月16日,全株脱叶; 9月19日开始,连续3天(9月21日为止)每天用650 mg·L-1GA3(分析纯,源叶生物科技有限公司,上海)水溶液浸湿的脱脂棉包裹全株所有芽处理1次。
4)处理C: 2019年9月16日,全株脱叶; 9月19日开始,连续3天(9月21日为止)每天用500 mg·L-1PP333(分析纯,北京华越洋生物科技有限公司,北京)水溶液浸湿的脱脂棉包裹全株所有芽处理1次。
1.3 试验期间气温
如图2, 2019年洛阳从6月初至9月中旬,除3次短时间大幅度的气温变化外,最高气温稳定在30 ℃左右,最低气温20 ℃以上; 9月中旬后最高气温逐渐降至30 ℃以下,最低气温降至15 ℃左右,并保持下降趋势,9月下旬至10月上旬最高气温下降至20 ℃左右,最低气温降至10 ℃左右; 10月中旬出现最高气温小低谷(16 ℃),之后气温短暂回升后持续下降,至12月2日,最低气温降至0 ℃以下(https:∥weather.com/zh-CN/weather/today)。
图2 试验期间日最高气温与最低气温Fig. 2 The daily maximum and minimum temperatures during the experiment
1.4 激素含量测定
2019年9月至10月,分别按表1采样日期于9:00—11: 00,在各试验组随机选取枝条上部3枚长势健壮的芽(去除芽鳞后储存)或3个萌动后新生花蕾及叶片,标记后-80 ℃保存。酶联免疫吸附分析法(enzyme-linked immunosorbent assays,ELISA)测定激素(GA3、GA4、ABA、IAA)含量,每样本设定3个生物学重复。具体操作参照Zhao等(2006),略有改动。
1.5 可溶性糖和淀粉含量测定
与激素含量测定样品采集方式、时间相同,用蒽酮比色法测定糖类指标(可溶性糖、淀粉),方法参照李合生(2000),略有改动。
1.6 DNA甲基化敏感多态性分析
1)接头和引物准备 MSAP分析采用的接头序列、预扩增引物见表2,选择性扩增引物组合见表3。接头和引物均由Thermo scientific(上海)公司合成。试验所用KAPA Taq HotStart扩增试剂购自TaKaRa(大连)公司, T4 DNA连接酶购自New England Biolabs(北京)公司、限制性内切酶购自Thermo Fisher Scientific(上海)公司。

表2 MSAP接头序列和预扩增引物序列Tab.2 MSAP adapters sequences and pre-amplification primer sequences

表3 MSAP选择性扩增引物序列Tab.3 MSAP selective amplification primer sequences
2)酶切连接 取2 μL 10× T4 Buffer,1 μL E接头,1 μL M接头,0.41 μLEcoRⅠ,0.3 μLMseⅠ,0.3 μL T4 DNA连接酶,4样品DNA,加ddH2O补齐至15 μL,在37 ℃下酶切12 h,产物-20 ℃保存备用。
3)预扩增 PCR反应体系20 μL,包括2 μL 10×BufferⅠ,0.8 μLEcoRⅠ预扩增引物(10 mmol·L-1),0.8 μLHpaⅡ/MspⅠ预扩增引物(10 mmol·L-1),1.8 μL dNTP(10 mmol·L-1),0.2 μL Hs Taq酶(5 U·μL-1),2 μL酶切连接产物,12.4 μL ddH2O; PCR反应程序设定为95 ℃ 5 min; 95 ℃ 30 s,56 ℃ 30 s,72 ℃ 2 min,30个循环; 72 ℃ 5 min; 产物15 ℃保存。
4)选择性扩增 反应体系20 μL,包括2 μL 10×Buffer I,0.8 μLEcoRⅠ选择性扩增引物(10 mmol·L-1),0.8 μLHpaⅡ/MspⅠ选择性扩增引物(10 mmol·L-1),1.8 μL dNTP(10 mmol·L-1),0.2 μL Hs Taq酶(5 U·μL-1),2 μL酶预扩增产物,12.4 μL ddH2O; PCR反应程序设定为95 ℃ 5 min; 95 ℃ 30 s,56 ℃ 30 s,72 ℃ 2 min,30个循环; 72 ℃ 5 min; 产物15 ℃保存。
5)3730XL测序仪(ABI公司,美国)检测 96孔板中每孔加入ROX-1200分子量内标(北京阅微基因技术有限公司,北京)和甲酰胺混合液(体积比0.5∶8.5)9 μL,PCR产物1.0 μL。95 ℃变性3 min,上机检测。
6)将检测得到的原始数据文件导入到Genemapper4.0中分析。导出结果后Excel制表。
分别用EcoRⅠ/HpaⅡ、EcoRⅠ/MspⅠ组合对样品基因组DNA酶切后,得到的样品DNA甲基化状态可分为4种模式:
模式Ⅰ(无甲基化: DNA双链上的CCGG位点未发生甲基化),EcoRⅠ+HpaⅡ 和EcoRⅠ+MspⅠ酶切都有带,记为1,1(1表示有带,0表示无带);
模式Ⅱ(半甲基化: DNA双链中仅一条单链上CCGG位点甲基化),EcoRⅠ+HpaⅡ酶切有带,而EcoRⅠ+MspⅠ酶切无带,记为1,0;
模式Ⅲ(全甲基化: DNA双链上的CCGG序列中内侧CG位点处于全甲基化状态),EcoRⅠ+HpaⅡ酶切无带,而EcoRⅠ+MspⅠ酶切有带,记为0,1;
模式Ⅳ(全甲基化: DNA双链上CCGG位点外部胞嘧啶甲基化或DNA双链内外胞嘧啶都甲基化),EcoRⅠ+HpaⅡ 和EcoRⅠ+MspⅠ酶切都无带,记为0,0。
模式Ⅰ、Ⅱ和Ⅲ DNA 甲基化状态根据单个DNA样品电泳结果即可检测,而检测模式Ⅳ甲基化状态则需比较2个或多个DNA 样品甲基化差异。
2 结果与分析
2.1 芽萌动率及形态变化
牡丹‘户川寒’能够稳定于一年春秋二次正常开花,但秋季芽萌动极不整齐且花期晚(11月上旬),同株上不同萌动和发育期的芽并存(图3),萌动晚的花芽形成花蕾后若遭遇低温,即使花器官已分化完全也不能开放。

图3 同一时间同株牡丹‘户川寒’花芽的不同发育状态Fig. 3 Different developmental states of P. suffruticosa ‘Togawakan’ flower buds on the same plants at the same time对照组同株花芽发育不整齐。0-3号为休眠芽, 2020年春季开花; 4-9号花芽已萌动, 2019年11月陆续开花。2019年11月5日摄于洛阳国际牡丹园。In the control group, flower buds in different developmental states appeared in one plant. No. 0-3 were dormant buds, which flowered in spring in 2020. The buds of No. 4-9 have begun to burst and flower successively in November 2019. All figures were taken on Nov. 5, 2019 in the Luoyang International Peony Garden.
牡丹‘户川寒’4个试验组都有芽萌动、开花(图4),花型正常,胚珠、花药外观正常。对照组萌动慢,10月18日自然萌动(自然落叶后),11月27日陆续进入花期。处理B萌动最快且开花最早,11天(9月27日)萌动率达81.4%,17天(10月3日)已100%萌动,并于42天(10月28日)进入初花期。处理A开花时间及最终萌动率与处理C相似,但在早期萌动更快(图4、图5)。
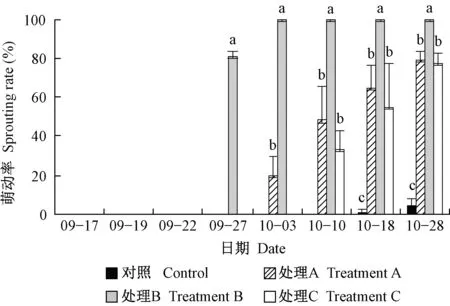
图4 不同处理芽的萌动率Fig. 4 Sprouting rate of different treatments误差线表示标准差(n=3),同一时期不同字母表示在P<0.05水平差异显著(单因素ANOVA检验)。下同。Error bars indicate SD(n=3), and the different letters for each day indicate significant differences at P<0.05(one-way ANOVA with post-hoc Duncan’s test). The same below.

图5 不同处理对芽萌动的影响Fig. 5 The effect of different treatments on sprouting图中叶柄示意留存叶片,9月16日对处理A、B、C全株脱叶(当日照片摄于脱叶前)。9月16日后仅对照尚留叶片,10月10日后植株自然落叶,不再有叶片。处理B 9月27日开始萌动,处理A 10月3日开始萌动,处理C 10月10日开始萌动,对照11月7日才开始萌动。各组萌动后逐渐成花。The petiole in the figure shows the retained leaves. On September 16, treatment A, B and C were defoliated for the whole plant (the photos were taken before defoliation on the same day). Therefore, after September 16, leaves were left only in the control; after October 10, the plant naturally defoliated, no more leaves were left. Treatment B burst from September 27, treatment A burst from October 3, treatment C burst from October 10, and the control did not burst until November 7. Flowers gradually developed after bursting in each group.
2.2 芽(或花)的发育情况
与芽萌动相呼应,处理B萌动最快且萌动率最高,芽(芽萌动后为花蕾)直径和长度最早出现大幅度增加,17天(10月3日)起直径和长度都明显大于其他组,到42天(10月28日)初花期时,花蕾平均直径为(1.9±0.1)cm,花枝平均长度为(22.7±1.8)cm。处理A萌动早于处理C,芽(花蕾)直径方面,处理C在21天(10月10日)后显著大于处理A(图6A); 而芽(花蕾)长度方面,处理A与处理C差异始终不显著(图6B)。

图6 不同处理对芽(花蕾)发育的影响Fig. 6 The effect of different treatments on the bud growth
2.3 芽体内激素含量变化
如图7所示,牡丹‘户川寒’4个试验组GA3、GA4含量变化趋势相似。脱叶(9月16日)使得芽体内GA3、GA4含量在短时间内降低,但在11天(9月27日)骤升并于17天(10月3日)时达到最大值后迅速降低(处理A)。外施GA3(9月21日处理结束)使芽体内由于脱叶造成的低水平GA3、GA4含量逐渐升高,至24天(10月3日)时达到最大值(处理B)。说明脱叶后的短时间内,芽体内GA3、GA4含量降低,但之后迅速增加,脱叶后施加GA3能加大芽体内GA3、GA4增长强度并延长增长时间。施加PP333也使脱叶造成的低水平GA3、GA4含量升高,但升幅远小于施加GA3的处理; 在处理一段时间后2种激素含量都有不同程度降低(低于仅脱叶的处理A)。说明脱叶后施加PP333能在短时间内使芽体内GA3、GA4含量增加,但随后可能会抑制GA合成。

图7 不同处理对芽体内激素水平的影响Fig. 7 The effect of different treatments on the phytohormone contents in buds
脱叶(处理A)使牡丹‘户川寒’ABA含量相较对照明显下降,但在后期(10月18日起)含量上升超过对照。外施GA3在短时间内使芽体内ABA含量降低更剧烈,并维持低水平状态直至24天(10月10日)。施加PP333会使ABA含量出现骤升后下降。
对照组在3天(9月19日)时,IAA含量升高,6天(9月22日)时含量降低且一直维持低水平; 处理A使IAA含量下降,除3天时有大幅上升外,始终保持在较低水平直至42天(10月28日); 施加GA3(处理B)延缓了IAA含量的持续降低,但后期IAA含量仍上升; 施加PP333(处理C)使IAA含量增加并始终高于对照和处理A。
2.4 芽体内淀粉和可溶性糖含量变化
由图8可知,对照组试验过程中可溶性糖含量增加而淀粉含量减少。3个处理组可溶性糖含量变化趋势在试验前期大致相同,都在11天(9月27日)达到含量的小高峰,而后迅速降低,在17天(10月3日)达到小低谷,其后处理A、处理B含量先上升后下降,而处理C则一直保持下降趋势。在试验前期3个处理组淀粉含量变化趋势大致相同,11天之前各组含量都相对稳定,仅有小幅升高或降低,17天时大幅降低分别达到各组最小值,之后处理A、C淀粉含量先上升后下降,而处理B含量上升后基本保持稳定; 到42天(10月28日),3个处理组淀粉含量相对1天(9月17日)时都有不同程度降低。

图8 不同处理对芽体内可溶性糖和淀粉含量的影响Fig. 8 The effect of different treatments on the contents of soluble sugar and starch in buds
2.5 DNA甲基化敏感多态性分析
2.5.1 GA3对开花过程中甲基化水平的影响 试验共选用3个EcoRⅠ和6个HpaⅡ/MspⅠ 选择性扩增引物构成的10个引物组合(表3),对牡丹‘户川寒’秋季试验样品利用MSAP检测分析其DNA甲基化状态。
结果如表4所示。不同时期不同处理均检测到2 330个CCGG位点,平均每个引物组合检测到的甲基化位点数为233个。总体来看,脱叶后(1天)处理组DNA半甲基化水平相较对照明显升高,之后逐渐降低; 而处理组与对照组完全甲基化水平呈现与其半甲基化水平相反的变化趋势,使得处理组总甲基化水平与对照组相差较小。施加GA3(6天)后,处理B相对处理A半甲基化水平降低,但仍高于对照,而完全甲基化水平升高,但低于对照; 施加PP333(6天)后,处理C与处理A半甲基化、完全甲基化水平都基本保持同步变化,二者差异较小; 4组总体甲基化水平相近。处理B萌动率达50%以上时(11天),其半甲基化率达到最小值(9.4%),但仍高于对照且低于其他2个处理组; 其完全甲基化率和总甲基化率均达到最大值(61.8%、71.2%),且高于其他3组。处理C萌动率达50%以上时(32天),其半甲基化率(11.5%)低于其他3组而完全甲基化率(46.9%)和总甲基化率(66.7%)均高于其他3组。
2.5.2 GA3对秋季开花过程中甲基化模式的影响 10对引物在各处理不同时期的样本中共扩增产生4种模式,进一步可分为16个亚类。表5至表8分别为对照不同时期及处理A、处理B、处理C相对对照1天时各时期的甲基化模式变化统计。表中模式A为甲基化状态未发生变化的位点,包括4个亚类; 模式B为与对照1天相比甲基化水平下降的位点,即这些位点发生了去甲基化(demethylation),包括5个亚类; 模式C为与对照1天相比甲基化水平上升的位点,即这些位点发生了超甲基化(hypermethylation),包括5个亚类; 模式D是与对照1天相比甲基化水平变化无法确定的位点,即不定型,包括2个亚类。
对比表5与表6、表7、表8,对照组各时期模式A位点比例较高(61.8%~70.4%),而处理组模式A位点比例仅3天时为63.3%,其余各时期不足60%; 另一方面,对照组和处理组甲基化状态为不定型(即模式D)的位点比例较低(对照仅1.2%~1.5%,处理组为1.5%~2.4%); 说明处理组甲基化比对照组甲基化变化更活跃,集中在去甲基化(模式B)和超甲基化(模式C)。
试验开始后,牡丹‘户川寒’对照DNA去甲基化位点数逐渐升高,3、6、11、17、24、32、42天发生去甲基化的位点数分别为275、342、317、348、335、373、410,分别占总位点数的11.8%、14.7%、13.6%、14.9%、14.4%、16.0%、17.6%; 发生超甲基化的位点数先升高,17天以后降低,17、24、32、42天发生去甲基化的位点数分别为508、473、439和435,分别占总位点数的21.8%、20.3%、18.8%和18.7%(表5)。
处理A在0天脱叶,1天后去甲基化位点数开始增加,1、3、6、11、17、24、32、42天发生去甲基化的位点数分别为527、454、440、471、468、489、451和626,分别占总位点数的22.6%、19.5%、18.9%、20.2%、20.1%、21.0%、19.4%和26.9%,均高于对照相应时期去甲基化的位点数; 发生超甲基化的位点数先升高,17天以后降低,17、24、32、42天发生去甲基化的位点数分别为608、541、538和468,分别占总位点数的26.1%、23.2%、23.1%和20.1%(表6)。
处理B 0天脱叶,5天外施GA3处理,处理后去甲基化位点数总体曲折上升,6、11、17、24、32、42天发生去甲基化的位点数分别为485、439、467、433、485和501,分别占总位点数的20.8%、18.8%、20.0%、18.6%、20.8%和21.5%,均高于对照相应时期发生去甲基化的位点数(表7)。
处理C在0天脱叶,5天外施PP333处理,处理后去甲基化位点数除11天时骤升至605外,其余时期总体保持缓慢增加趋势,6、11、17、24、32、42天发生去甲基化的位点数分别为481、605、445、476、534和428,分别占总位点数的20.6%、26.0%、19.1%、20.4%、22.9%和18.4%,均高于对照相应时期发生去甲基化的位点数(表8)。
3 讨论
研究表明,牡丹二次开花与GA关系密切。周华(2015)分析转录组数据,认为GA途径与光周期途径、春化途径共同参与诱导牡丹‘海黄’秋季二次开花。PP333是园艺作物常用的GA合成抑制剂,有控制营养生长(潘瑞炽, 2012)、影响植物的光合作用、呼吸作用、矿质营养代谢、碳水化合物的代谢与分配、延缓植物衰老等生理效应(宋海凤等, 2015; 吕双庆等, 2005)。
3.1 脱叶、激素与秋季开花
GA3能有效解除牡丹芽体休眠,提早开花、促进枝叶生长,提高成花率和切花品质、增大花径、促进牡丹二次开花等(任小林等, 2004; 张秀新, 2004; 张文娟, 2005; 迟东明等, 2007); GA4能促进植物芽体休眠解除(Rinneetal., 2011; 温璐华等, 2015),ABA能抑制开花,较高浓度的IAA能够促进开花,内源激素对芽体休眠的影响是以激素平衡为标准的(陈新露, 2000; 张秀新, 2004)。因此,本研究对不同处理GA3、GA4、ABA及IAA含量进行了测定与分析。
牡丹‘户川寒’能够稳定于一年春秋二次正常开花,但秋季芽萌动极不整齐且花期晚(11月上旬),同株上不同萌动和发育期的芽并存(图3),萌动晚的花芽形成花蕾后若遭遇低温,即使花器官已分化完全也不能开放; 本试验不仅促进了花芽萌动且提高了萌动整齐度(图4)。仅脱叶、脱叶后施GA3、脱叶后施PP333都促进了‘户川寒’秋季较快较整齐地萌芽和生长,各处理组开花进程依次为: 脱叶后施加GA3组>脱叶组>脱叶后施加PP333组。说明秋季脱叶促进了芽萌动和生长,施加GA3则叠加促进效应,PP333会部分抵消脱叶的促进效应。脱叶发挥了短时间对GA3、GA4含量的抑制作用后,芽内GA3、GA4的含量升高而ABA含量下降,施加GA3后加强了GA3、GA4含量升高和ABA含量下降的强度,且延长了GA3、GA4含量上升期,而施加PP333表现出相反的作用; 此外,试验后期对照组开花时GA3、GA4含量升高而ABA下降。Xue等(2018)认为外施GA3能使植株通过外源吸收和自身内源合成的方式积累GA3,从而抑制ABA功能,使牡丹品种‘紫罗兰’二次开花。本试验结果也支持这一论断。
3.2 可溶性糖、淀粉与秋季开花
可溶性糖与淀粉都属于非结构性碳水化合物(non-structural carbohydrate, NSC),是植物生长过程中重要的能量供应物质和植物参与碳吸收与消耗的重要指标(Lietal., 2002; Raessleretal., 2010)。一方面,外施赤霉素和脱叶使NSC重新分配诱导牡丹开花(Xueetal., 2019),另一方面,多效唑在牡丹及其他植物中也被证明能够使NSC含量增加(黄睿, 2007; 张华等, 2018)。在一些植物中,淀粉转化为可溶性糖被认为是开花的影响因素之一(郑国生等, 2009; 高志民, 2007; 曲波等, 2010)。在本试验中,芽萌动前各试验组可溶性糖含量明显上升,而萌动后一段时间内淀粉和可溶性糖大量消耗,说明芽萌动前需高浓度可溶性糖以满足萌芽时的消耗。
3.3 DNA甲基化与秋季开花
DNA甲基化水平的改变在植物生长发育过程中起着调控重要功能基因表达、基因组防御以及细胞发育与分化等方面的重要作用。一般认为,过度甲基化会阻碍转录因子复合体与DNA结合从而抑制基因的表达,而去甲基化则有利于基因表达(Richards, 1997; Lukensetal., 2007)。因此,研究不同处理下牡丹秋季萌动开花过程中DNA甲基化的状态变化,有助于从基因层面揭示牡丹秋季萌动开花与不同处理间的联系。本研究中,试验开始时牡丹‘户川寒’都还处于生长期(未落叶),处理组于9月16日(0 d)时进行人工脱叶,对照组10月中旬自然落叶,之后自然萌动(图5),即几乎不经历休眠期,‘户川寒’在落叶后新芽萌动生长。MSAP检测结果显示,在整个试验期间‘户川寒’DNA总甲基化的变化范围为57.3%~72.4%,开始萌动前达到DNA甲基化的最高水平,之后逐渐下降。这与盖树鹏等(2012)研究低温解除牡丹品种‘鲁荷红’(P.suffruticosa‘Luhehong’)休眠过程中的发现相似: 在低温18天时(内休眠解除)DNA甲基化水平升至最高,之后下降。说明内休眠解除时植株体内的分子调控发生了重大变化,推测DNA甲基化可能是参与调控牡丹芽体萌动的关键因素。
前人研究认为低温促进植物成花可能是通过调控DNA去甲基化实现的(Or, 2009; Lízaletal., 2001; 盖树鹏等, 2012); 蓝莓(Vacciniumcorymbosum)芽休眠解除和萌发可能也与基因组去甲基化使得基因组甲基化水平降低有关(李波等, 2015)。由于本试验涉及处理和时期较多,故仅以对照1天时的甲基化状态为基准,比较牡丹‘户川寒’各处理不同时期甲基化状态。结果发现,处理组甲基化状态变化更活跃,集中在去甲基化(模式B)和超甲基化(模式C)。各处理组去甲基化率随时间推移增加,且都高于对照组同一时期的去甲基化率。处理组芽萌动和发育快,萌动率和开花整齐度高,说明牡丹‘户川寒’萌动开花可能受DNA去甲基化调控。
4 结论
牡丹‘户川寒’能够在秋季自然萌动开花,脱叶能促进内源GA3合成,结合外施GA3的叠加效应,体内GA3增加并抑制ABA,促进其秋季提前萌动二次开花,且花期整齐,外施PP333一定程度抵消了脱叶引起的内源GA3的合成促进作用。芽从萌动到开花伴随着大量糖类物质消耗,高浓度的可溶性糖含量可能有利于芽的萌动。牡丹‘户川寒’可自我调控相关DNA序列 CG 位点的甲基化状态,从而诱导其花芽在秋季萌动,施加处理可能会提前触发这一调控过程,其中DNA去甲基化率高更可能促进秋季萌动、开花。
