黄芪根腐病菌分离鉴定及细胞壁降解酶活性比较
2021-07-16沈煜铠李昭煜李佳佳
沈煜铠,李昭煜,李佳佳,田 天*
(1. 西安交通大学 励志书院,西安 710049;2. 兰州交通大学 甘肃省植物源生物农药工程技术研究中心,兰州 730070)
黄芪是多年生草本植物,其根入药,具有较高药用价值,现主要依赖人工种植.甘肃省渭源县是甘肃黄芪的主产区之一,近年随着轮作周期缩短以及连作面积增加使黄芪根腐病逐年加重[1-2],渭源县在多雨潮湿季节部分阴湿地区黄芪的发病率可达40%~60%[3].黄芪感病后轻者根部表皮粗糙,重者呈褐色腐朽状,严重影响黄芪的品质和产量.
镰刀菌是一种重要的植物病原真菌,可引起根腐病等多种植物病害.镰刀菌形态复杂,易受外界环境影响而发生变异,单凭形态学特征鉴定,常使鉴定结果不够准确,从而影响后续研究工作[4].目前随着分子生物学技术的不断发展,一些基因位点如核糖体内转录间隔区(rDNA-ITS)、组蛋白( Histone 3)、β-微管蛋白(β-tubulin)、线粒体小亚基核糖体(mtSSU)、及翻译延伸因子(EF-1α)等越来越多被用于镰刀菌属及种间的鉴定,弥补了形态学鉴定中的不足,其中rDNA-ITS和EF-1α基因应用最多[5],如李金花等[6]在对甘肃省马铃薯镰刀菌干腐病优势病原进行分子鉴定时就利用了EF-1α基因;高芬等[7]通过EF-1α基因序列对山西省蒙古黄芪根腐病优势致病菌群进行了分析;王喜刚等[8]在对宁夏回族自治区马铃薯镰刀菌根腐病病原菌进行鉴定时除了利用ITS基因序列还利用了EF-1α基因序列.
黄芪根腐病的主要致病菌是镰刀菌属真菌,骆得功等[9]调查了甘肃省定西市46 个点的大田和实验基地的黄芪根腐病并对采集的病样进行病原菌分离,通过形态学鉴定其主要致病菌是尖孢镰刀菌(Fusariumoxysporum)和茄腐镰刀菌(Fusariumsolani);陈垣等[10]对甘肃渭源的黄芪根腐病菌分离鉴定结果表明尖孢镰刀菌和茄腐镰刀菌为主要致病菌,且前者致病力更强;赵庆芳等[11]的报道中的黄芪根腐病的病原菌为从陇西大田黄芪病株上分离纯化所得茄腐镰刀菌和尖镰刀菌;牛世全等[12]对采集自甘肃省陇西县的黄芪种植栽培地的根腐病株进行病原菌分离,形态学鉴定结合rDNA-ITS序列分析得出优势致病菌为茄腐镰刀菌和尖孢镰刀菌.
细胞壁降解酶(cell wall degrading enzyme,CWDE)主要包括果胶酶、纤维素酶、半纤维素酶、蛋白酶、淀粉酶和磷脂酶等[13],能够降解寄主植物的细胞壁从而有利于病原菌的侵入、定殖和扩展,其中果胶酶、纤维素酶在病原菌致病过程中具有重要作用.镰刀菌也能够分泌多种细胞壁降解酶,且在侵染寄主植物的过程中不同镰刀菌所分泌的酶的种类及活性均有区别,胡长志等[14]对莲腐败病菌(Fusariumoxyporumf.sp.nelumbicola)的5种细胞壁降解酶的酶活性进行测定,结果表明莲腐败病病菌在致病过程中起主要作用的细胞壁降解酶为多聚半乳糖醛酸酶和纤维素酶;董章勇等[15]对茄科作物致病尖孢镰刀菌番茄专化型(Fusariumoxysporumf.sp.lycopersici,FOL)、辣椒专化型(F.oxysporumf.sp.capsicum,FOC)和茄子专化型(F.oxysproumf.sp.melongenae,FOM)3种镰刀菌的5种细胞壁降解酶活性进行比较,结果表明病原菌侵染的茄子和番茄体内酶活性从高到低依次为 PG、PMG、PGTE、Cx和 PMTE,发病辣椒体内酶活性从高到低依次为 PG、PGTE、PMG、PMTE和Cx;岳换弟等[16]对山西黄芪根腐病的的优势病原菌锐顶镰刀菌(Fusariumacuminatum)、尖孢镰刀菌和茄腐镰刀菌产生得多聚半乳糖醛酸酶等6种CWDEs的酶活性进行了比较,结果表明3种病原菌产生各种酶的活性大小和变化趋势具有明显差异,并得出病原菌产酶活性的大小在一定程度上能够表明其致病力的大小的结论.
本文从甘肃渭源县采集黄芪根腐病样,对分离得到的病原菌除了形态学鉴定还利用rDNA-ITS和EF-1α基因序列分析进行分子生物学鉴定,并对6株病原菌的致病力、生长速率及产孢量进行测定,最后比较了6株病原菌产内切1,4-β-D葡聚糖酶(Cx)、β-葡萄糖苷酶(βG)多聚半乳糖醛酸酶(PG)、聚甲基半乳糖醛酸酶(PMG)、多聚半乳糖醛酸反式消除酶 (PGTE)、果胶甲基反式消除酶(PMTE)及果胶甲基脂酶(PME)的活性,从产细胞壁降解酶的种类及酶活力的差异的角度对其致病力差异进行分析,以期明确目前甘肃渭源地区黄芪根腐病病原菌种类及致病力分化情况,后续对强致病力菌株进行防治试验研究.
1 材料与方法
1.1 材料
供试病原菌:分离自甘肃渭源半阴坡村具典型黄芪根腐病状的病株.
供试黄芪品种:蒙古黄芪.
试剂及仪器:DNA分子量标准 Marker(100~2 000 bp) ,生工生物工程(上海)股份有限公司;Taq PCR Mix预混液(2X,含蓝染料),生工生物工程(上海)股份有限公司;光学显微镜,宁波永新光学股份有限公司;智能型生化培养箱,上海琅玕实验设备有限公司;PCR仪,美国Bio-Rad公司.
1.2 方法
1.2.1 病原菌的分离鉴定
病原菌的分离采用组织分离法,并通过单孢纯化得到纯培养.根据柯赫氏法则对病原菌的致病性进行验证:将活化好的菌株制成8 mm的菌饼置于75%乙醇消毒且针刺处理的黄芪根段上,于25 ℃培养箱中保湿培养,待发病后,将发病部位再次分离培养,确定再次分离到的菌株与所接种的菌株为同株.具致病性的病原菌株于4 ℃保存.
将病原菌株接种于PDA培养基上,在25 ℃培养箱中培养7 d后观察菌落的形态特征,并挑取少量菌丝置于光学显微镜下观察病菌的菌丝和分生孢子的形态特征,初步进行形态鉴定.将分离得到的病原菌株活化培养,于菌落边缘挑取适量菌丝体进行PCR,用rDNA-ITS和EF-1α两组基因对病原菌进行鉴定.rDNA-ITS基因的引物为ITSl 和ITS4,其序列分别为5′-TCCGTAGGTGAACCTGCGG-3′和5′-TCCTCCGCTTATTGATATGC-3′,EF-1α基因的引物为EF-1和EF-2,其序列分别为5’-ATGGGTAAGGAAGACAAGAC-3′和5′-GGAAGTACCAGTAATCATGTT-3’.PCR反应体系为25 μL,包括有:PCRmix12.5 μL,ddH2O10.5 μL,0.5 μL 5 μmol/L的ITS1/ EF-1和0.5 μL 5 μmol/L ITS4/ EF-2,适量菌丝.以上试剂均购自生工生物工程(上海)股份有限公司.PCR反应条件:预变性94 ℃ 4 min;变性94 ℃ 30 s;退火54 ℃ 45 s ;延伸72 ℃ 60 s;最后延伸72 ℃ 7 min,保持4 ℃.PCR扩增得到的产物送生工生物工程(上海)股份有限公司测序,测序结果提交GenBank数据库进行比对分析,通过软件MEGA6.0使用邻接法(neighbor-joining method)构建系统发育树,以明确系统发育学定位.
1.2.2 致病力测定
选取健康且粗细均匀的两年生蒙古黄芪根部截成6 cm左右的根段,冲洗干净,用75%乙醇进行表面消毒,每根段分别于上、中及下部3处均针刺5个伤口,将活化好的菌株用打孔器制成8 mm的菌饼朝下接种于针刺伤口上,每个菌株接种2个根段,25 ℃保湿培养3 d后取掉菌饼,接着培养至7 d后观察发病情况并用十字交叉法测量病斑直径.
1.2.3 菌丝生长速率测定
将6株病原菌株于25 ℃条件下培养7 d后用打孔器制成8 mm的菌饼,接种于PDA平板上,于25 ℃恒温箱培养,每个菌株3次重复,分别于第3 d、5 d、7 d、9 d用十字交叉法测量菌落直径.
1.2.4 产孢量测定
将6株病原菌株制成8 mm的菌饼接种于PDA培养基上,每处理3次重复,25 ℃恒温培养10 d后用50 mL无菌水少量多次洗下孢子,用血球计数板分别统计大孢子和小孢子的浓度以计算毎皿的产孢量,同时于显微镜下测量大孢子和小孢子的大小.
1.2.5 粗酶液提取
CWDEs的诱导培养,将25 ℃条件下培养7 d的6株病原菌株用打孔器制成8 mm的菌饼并分别接种于100 mL PD培养基中,每瓶接5个菌饼,25 ℃,180 r/min震荡培养6 d,以作为种子液备用.诱导培养基选取改良后的Czaper液体培养基,诱导病原菌产生果胶酶加入诱导物果胶,诱导病原菌产生纤维素酶加入诱导物羟甲基纤维素钠[18].将6株病原菌株的孢子悬浮液分别取1 mL接种于装有100 mL诱导培养基的三角瓶中,每个菌株3次重复,于25 ℃,180 r/min条件下震荡培养.分别在第3、5、7、9、11 d取样,每次取样10 mL,分别用4层纱布滤除样品中的菌丝,并以10 000 r/min在4 ℃条件下离心得粗酶液,4 ℃保存备用.
1.2.6 纤维素酶活力测定
通过DNS法测定纤维素酶CX和βG的活性[16].取2支试管分别标记为1、2号,均加入1 mL 0.05 mol/L的柠檬酸缓冲液(pH 5.0)和1mL 1%的底物溶液(βG的底物是水杨苷,CX的底物是羟甲基纤维素钠),50 ℃水浴5 min,1号管中加入1 mL粗酶液后直接加入2 mL DNS试剂,并立刻置于沸水中5 min以终止反应,2号管中加入1 mL粗酶液,于50 ℃水浴酶解1 h后再加2 mL的DNS试剂,然后在沸水中反应5 min以终止反应,最终在OD540 nm处测定吸光值.
1.2.7 果胶酶活力测定
DNS比色法测定果胶酶PG和PMG的活性[16].取2支试管分别标记为1、2号,均加入1 mL柠檬酸缓冲液(0.05 mol/L,pH 5.0)和1 mL 0.1%底物溶液(PG的底物是多聚半乳糖醛酸,PMG的底物是果胶),50 ℃水浴5 min,1号管中加0.1 mL的粗酶液,然后直接加入2 mL DNS试剂并立刻置于沸水中5 min以终止反应,2号管中加入1 mL粗酶液,于50 ℃水浴酶解1 h后再加入2 ml DNS试剂,然后沸水中反应5 min以终止反应,最终在OD540 nm处测定吸光值.
使用紫外分光光度法测定PMTE和PGTE的活性[16].取1 mL酶液并加入1 mL的0.05 mol/L甘氨酸-氢氧化钠缓冲液(pH 9.0)和1 mL 1%底物(PMTE的底物为果胶,PGTE的底物为多聚半乳糖醛酸),接着加入1 mL CaCl2溶液(3 mmol/L),然后置于30 ℃水浴10 min,最后取在OD232 nm处测定反应前后的吸光值.
1.3 数据统计分析
使用SPSS 13.0软件对试验数据进行统计学分析,使用邓肯氏新复极差法对试验数据进行差异显著性分析.
2 结果分析
2.1 病原菌的分离鉴定结果
本试验共分离得到6株黄芪根腐病原菌,分别编号为GF1、GF2、GF3、GF4、GF5、GF6.在25 ℃条件下PDA平板上培养9 d 菌株GF5未能长满平板,菌株GF1、GF2、GF3、GF4、GF6均能长满平板,6株菌的株菌丝均较稀疏且为白色(见图1(a)).培养15 d的菌落性状有明显区别,菌株GF1与GF5的菌落呈现暗红色,菌株GF1还可见明显的轮纹;菌株GF2 、GF6、GF4、GF3的菌落均呈现不同程度的暗绿色,且颜色依次由浅到深,均明显可见墨绿色的分生孢子堆(见图1(b)).正是由于这6株菌株的菌落特征差异较大,本文就进一步对其致病力进行了比较.
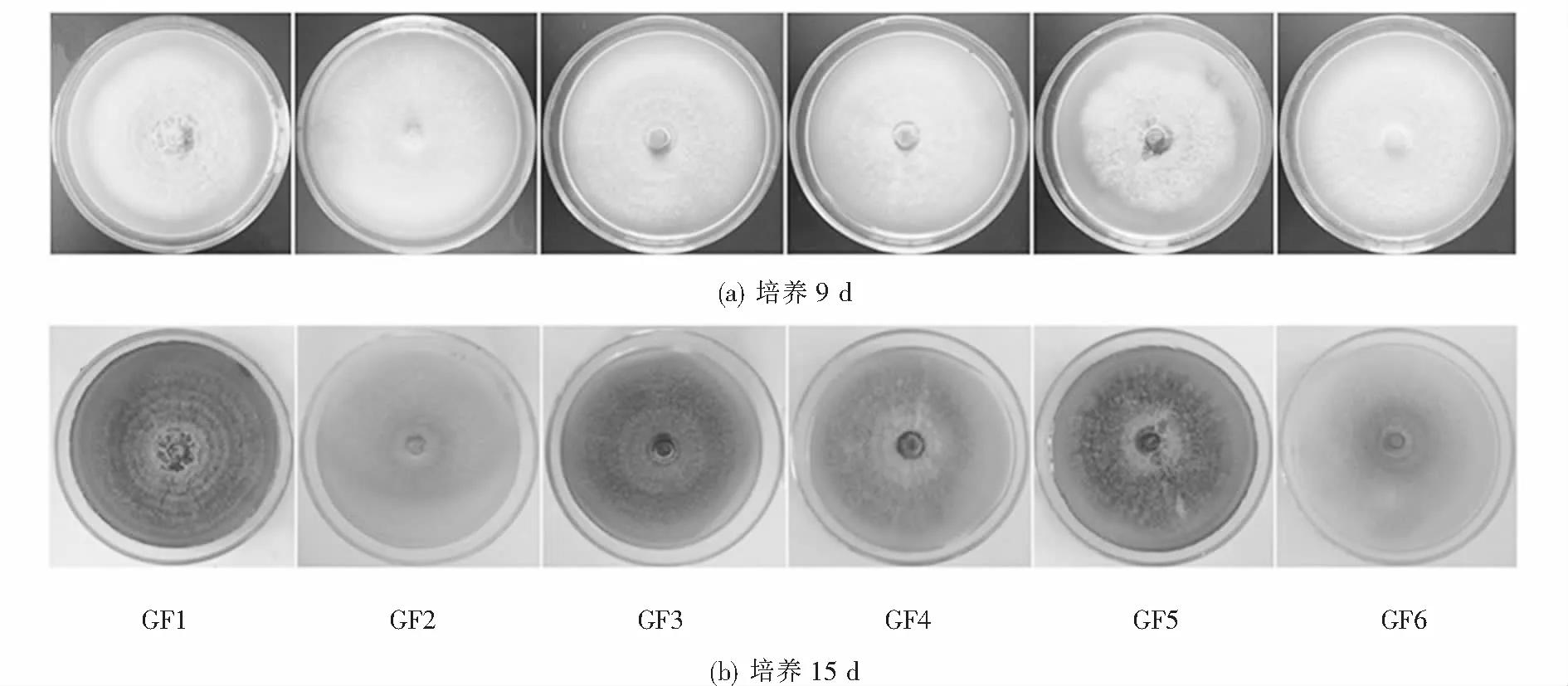
图1 6株黄芪根腐病菌培养9 d和15 d的菌落形态Fig.1 Colony morphology of 6 pathogenic fungi cultured for 9 and 15 days
显微观察结果表明:6个菌株均能产生镰刀状的大型分生孢子和椭圆形的小型分生孢子,大型分生孢子均有2~4个隔,小型分生孢子无隔,从形态特征可以确定6株病原菌均为镰刀菌属真菌(见图2).

图2 菌株GF1、GF2、GF3、GF4 、GF5和GF6的分生孢子Fig.2 Conidia of GF1、GF2、GF3、GF4 、GF5 and GF6 strain
将菌丝扩增后的产物进行琼脂糖凝胶电泳检测,结果表明rDNA-ITS和EF-1α基因序列都在500~750 bp之间,经测序所得菌株GF1、GF2、GF4、GF5、GF6的rDNA-ITS序列碱基长分别为569、569 、565、568、555、566 bp,EF-1α序列碱基长分别为715、711、711、712、698、716 bp.rDNA-ITS基因序列构建的系统发育树表明菌株GF1、GF2、GF4与MF077247(F.solani)、MF077246(F.solani)聚在一起,病原菌GF3、GF5与EU263916.1(F.solani)聚在一起,菌株GF6与MG561938.1(F.solani)聚在统一分支(见图3(a)).EF-1α基因序列构建的系统发育树表明菌株GF1、GF4、GF5与MG857483(F.solani)、MG857376(F.solani)聚于同一分支,菌株GF2、GF3与MH595519(F.solani)聚于同一分支,菌株GF6与MK560265(F.solani)、MK503785(F.solani)聚在一起(见图3(b)).综合两组基因序列分析结果表明6株病原菌均为茄腐镰刀菌(Fusariumsolani).

图3 基于rDNA-ITS和EF-1α序列采用邻接法构建菌株GF1-GF6及相关菌株的系统发育树Fig.3 Phylogenetic tree of strain GF1-GF6 and its related strains constructed by using neighbor-joining method based on rDNA-ITS and EF-1α sequences
2.2 菌丝生长速率测定结果
6株病原菌中菌株 GF3的生长最快,培养9 d后的菌落直径为8.50 cm,长满平板(见图1),菌株GF1、GF2、GF4、GF5及GF6培养9 d的菌落直径分别为6.38、8.2、8.5、8.23、6.5和7.93 cm、(见表1),菌株GF3培养9 d的菌落直径与菌株GF1、GF5、GF6的菌落直径差异显著.

表1 6株黄芪根腐病菌的生长速率Tab.1 Growth rates of 6 strains of astragalus membranaceus root rot
2.3 产孢量测定结果
培养10 d后菌株GF3的总产孢量最大,为7.5×108个/皿,与其他几个菌株的产孢量差异显著,分别是菌株GF1 、GF2、GF4、GF5、GF6产孢量的2.86、1.94、4.29、6.67、3.33倍,同时,菌株GF3小孢子的产量为6.88×108个/皿,大孢子的产量为6.25×108个/皿(见图4).
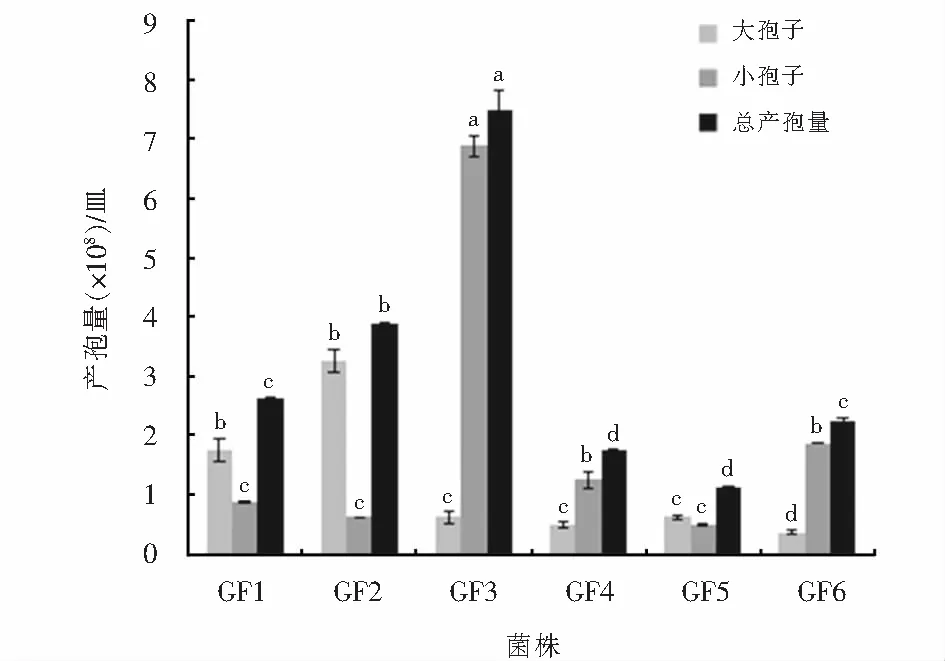
图4 6株黄芪根腐病菌培养10 d的产孢量Fig.4 Spore production of 6 strains cultured for 10 days
表中数据为平均数±标准差,不同小写字母(a、b、c)表示经邓肯氏新复极差法检验在P<0.05水平差异显著.
2.4 致病力测定结果
接种6株病原菌7 d后,黄芪根段表面均出现不同程度的黑色病斑(见图5和图6),切开后根内部组织也不同程度的变褐,其中接种菌株GF3根段的病斑面积最大,且发黑变质的程度也最大,病斑的直径为1.43 cm,其次是菌株GF1,病斑直径为1.11 cm,其他几株病原菌的病斑直径均在1 cm以下,由此可见6株菌株均具致病性,且菌株GF3的致病力最强.

图5 6株黄芪根腐病菌病斑大小Fig.5 Size of the spots of 6 strains of root rot of Astragalus membranaceus var.mongholicus

图6 接种6株黄芪根腐病菌7 d后的病斑大小Fig.6 Size of the spots after inoculation with 6 strains of root rot of Astragalus membranaceus var.mongholicus for 7 days
2.5 纤维素酶测定结果
6株黄芪根腐病原菌产Cx的情况分别见图7.6株菌均能产Cx,只是产酶开始时间、酶活力大小以及变化趋势有所不同.菌株GF2-GF6均在3 d后开始产酶,菌株GF1在9 d后才开始产酶,6株病原菌的Cx活力随着时间均为增加的趋势,其中菌株GF3在第5 d、7 d、9 d以及11 d的酶活力均最大,11 d时的酶活力为2.395 U/mg.

图7 6株黄芪根腐病菌产Cx能力比较Fig.7 Comparison of Cx production capacity of 6 strains of root rot of Astragalus membranaceus var. mongholicus
6株黄芪根腐病原菌产βG的情况分别见图8.菌株GF3产酶时间最早,3 d时已有酶产生,菌株GF4和GF6在3 d后才开始产酶,菌株GF1、GF2和GF5在5 d后才开始产酶.6株病原菌9 d前的酶活力均逐渐增大,菌株GF3和GF4在的酶活在9 d后开始逐渐降低,菌株GF1、GF2、GF5和GF6的酶活性在9 d后几乎没有变化.在整个酶活变化的过程中菌株GF3的酶活性一直是最大的,在第9 d时达到峰值,为1.431 U/mg.
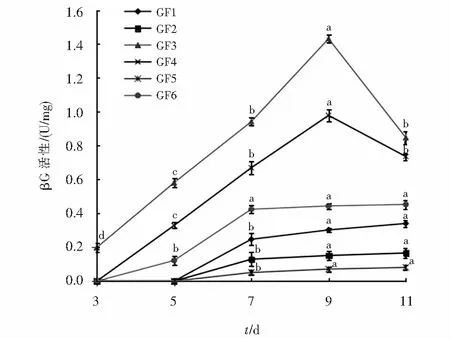
图8 6株黄芪根腐病菌产βG能力比较Fig.8 Comparison of βG production capacity of 6 strains of root rot of Astragalus membranaceus var. mongholicus
2.6 果胶酶测定结果
6株黄芪根腐病原菌产PG酶的情况见图9.6株病原菌在3 d以前均开始产PG酶,其中菌株GF1、GF2、GF3和GF6的酶活力在第3 d达到最高值,分别为506.42 U/mg、540.06 U/mg、620.21 U/mg和568.60 U/mg,菌株GF3的酶活力最高,3 d以后均逐渐降低,第9 d后有上升的趋势,但是第11 d的酶活力均没有第3 d高.菌株GF4和GF5第3 d到第5 d的酶活力逐渐增高,第5 d时达到峰值,分别为313.13 U/mg和222.623 U/mg,5 d到9 d逐渐降低,9 d后有升高的趋势,但是第11 d的酶活力没有3 d时高.
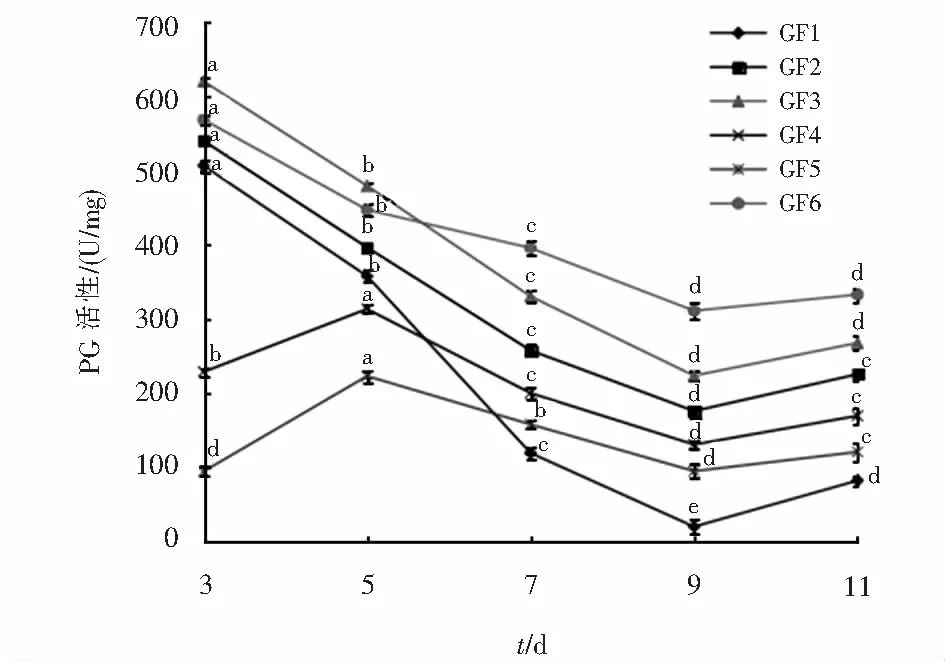
图9 6株黄芪根腐病菌产PG能力比较Fig.9 Comparison of PG production capacity of 6 strains of root rot of Astragalus membranaceus var. mongholicus
6株黄芪根腐病原菌产PMG酶的情况见图10, 6株病原菌的PMG活力均在第3 d时达到峰值,菌株GF1-GF6第3 d的酶活力分别为159.62 U/mg、84.23 U/mg、179.71 U/mg、142.30 U/mg、132.41 U/mg和122.48 U/mg,其中菌株GF3的酶活力最大.在第3 d~7 d时间段6株病原菌的酶活力均逐渐降低.菌株GF3和GF6的酶活力在第7 d~9 d有下降趋势,9 d~11 d又逐渐上升.菌株GF1、GF2、GF4和GF5的酶活力在7 d~9 d呈增高趋势,在第9 d~11 d又逐渐降低.
6种黄芪根腐病菌产PGTE的情况见图11,6株病原菌中除了菌株GF2在第3 d没有产PGTE外,其他5株病原菌均产酶.菌株GF4的酶活力在3 d~11 d为逐渐降低的趋势,但是在整个过程中每个时间点的酶活力均高于其他5株病原菌.菌株GF4、GF5和GF6在第3 d的酶活力最高,分别为61.24 U/mg、24.33 U/mg、30.79 U/mg,以后均有逐渐降低的趋势.菌株GF2和GF3在第3 d~9 d的酶活力逐渐增高,9 d~10 d为降低的趋势.菌株GF1第3 d~5 d的酶活力趋于平稳,5 d后逐渐降低.
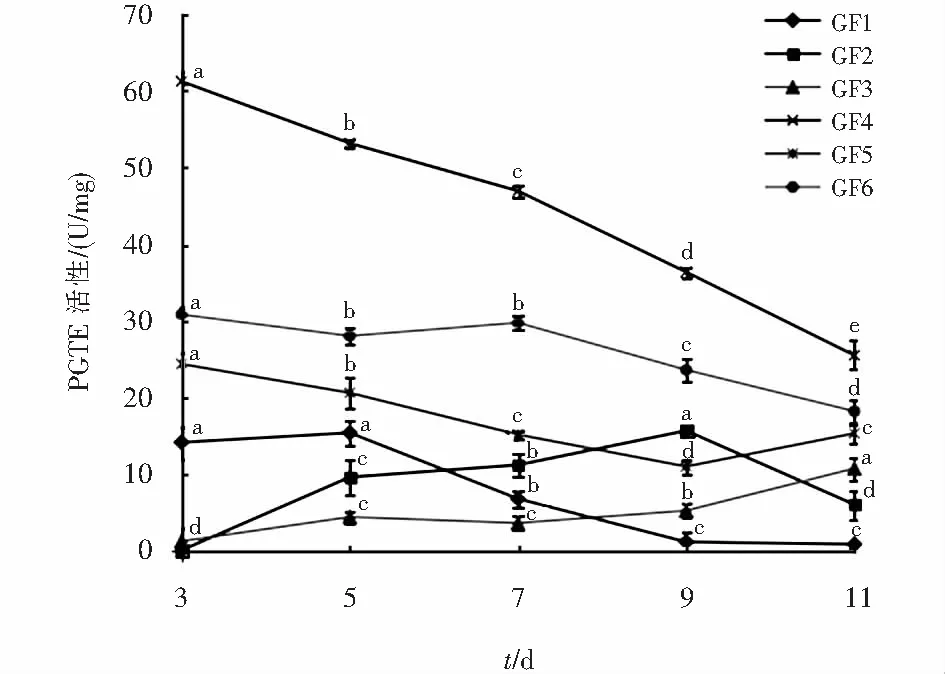
图11 6株黄芪根腐病原菌产PGTE能力比较Fig.11 Comparison of PGTE production capacity of 6 strains of root rot of Astragalus membranaceus var.mongholicus
6种黄芪根腐病原菌产PMTE的情况见图12,6株病原菌在第3 d均有最高的PMTE活力,分别为100.11 U/mg、135.76 U/mg、69.32 U/mg、78.32 U/mg、35.75 U/mg、14.98 U/mg.菌株GF1、GF2、GF4、GF5、GF6在第3 d~11 d的酶活力均逐渐降低,在第11 d达到最低值.菌株GF3第3 d~5 d的酶活力逐渐降低,5 d~7 d逐渐升高,但是7 d的酶活力为51.59 U/mg没有高于第3 d,第7 d~11 d的酶活力逐渐降低.
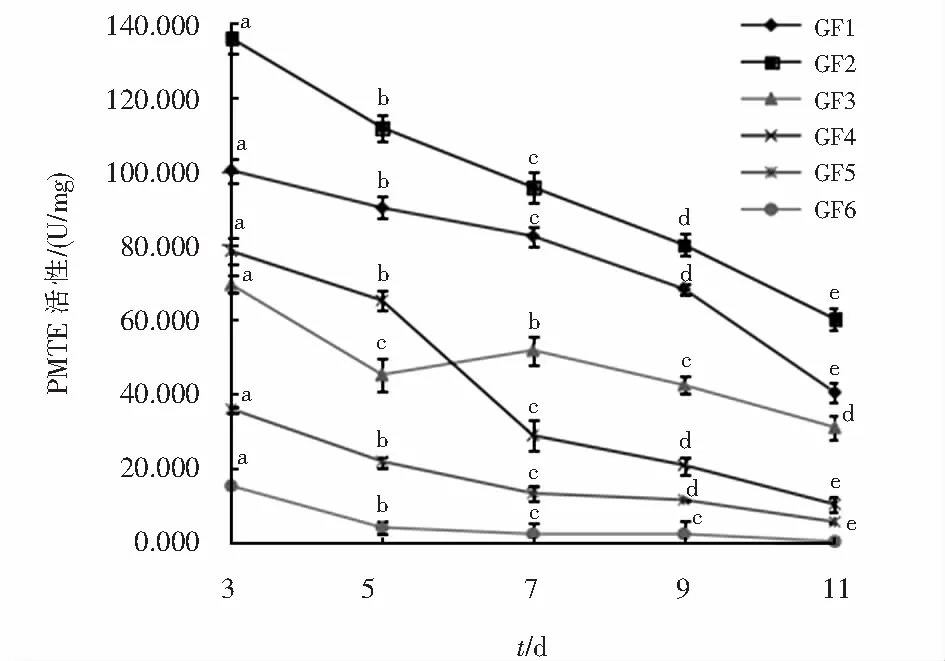
图12 6株黄芪根腐病原菌产PMTE能力比较Fig.12 Comparison of PMTE production capacity of 6 strains of root rot of Astragalus membranaceus var.mongholicus
3 讨论
陈垣等[10]的研究结果表明尖孢镰刀菌(Fusariumoxysporum)和茄腐镰刀菌(Fusariumsolani)为甘肃渭源黄芪根腐病的主要致病菌,且尖孢镰刀菌(Fusariumoxysporum)的致病力最强,本研究从甘肃渭源采集的黄芪根腐病样上分离得到的6株病原菌均鉴定为茄腐镰刀菌(Fusariumsolani),并未分离出尖孢镰刀菌(Fusariumoxysporum),在对分离得到的6株茄腐镰刀菌(Fusariumsolani)进行回接试验,均能使黄芪根段产生出现不同程度的黑色病斑,切开后根内部组织有不同程度的变褐,这与采集的原始病组织的病斑形状相同,其中菌株GF3的致病力最强.且6株茄腐镰刀菌在菌落特征、生长速率及产孢量上存在差异,这说明甘肃渭源地区近年黄芪根腐病病原菌的致病种群及其致病力方面发生了一定的变化.以前报道中对黄芪根腐病菌多是通过形态鉴定和rDNA-ITS序列分析鉴定,本文除此之外还进行了EF-1α基因序列分析,使鉴定结果更加准确.
本研究6株病原菌均能产生4种果胶酶(PG、PMG、PGTE、PMTE)和2种纤维素酶(Cx、βG).在产酶能力上6株病原菌产果胶酶的活力明显优于产纤维素酶的活力,在产酶时间上6株病原菌的果胶酶在3 d以前就已经开始产生,第3 d酶活力已达最高,而两种纤维素酶在3 d后才开始产酶,后续虽产酶活力逐渐升高,但是与4种果胶酶的酶活力相比还是较低.这与病原菌入侵寄主植物时,首先果胶酶降解胞间层以及初生壁中的果胶物质,然后纤维素酶和半纤维素酶降解次生壁中的纤维素的致病机制相吻合[17].
病原菌产酶活性的大小在一定程度上能够表明其致病力的大小,柴莹等[18]的研究结果表明黑龙江省马铃薯干腐病的强致病菌株接骨木镰孢菌(Fusariumsambucinum)和燕麦镰孢菌(Fusariumavenaceum)在体内培养条件下产生的 Cx、β-葡萄糖苷酶、PG、PMG的活性均高于其他3种镰孢菌,而弱致病菌株拟枝孢镰孢菌(Fusariumsporotriodides)和拟丝孢镰孢菌(Fusariumtrichothecioides)产生的这4种细胞壁降解酶活性较低.本研究中菌株GF3产生的2种果胶酶(PG、PMG)在第3 d的酶活力高于其他几株菌株,产2种纤维素酶(Cx、βG)的酶活力在整个之间段均高于其他几株病原菌,这可以表明菌株GF3的致病力强于其他5株病原菌与其侵染初期较高的2种果胶酶(PG、PMG)活性和后续较高2种纤维素酶(Cx、βG)活性有关.
本研究只测定了黄芪根腐病菌在活体外产生的细胞壁降解酶的活性,但是活体内外的环境因素差异、体外诱导物不同以及植物自身抗病性等均会导致活体内外酶活性有一定的差异[19],金勤等[20]的研究发现油茶炭疽病菌(Colletotrichumgloeosporiqides)在活体内产生的细胞壁降解酶活性明显低于活体外.因此本研究中每种菌株离体细胞壁降解酶活性的测定并不能完全代表病原菌在自然状态下活体内的变化情况,但是能够说明6株病原菌株之间所产酶的种类及酶活性之间的差异,这对探索其致病力差异具有一定意义.后续可以探究病原菌果胶酶和纤维素酶产生的分子机理,进而揭示镰刀菌的致病机理,并可以针对强致病力菌株进行黄芪根腐病病害防治研究,这对田间黄芪根腐病的防治具有指导意义.
4 结论
甘肃渭源黄芪根腐病致病菌的主要类型为茄腐镰刀菌(Fusariumsolani),且分离所得的6株茄腐镰刀菌(Fusariumsolani)菌株的致病力存在差异,这与其所产的细胞壁降解酶的种类和活力不同有关.
