TSP、PM2.5致人脐静脉内皮细胞和人支气管上皮细胞氧化损伤及凋亡
2021-07-16万雪莹陈廷涛邹长伟
黄 虹,万雪莹,杨 红,陈廷涛,邹长伟*
(南昌大学a.资源环境与化工学院;b.鄱阳湖环境与资源利用教育部重点实验室;c.转化医学研究院,江西 南昌 330031)
中国快速的工业化和交通运输发展导致严重的空气污染问题[1]。先前的研究表明,空气污染已大大增加了人类呼吸系统疾病、心血管疾病、免疫系统异常和癌症的发病率。据估计,每年约有80万人死于空气污染[2]。近年来许多学者开始关注空气中颗粒物健康危害,然而颗粒物是一种复杂的、非均匀的、不同维数的颗粒混合物。研究表明,颗粒物的组成、大小、生物学特性和物理特性与区域、季节和时间的变化有关,因此,颗粒物暴露和毒性可能与地理位置、采样季节、排放源、特定的大气化学和天气条件等[3]密切相关。除时间和空间的影响外,颗粒物的粒径也是不可忽略的因素,研究表明细小的颗粒物(PM2.5)因比表面积小、可携带多种重金属和有机物以及能够到达肺部深处—肺泡,对人体的伤害更大[4]。
近年来,环境空气中颗粒物的毒理学研究逐渐被科学家们所重视,然而探索室内颗粒物对人体健康的潜在风险和毒理作用尚为少见[5]。室内环境对于人类的生存至关重要,现代人约90%的时间在室内度过[6],室内环境空气质量对人类健康重要性不言而喻。当今社会,各种类型的打印机被广泛用于现代办公和家庭生活。随着打印机的广泛使用,在打印机工作条件下室内空气污染对健康的影响与危害的研究显得尤为重要且十分有必要[7]。研究发现长期使用打印机会导致眼睛瘙痒、皮肤红斑、上呼吸道不适、尘肺、血栓形成和碳纳米颗粒腹膜沉积[8- 9]等相关的职业病。研究表明打印室中的颗粒物增加了人们患呼吸系统疾病甚至心血管疾病的机会[10],然而关于打印室内颗粒物对人体的危害、影响与作用机制的研究鲜有报道。本研究采集南昌大学前湖校区某打印室PM2.5和环境楼楼顶环境空气TSP、环境空气PM2.5,通过对人脐静脉内皮细胞(HUVEC)和人支气管上皮细胞(HBE)体外染毒,来探索环境空气TSP、PM2.5及打印室PM2.5等不同来源不同粒径的颗粒物对HUVEC细胞和HBE的致毒作用机制,从而为明确颗粒物的毒性作用提供实验依据,为长期接触PM2.5所诱发的有关疾病的防控提供理论基础和科学依据。
1 材料与方法
1.1 材料
1.1.1 药品与试剂
打印室PM2.5采自南昌大学前湖校区某打印室,环境空气总悬浮颗粒物(TSP)和环境空气PM2.5采自南昌大学前湖校区资源环境与化工学院教学楼楼顶。细胞存活率(CCK-8,cell counting kit-8)试剂盒、超氧化物歧化酶(SOD,superoxide dismutase)试剂盒、丙二醛(MDA,malondialdehyde)试剂盒均为南京建成生物工程研究所产品。β肌动蛋白(β-actin)抗体、BCL2-Associated X的蛋白质(Bax,Bcl-2-associated X protein)抗体、B淋巴细胞瘤-2基因(Bcl-2,B-cell lymphoma-2)抗体均为美国Proteintech公司产品。
1.1.2 细胞与仪器
HUVEC和HBE购于中国科学院上海生物化学研究所。仪器有:1.05 m3.min-1大容量采样器(崂山电子仪器厂有限公司),5 L·min-1小流量采样器(美国Airmetrics公司),细胞培养箱(LONGYUE/龙跃),超净工作台(德国The Baker Company),酶标仪(美国Thermo公司),琼脂糖凝胶电泳系统(北京六一仪器厂),凝胶成像分析仪(美国BIO-RAD),倒置荧光显微镜(日本OLYPUS),水浴锅(上海精宏实验设备有限公司),高压蒸汽灭菌锅(上海中安医疗器械厂),-80 ℃冰箱(美国Thermo公司)。
1.2 实验方法
1.2.1 颗粒物的采集与制备
空气中的TSP和PM2.5采用1.05 m3.min-1的大容量采样器采样,打印室PM2.5采用5 L·min-1的小流量采样器采样,一次连续采样时间均为24 h,采时均为11月1日~12月1日。滤膜采样前保持24 h恒温恒湿后称重,采样时,滤膜毛面向上,采样24 h结束后,记录参数,用锡纸将滤膜包裹放入-20 ℃冰箱中,保存备用。
采样膜经超声震荡仪超声振荡,将颗粒物洗脱下来,取得颗粒物悬液,离心,次日放入真空冷冻干燥机中干燥,将所得的颗粒物粉末放入-80 ℃保存。配制母液时,取适量的颗粒物干粉,用紫外线灭菌30 min,然后用无菌磷酸盐缓冲盐水(PBS,phosphate buffer saline)配置成浓度为10 mg·mL-1母液。实验前吸取母液配制成实验所需要的浓度。
1.2.2 实验分组
环境空气颗粒物样本:该实验设置对照组(不加样品的细胞孔),PRL组(环境空气TSP),PRM组(打印室PM2.5),PRH组(环境空气PM2.5)4个组别,浓度均为100 μg·mL-1[11]。
打印室PM2.5样本:该实验设置对照组(不加样品的细胞孔),TSP组(打印室PM2.5低浓度25 μg·mL-1),PRM组(打印室PM2.5中浓度100 μg·mL-1),PM组(打印室PM2.5高浓度400 μg·mL-1)4个组别。
1.2.3 细胞增殖实验
取对数生长期的HUVEC和HBE,接种于96孔板中,每孔100 μL,在37 ℃、5% CO2培养箱培育24 h后待细胞贴壁后进行染毒实验。加入样本溶液,每组设置3个复孔,向96孔板中加入100 μL含有样本的完全培养基。将96孔板放入细胞培养箱中培育7 h后将96孔板中的液体吸出,洗3次(避免杂质影响吸光度)每孔加入10 μLCCK-8溶液(尽量不要生成气泡)。将96孔板放入细胞培养箱中培育1~4 h后用酶标仪测定在450 nm处的吸光度。细胞的存活率采用下式计划:
细胞存活率%=(测试孔OD/对照孔OD)×100%
1.2.3 超氧化物歧化酶(SOD)的测定
按照上述方法于六孔板培育细胞并染毒7 h后,每孔加入RIPA裂解液和蛋白酶抑制剂,收集上清,按照BCA浓度测定方法检测各孔蛋白浓度。按照实验说明书配制实验所需试剂,并设置对照孔,对照空白孔、测定孔,测定空白孔。按照说明书在每孔中加入所需试剂,混匀后,37 ℃孵育20 min,用酶标仪测定在450 nm处的吸光度。按照下述公式计算SOD活性:
细胞内SOD活性(U·mgprot-1)=SOD抑制率÷50%×(反应体系/稀释倍数)÷待测样本蛋白浓度(mgprot·mL-1)
1.2.4 丙二醛(MDA)的测定
按照上述方法收集细胞上清,按照BCA浓度测定方法检测各孔蛋白浓度。按照实验说明书配制实验所需试剂,并设置空白管,标准管,测定管。每孔加入所需试剂,95 ℃水浴40 min,冷却后4000 r.min-1离心10 min,吸取250 μL各管反应液加入到新的96孔板中,用酶标仪测定在530 nm处的吸光度。按照下述公式计算MDA含量:
细胞内MDA含量(nmol.mgprot-1)=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度(10 nmol·mL-1)÷待测样本蛋白浓度(mgprot·mL-1)
1.2.5 Western blot测定凋亡相关蛋白的表达
loading buffer稀释蛋白样品,沸水浴5 min。样品经10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE,sodium dodecyl-sulfate polyacrylamide gel electrophoresis)转移至PVDF膜,置于5%脱脂乳-TBST(TBST,tris buffered saline tween 20)中封闭1 h,3次洗涤后,在4 ℃条件下于一抗孵育过夜,Bax/Bcl-2一抗配制应参照一抗的说明书,按中间比例用1%脱脂乳配制一抗,其中Bax按1:5 000稀释,Bcl-2按1:2500稀释。然后用二抗稀释1:5 000和1%脱脂乳-TBST在室温下孵育60 min,滴加显影液进行曝光,观察结果并计算灰度值。
1.2.6 统计学处理
SPSS 20.0软件(SPSS,Chicago,IL)统计分析。P值<0.05有统计学意义。
2 结果与讨论
2.1 环境空气TSP和环境空气PM2.5对HUVEC和HBE的毒作用机制
2.1.1 细胞存活率
为了探讨环境空气TSP和环境空气PM2.5对细胞的毒性,进行CCK-8增殖实验。实验检测结果如图1所示,将100 μg·mL-1的环境空气TSP和环境空气PM2.5与HUVEC和HBE共孵育7 h后,与对照组相比,在环境空气TSP和环境空气PM2.5作用下,HUVEC和HBE的细胞存活率均下降,细胞存活率分别下降到71.26%和22.06%(HUVEC),78.12%和20.89%(HBE)。与环境空气TSP相比,环境空气PM2.5对细胞的毒作用更大,使得细胞存活率显著下降(P<0.05)。这提示我们粒径越小的颗粒物对细胞的毒性更强。
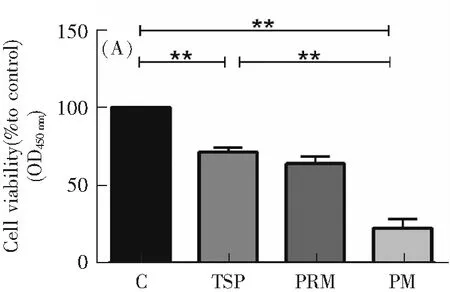
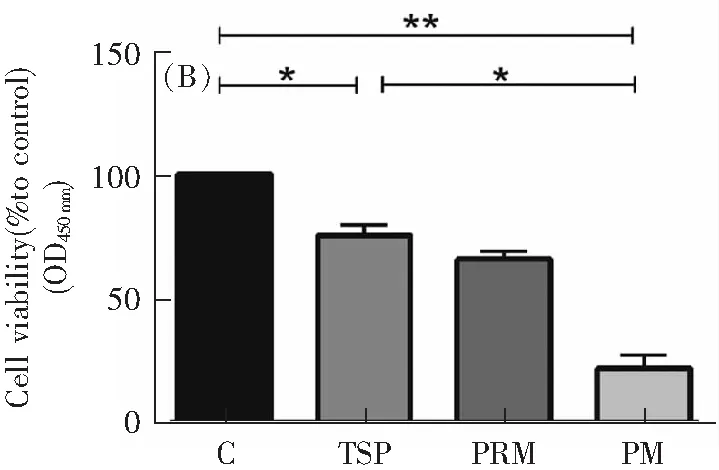
图1 环境空气TSP、打印室PM2.5和环境空气PM2.5对细胞存活率的影响
2.1.2 细胞氧化损伤
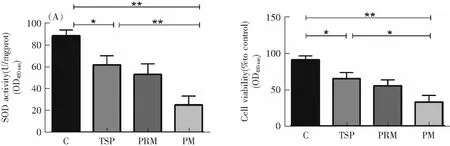
氧化损伤是指体内氧化与抗氧化作用的失衡,可产生大量活性氧,活性氧是氧化应激最重要的分子,它在人体内通过自然生物过程和外界刺激(如空气污染)产生,通过对蛋白质和DNA的损伤、炎症和细胞毒性[2,12]导致多种病理状态[13]。研究表明,当机体发生氧化损伤时,机体中SOD活性降低,并且MDA含量升高,这是心血管系统结构和功能损伤的重要原因之一。为了检测颗粒物对细胞的氧化损伤程度,我们选取了SOD、MDA两个常用的氧化应激相关指标,通过对细胞染毒7 h后细胞相关指标的变化来评价颗粒物对细胞的影响。由图2A可知,将100 μg·mL-1的环境空气TSP和环境空气PM2.5与HUVEC和HBE共孵育7 h后,与对照组相比,在环境空气TSP和环境空气PM2.5作用下HUVEC和HBE中SOD活性下降,SOD分别下降到59.14和22.31 U·mgprot-1(HUVEC),63.28和32.41 U·mgprot-1(HBE)。与环境空气TSP相比,环境空气PM2.5使细胞中SOD活性显著下降(P<0.05)。
细胞中MDA含量如图2B所示,与对照组相比,环境空气TSP和环境空气PM2.5显著升高HUVEC和HBE中MDA的含量,其中环境空气PM2.5诱导细胞氧化损伤程度最强,使HUVEC中的MDA含量升高17倍,使HBE中的MDA含量升高26倍(P<0.05)。这提示我们粒径越小的颗粒物诱导细胞氧化损伤的能力更强。
2.1.3 细胞凋亡
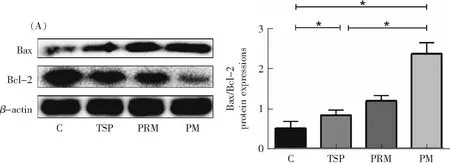
凋亡是指细胞程序性死亡,正常情况下在机体进化、生长发育过程中起着重要作用,但当细胞凋亡出现异常,细胞群体平衡失调则易导致疾病的发生。目前公认的两条细胞凋亡途径是死亡受体途径和线粒体凋亡途径[14]。死亡受体途径是通过结合细胞表面死亡受体如TNF-α及其配体TNR,最终激活细胞收缩、染色质凝集、凋亡小体形成等下游凋亡事件的主要影响因子Caspase-3,从而介导细胞凋亡[15]。线粒体凋亡途径主要激活Bcl-2家族成员中促凋亡基因Bax的表达。Bax是最重要的促凋亡基因之一[16],促进细胞色素C从线粒体释放到细胞质中,激活Caspase-3抑制抗凋亡基因Bcl-2的表达,从而介导细胞凋亡。除Bax因子外,在细胞凋亡过程中Bcl-2也发挥了至关重要的作用[17]。Bcl-2是凋亡信号转导通路中凋亡的关键调控因子,是最早发现的抗凋亡基因。研究发现正常情况下Bcl-2和Bax的表达水平基本稳定,当Bax在细胞中过表达时,细胞对死亡信号的响应更强烈,从而引发细胞凋亡;当Bcl-2在细胞中高度表达时,抑制细胞凋亡的作用更加明显,细胞存活时间延长[18]。因此,多项研究表明,这两种相对蛋白的比例是决定细胞存活时间的关键[19]。本章主要研究Bcl-2家族调控的线粒体凋亡途径。本研究实验结果如图3所示,与对照组相比,环境空气TSP和环境空气PM2.5均显著上调HUVEC和HBE凋亡通路中的Bax/Bcl-2蛋白表达量,与环境空气TSP相比,环境空气PM2.5显著上调HUVEC和HBE中Bax/Bcl-2蛋白表达量(P<0.05)。本研究表明,颗粒物粒径越小,诱导细胞凋亡的能力越强。
HUVEC HBE
HUVEC
2.2 打印室PM2.5和环境空气PM2.5对HUVEC和HBE的毒作用机制
由以上研究结果我们知道粒径是影响颗粒物毒性的重要因素,研究表明,除了粒径,排放源也是重要的影响因素之一[3]。
2.2.1 细胞存活率
为了探讨同一粒径不同来源的打印室PM2.5和环境空气PM2.5对细胞的毒性,将100 μg·mL-1的打印室PM2.5和环境空气PM2.5与HUVEC和HBE共孵育7 h后进行CCK-8增殖实验。实验检测结果如图1所示,与对照组相比,打印室PM2.5使HUVEC和HBE的细胞存活率下降,细胞存活率分别下降到63.68%(HUVEC)、64.89%(HBE),说明打印室PM2.5对细胞存活率有影响,打印室内人群需做好防护措施。与对照组相比,环境空气PM2.5使HUVEC和HBE的细胞存活率明显下降,细胞存活率分别下降到22.06%(HUVEC),20.89%(HBE)。本实验中环境空气PM2.5对细胞存活率的影响比打印室PM2.5的更大,分析其中一个重要的原因是本实验中环境空气采样点位于南昌大学前湖校区环境楼楼顶,离采样点直线距离约100 m有一条交通繁忙的高速公路(枫生高路前湖段),采样点与公路之间离地高度相当,且无绿化隔离离地,反映道路交通相关的PM2.5对细胞生长有较明显的抑制作用[20]。
2.2.2 细胞氧化损伤
由图2A可知,将100 μg·mL-1的打印室PM2.5和环境空气PM2.5与HUVEC和HBE共孵育7 h后,与对照组相比,打印室PM2.5和环境空气PM2.5均显著降低HUVEC和HBE中SOD的活性,分别是50.82和22.31 U·mgprot-1(HUVEC),52.69和32.41 U·mgprot-1(HBE)。其中,与打印室PM2.5相比,环境空气PM2.5使细胞中SOD活性显著下降(P<0.05)。
细胞中MDA含量如图2B所示,与对照组相比,打印室PM2.5和环境空气PM2.5显著升高HUVEC和HBE细胞中MDA的含量,其中与打印室PM2.5相比,环境空气PM2.5使细胞氧化损伤程度最强,使HUVEC中的MDA含量升高2倍,使HBE中的MDA含量升高1.5倍(P<0.05)。本实验中,打印室PM2.5和环境空气PM2.5均诱导细胞发生氧化损伤。因受枫生高速交通源影响,本实验环境空气采样点采集的PM2.5诱导细胞发生氧化损伤的影响大。
2.2.3 细胞凋亡
本研究实验结果如图3所示,与对照组相比,打印室PM2.5和环境空气PM2.5均显著上调HUVEC和HBE凋亡通路中的Bax/Bcl-2蛋白表达量,与打印室PM2.5相比,环境空气PM2.5显著上调HUVEC和HBE细胞中Bax/Bcl-2蛋白表达量(P<0.05)。本实验中,打印室PM2.5和环境空气PM2.5均诱导细胞凋亡,提示当室内存在特定排放源(如打印源)时需注意防控室内PM2.5对人体健康的影响;另外,本实验中采集的环境空气中PM2.5对HUVEC、HBE细胞凋亡影响很大,反映道路交通相关的PM2.5可诱导细胞发生炎症以及凋亡[21]。
2.3 打印室PM2.5对HUVEC和HBE的毒作用机制
根据以上研究结果表明,打印室PM2.5比环境空气PM2.5毒作用虽然略小,但因为在室内停留时间长,对人体存在一定的伤害,由于其作用机制我们依然不了解,因此设计实验探究其毒理机制。
2.3.1 细胞存活率
分别选择浓度为0,25,100,400 μg·mL-1的打印室PM2.5染毒HUVEC和HBE7 h。CCK-8实验结果如图4所示,随着打印室PM2.5浓度的升高,细胞存活率逐渐降低,分别是93.7%,62.1%和31.9%(HUVEC),92.43%,49.71%和24.45%(HBE)(P<0.05)。

HUVEC
2.3.2 细胞氧化损伤
为了检测打印室PM2.5对HUVEC和HBE细胞的氧化损伤程度,本实验选择SOD和MDA作为检测指标,SOD活性的检测结果如图5A所示,与对照组相比,随着打印室PM2.5浓度的升高,HUVEC和HBE细胞中的SOD活性逐渐降低,分别是69.81,45.72和27.36 U·mgprot-1(HUVEC),74.82、51.39和28.61 U·mgprot-1(HBE)。而HUVEC和HBE细胞中的MDA含量如图5B所示,随着打印室PM2.5浓度的升高,HUVEC和HBE细胞中的MDA含量逐渐升高,其中,400 μg·mL-1打印室PM2.5使HUVEC和HBE中的MDA含量均升高至对照组的9倍(P<0.05)。
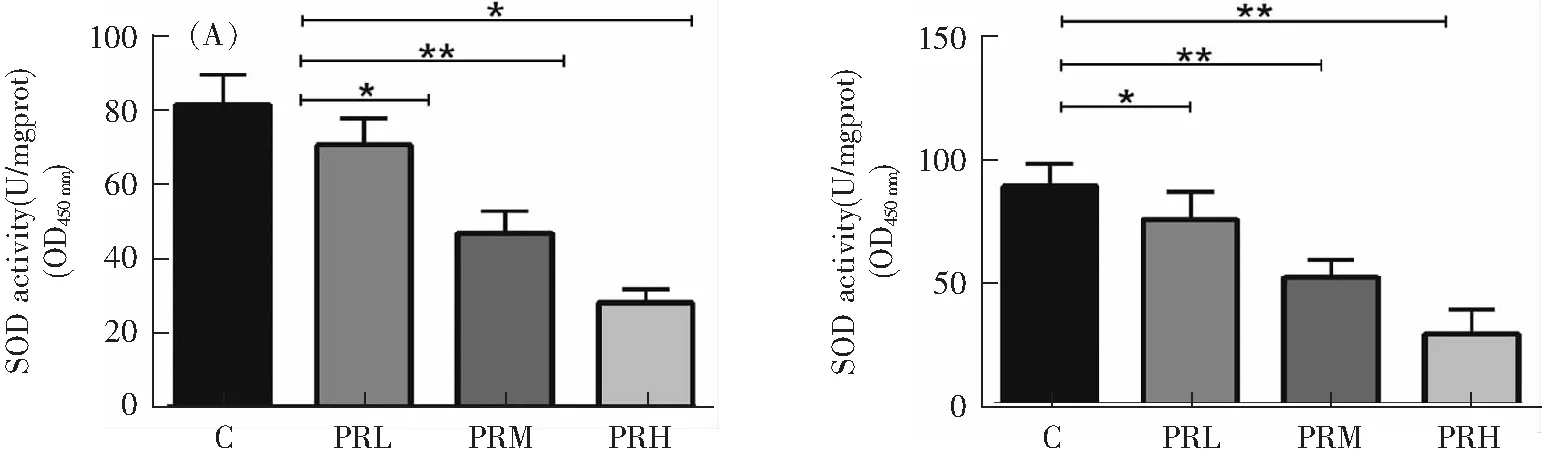
HUVEC HBE
2.3.3 细胞凋亡
为了探究打印室PM2.5对细胞凋亡通路的影响,将HUVEC和HBE暴露于不同浓度打印室PM2.5中7 h后,收集细胞上清,通过western blot实验对凋亡相关蛋白Bax/Bcl-2在染毒细胞和未染毒细胞内的表达情况进行检测。实验结果如图6所示,与对照组相比,随着浓度升高,细胞中Bax/Bcl-2蛋白表达量也逐渐增加,其中400 μg·mL-1染毒组细胞中的Bax/Bcl-2蛋白表达量明显增加(P<0.05)。
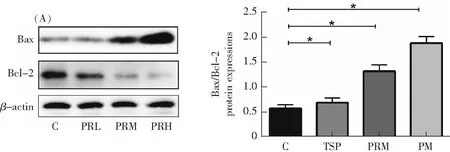
HUVEC
3 结论
环境空气TSP、打印室PM2.5和环境空气PM2.5对细胞生长均有抑制作用并能诱导氧化应激和细胞凋亡发生,且粒径越小的颗粒物毒性越强,诱导细胞氧化应急和凋亡的能力也越强。
打印室PM2.5和环境空气PM2.5均使细胞(HUVEC、HBE)存活率下降,导致细胞氧损伤和细胞凋亡,反映室内特定的打印排放源和室外交通源使PM2.5对细胞毒害作用增强。
打印室PM2.5对人体健康的危害不容小觑,浓度越高,细胞存活率和SOD活性越低且MDA含量和凋亡通路中的Bax/Bcl-2蛋白表达也越高。
