氯化钙改性的HAP-APB@CaCO3复合材料吸附性能
2021-07-16陈文金彭希珑何宗健
陈文金,彭希珑,何宗健*
(南昌大学a.资源环境与化工学院;b.鄱阳湖环境与资源利用教育部重点实验室,江西 南昌 330031)
铜作为一种具有较强迁移能力的有毒重金属,广泛存在于环境中[1],由于各种人类活动,铜的含量每年都在增加,特别是在最近几年中,标记有64Cu的放射性药物的生产有所增加[2]。铜一旦进入环境,就会在土壤中积累,由于土壤风化,可溶性铜可以穿透表面和地面,并转移到动植物中,通过食物链富集作用被人体所吸收。人体摄入过多铜会导致多种疾病(包括不育症,呕吐,腹泻,血尿,黄疸和精神疾病),甚至死亡[3]。因此,对含铜废水进行处理以将其释放到环境中之前将Cu2+含量降低至允许的排放浓度非常重要。世界卫生组织(WHO)建议饮用水中的最大Cu(Ⅱ)浓度为2.0 mg·L-1[4],为实现废水的节能环保处理,应研究去除铜离子的有效方法。
目前处理含重金属废水的方法有化学沉淀法、离子交换法、电化学处理法、膜过滤、吸附法等[5-9]。吸附法是一种操作简单、成本低、吸附效率高和不易造成大面积环境污染的重金属处理方法,近年来吸附技术也被广泛应用。目前常用的吸附剂有活性炭、碳纳米管、腐殖酸、二氧化钛和羟基磷灰石(HAP)等[10-14]。其中羟基磷灰石[Ca10(PO4)6(OH)2]是脊椎动物骨骼和牙齿的组成部分之一,通常用作生物材料,由于HAP具有其独特的晶体结构,常用于吸附重金属离子[15],并且HAP是一种环境友好型的高效吸附材料。
HAP对Cu(Ⅱ)的固定化具有良好的稳定性,国内外有不少学者开展关于HAP处理含重金属废水的研究,都取得较好的效果[16-17]。HAP常使用硝酸钙和磷酸作为起始材料,氨水溶液作为pH调节剂并通过水热法制备[18],该方法成本高且制备条件困难。近年来已有通过石灰石制备HAP的报道,Kanno等[19]直接利用石灰石和磷酸二氢钠反应制备HAP涂层材料来吸附F-;Xu等[20]发现在合成HAP涂层材料过程中,加入少量乙醇(3%(体积))可显著提高HAP涂层材料对F-的去除率。目前大多数这些研究都集中在去除F-,很少有关于去除重金属Cu(Ⅱ)的研究。
本文以石灰石、磷酸氢二铵为原料,采用共混法合成HAP-APB@CaCO3复合材料,并且通过投加无水氯化钙来改性HAP-APB@CaCO3复合材料,对比了改性前后材料在不同条件下对水溶液中Cu2+的吸附影响,改性后的材料能有效的提高对水溶液中重金属铜的吸附能力。
1 实验方法
1.1 实验材料
石灰石取自南京豆村,本实验所用石灰石粉末粒径为0.074~0.15 mm;无水硫酸铜、双环己酮草酰二腙、磷酸氢二铵、无水氯化钙均为分析纯;硼砂(pH缓冲剂)购自国药集团化学试剂有限公司;含铜水溶液由无水硫酸铜溶于去离子水配置而成。
1.2 HAP-APB@CaCO3复合材料的制备
采用共混法制备HAP-APB@CaCO3复合材料,将石灰石粉末(2.5 g)与磷酸氢二铵(5.0 g)加入到锥形瓶内,磷酸氢二铵加入锥形瓶之前用100 mL去离子水溶解,混合后将锥形瓶置于集热式恒温加热磁力搅拌器(DF-101Z)中反应96 h,温度控制为40 ℃。反应完后过滤并收集产物,洗至中性,在60 ℃温度下干燥24 h,即可得到HAP-APB@CaCO3复合材料。
反应主方程如下[21]:
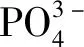
1.3 改性HAP-APB@CaCO3复合材料的制备
采用共混法制备改性HAP-APB@CaCO3复合材料,将石灰石粉末(2.5 g)、磷酸氢二铵(5.0 g)、无水氯化钙加入到锥形瓶内混合反应,其中三者质量比分别为25:50:2,25:50:5,25:50:8,25:50:10,25:50:15,25:50:20,25:50:30,磷酸氢二铵加入锥形瓶之前均用100 mL去离子水溶解,混合后将锥形瓶分别置于集热式恒温加热磁力搅拌器(DF-101Z)中反应96 h,温度控制为40 ℃。反应完后过滤并收集产物,洗至中性,在60 ℃温度下干燥24 h,即可得到改性HAP-APB@CaCO3复合材料。
1.4 仪器分析
使用衍射仪(D8 ADVANCE,Germany)以3°·min-1的扫描速率在10°~80°的扫描范围内获得粉末X射线衍射(XRD)图案的表征。
通过傅立叶变换红外分光光度法(FT-IR)分析合成材料的化学键。使用FT-IR光谱仪(Nicolet 5700,USA)在4 000~400 cm-1的光谱范围内记录材料的光谱。
通过物理吸附分析仪(ASAP-2020,USA)分析样品的结构性质。将样品在200 ℃真空条件下脱气5 h,利用BET法计算比表面积。当相对压力(P/P0)接近1时,总孔体积由吸附的蒸汽量获得,其中P和P0分别是测量的和平衡压力。使用Barrett-Joyner-Halenda方法(BJH)从等温线的解吸曲线评估孔径分布。
将钯-金合金分别真空蒸发到合成的样品上,然后使用JSM 6701F(日本)扫描电子显微镜(SEM)获取样品相应放大倍率(20000×)的外表面照片。
1.5 批量吸附实验
(1)吸附时间对HAP-APB@CaCO3复合材料吸附行为的影响
将HAP-APB@CaCO3复合材料粉末(0.01 g)浸入100 mL浓度为20 mg·L-1Cu2+溶液中,在温度为30 ℃,pH为5.52条件下,测出5,10,30,50,80,120,180,240 min水溶液中Cu2+剩余量。设置3组平行实验。
(2)无水氯化钙投加量对HAP-APB@CaCO3复合材料吸附行为的影响
将加入不同质量无水氯化钙制备的改性HAP-APB@CaCO3复合材料粉末(0.01 g)浸入100 mL浓度为20 mg·L-1Cu2+溶液中,在温度为30 ℃,反应时间为120 min,pH为5.52条件下,探究不同无水氯化钙投加量对HAP-APB@CaCO3复合材料的吸附情况,吸附后取适量的溶液过滤并检测滤液中剩余铜量。吸附实验重复进行3次。
(3)初始Cu2+浓度的影响
在温度为30 ℃,反应时间为120 min,pH为5.52条件下,通过将0.01 g吸附剂与100 mL Cu2+溶液(初始Cu2+浓度10,20,30,40,50 mol·L-1)混合,研究了不同Cu2+浓度对吸附剂吸附的影响。
(4)温度的影响
在铜离子浓度为20 mg·L-1,反应时间为120 min条件下,通过将0.01 g吸附剂与100 mL Cu2+溶液混合,研究了不同温度对吸附剂吸附效果的影响。反应器中溶液的pH值为5.52,温度分别为20 ℃,30 ℃,40 ℃,50 ℃。
溶液中Cu2+的测定采用双环己酮草酰二腙分光光度法测定[22],计算吸附效率和吸附容量公示如下:
(1)
(2)
式中:c0为初始Cu2+浓度,mg·L-1;ci为吸附后Cu2+浓度,mg·L-1;η为吸附效率,%;V为Cu2+溶液体积,L;m为吸附剂质量,g;qi为吸附容量,mg·g-1。
2 结果与讨论
2.1 HAP-APB@CaCO3复合材料与改性HAP-APB@CaCO3复合材料表征分析
图1(a)为石灰石样品、HAP-APB@CaCO3复合材料和改性HAP-APB@CaCO3复合材料(25:50:15)粉末的XRD图谱。用于鉴定HAP形态的主要区域在2θ为30.5°~34.5°处,CaCO3的特征峰出现在29.3°,31.35°,36.2°,39.6°和43.3°处,HAP的特征峰出现在32.2°和34.1°处[23]。根据HAP-APB@CaCO3复合材料和改性HAP-APB@CaCO3复合材料的XRD图谱,可以发现在2θ为32.2°和34.1°处均出现HAP的特征峰,说明所制备复合材料中存在HAP。HAP-APB@CaCO3复合材料和改性HAP-APB@CaCO3复合材料的XRD衍射图谱中CaCO3的特征峰峰值相对较低,是由于碳酸钙与磷酸盐反应而导致的结果。图谱中HAP的衍射峰彼此未完全分离,说明合成的HAP为弱结晶结构,但是该特征峰较尖锐,表明形成的HAP相良好。另外,由于实验所使用的石灰石中含有部分微量的石英、氧化铝、氧化铁等,所以XRD图谱中可以检测出其峰的存在。

2θ/(°)

w/cm-1图1 石灰石与复合材料粉末的XRD(a)和FT-IR(b)图谱(1:石灰石样品;2:HAP-APB@CaCO3复合材料;3:改性HAP-APB@CaCO3复合材料)
根据图2(a)中的吸附-解吸等温线,HAP-APB@CaCO3复合材料和改性HAP-APB@CaCO3复合材料的吸附-解吸等温线属于IV等温线,并且吸附-解吸等温线显示出H3滞后环,表明材料是多孔结构材料[25]。表1为吸附材料的平均孔径计算结果,改性HAP-APB@CaCO3复合材料具有更大的比表面积和孔体积,改性HAP-APB@CaCO3复合材料具有更加优越结构。根据吸附实验,改性HAP-APB@CaCO3复合材料具有更大吸附性能,由于利用无水氯化钙改性过程中,反应容器内更多的磷酸氢二铵被消耗,反应过程中产生更多的CO2和NH3,气体的鼓出起发泡、增容、提升比表面积的作用。因此,改性后材料比表面积和孔体积增大,从而提升其吸附性能。同时,HAP-APB@CaCO3复合材料和改性HAP-APB@CaCO3复合材料的孔径分布在0和235 nm之间(图2(b)),改性后HAP-APB@CaCO3复合材料比表面积的变化可能会改变材料原有的晶体结构。
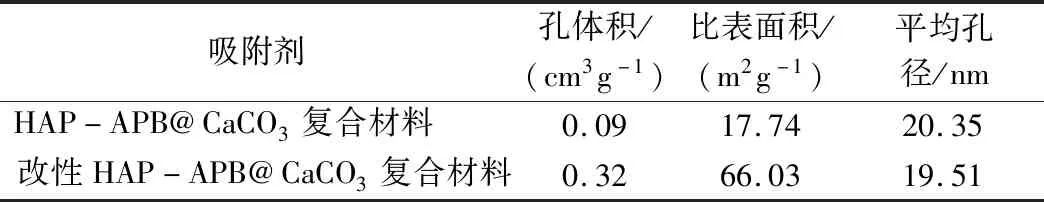
表1 复合材料的孔径分布
图3为HAP-APB@CaCO3复合材料和改性HAP-APB@CaCO3复合材料的SEM显微照片。HAP-APB@CaCO3复合材料表面具有孔隙和不规则的球状结构,相对分散(图3(a))。改性HAP-APB@CaCO3复合材料表面层具有许多致密的片状结构(图3(b)),改性HAP-APB@CaCO3复合材料结构相比于HAP-APB@CaCO3复合材料更加优越,其表面结构相互簇拥,使得材料整体粗糙程度更大,从而具有更大的比表面积,与BET检测结果一致。

本对压力/(p/p0)
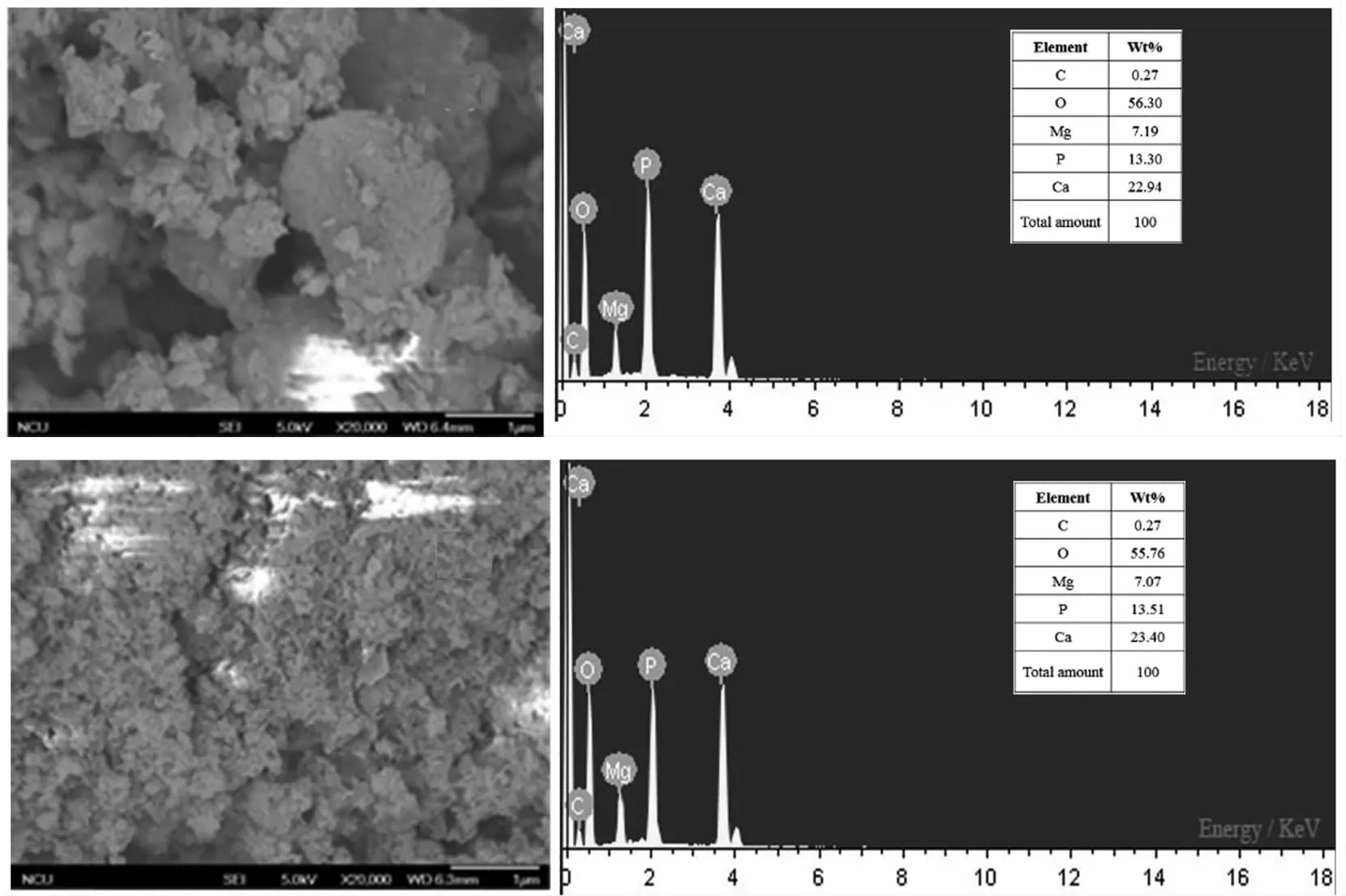
图3 HAP-APB@CaCO3和改性HAP-APB@CaCO3复合材料的SEM-EDS图(20000×)(a)HAP-APB@CaCO3复合材料,(b)改性HAP-APB@CaCO3复合材料
2.2 HAP-APB@CaCO3与改性HAP-APB@CaCO3复合材料对Cu2+的吸附性能
改变无水氯化钙的加入量,得到七种不同质量比的改性HAP-APB@CaCO3复合材料。利用改性HAP-APB@CaCO3复合材料进行吸附实验,吸附结果见图4(a)。随着无水氯化钙加入量的增加,材料对Cu2+的吸附容量逐渐增大,吸附效率逐渐升高。当石灰石粉末、磷酸氢二铵、无水氯化钙三者质量比为25:50:15时,吸附量达到最大,其值为155.88 mg·g-1,并且随着无水氯化钙量的增加吸附效果基本保持不变。后续实验中使用的改性HAP-APB@CaCO3复合材料均为石灰石粉末、磷酸氢二铵、无水氯化钙三者质量比25:50:15制备的吸附材料。

质量比
图4(b)为HAP-APB@CaCO3复合材料和改性HAP-APB@CaCO3复合材料对Cu2+的吸附容量随时间的变化曲线图。HAP-APB@CaCO3复合材料和改性HAP-APB@CaCO3复合材料对Cu2+的吸附容量随着时间的增加而增加,并且在120 min基本达到吸附饱和。通过计算,HAP-APB@CaCO3复合材料和改性HAP-APB@CaCO3复合材料对Cu2+的吸附容量分别为90.90和155.88 mg·g-1。相同条件下,改性HAP-APB@CaCO3复合材料对Cu2+表现出更大的吸附性能,由于HAP上具有与Cu2+发生离子交换和表面络合的活性位点[26],根据BET分析可知,改性HAP-APB@CaCO3复合材料具有更大的比表面积,其表面可以提供更多的活性位点,从而表现出更大的吸附性能。
图5为Cu2+初始溶度和温度对吸附剂吸附容量影响的趋势图。从图5(a)中可得看出,HAP-APB@CaCO3复合材料和改性HAP-APB@CaCO3复合材料的吸附容量(qe)随着Cu2+初始浓度的增加而增加。铜离子浓度从10增加到50 mg·L-1,HAP-APB@CaCO3和改性HAP-APB@CaCO3复合材料对Cu2+的吸附容量分别为:88.12~117.16和96.96~180.56 mg·g-1。说明吸附过程中,较高的初始浓度可以克服了固液相之间的传质阻力,为吸附过程提供驱动力,增加吸附剂对Cu2+的吸收[27]。图6(b)反映温度对吸附剂吸附容量的影响,随着温度的升高,HAP-APB@CaCO3和改性HAP-APB@CaCO3复合材料对Cu2+的吸附容量增加,材料的吸附性能增大,该现象属于典型的化学吸附特征。
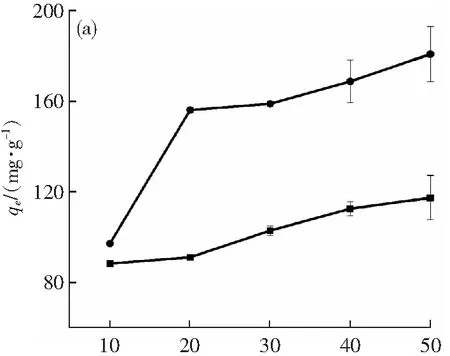
c0/(mg·L-1)
2.3 吸附等温线研究
等温线方程:
(3)
(4)
式中,qe是每单位质量吸附剂的平衡吸附量(mg·g-1);qm(mg·g-1)是最大吸附容量,KL/(L·mg-1)是Langmuir常数;ce为平衡浓度,KF/(mg·g-1)是Freundlich常数,n是吸附强度。
图6为Langmuir和Freundlich模型的线性拟合,相关等温线参数见表2。HAP-APB@CaCO3和改性HAP-APB@CaCO3复合材料都与Langmuir等温方程具有较好的拟合度(更大的R2值),另外根据Langmuir等温方程计算得到的qm值与实验值更为接近,因此,Langmuir等温模型可以更好的用于描述HAP-APB@CaCO3和改性HAP-APB@CaCO3复合材料对Cu2+的吸附行为,发生在两种吸附材料表面的吸附都属于单分子层吸附,利用无水氯化钙对HAP-APB@CaCO3复合材料改性并没有使得其吸附方式发生改变。根据BET检测结果,改性HAP-APB@CaCO3复合材料具有更大的比表面积,其表面可提供的更多数量的活性位点,因此改性HAP-APB@CaCO3复合材料对Cu2+具有更强的吸附性能。

表2 Langmuir和Freundlich等温线参数
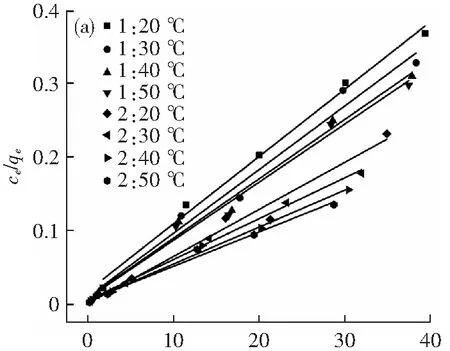
ce/(mg·L-1)(a) Langmuir等温线
2.4 动力学研究
动力学方程:
准一级:ln(qe-qt)=lnqe-K1t
(5)

(6)
式中,qe和qt(mg·g-1)分别是平衡时的吸附容量与t时刻的吸附容量,t是吸附时间,min;K1是一级吸附动力学速率常数,min-1;K2是二级吸附动力学速率常数,g·mg-1·min-1。
图7分别为HAP-APB@CaCO3和改性HAP-APB@CaCO3复合材料对Cu2+吸附的准一级和准二级模型的线性拟合图,根据表3中的动力学参数可知两种吸附剂材料对Cu2+的吸附过程可以用准二级动力学来描述。准二级动力学相关系数更接近1(更大的R2值),并且由准二级动力学模型计算出的qe值与实际测量值更为接近。准二级动力学模型是一种吸附剂吸附速率受化学吸附机理控制,并且这种化学吸附涉及吸附剂与吸附质之间的电子共用和电子转移的模型[28],因此本研究中,两种材料的吸附过程可以很好的用准二级动力学来描述。

表3 准一级和准二级动力学参数
2.5 热力学研究
热力学公式:
△Gθ=△Hθ-T△Sθ
(7)

(8)
式中,△Gθ是标准吉布斯自由能变化,J;△Hθ是标准焓变,J·mol-1;△Sθ是标准熵变,J·mol-1·K-1;T是绝对温度,K;R是气体的一般常数,J·mol-1·K-1;Kc是平衡常数。
利用Van’t Hoff方程研究了吸附材料对Cu2+的吸附过程,结果见图8和表4。根据表4中计算的热力学参数,吸附过程的ΔGθ值均为负,并且随着温度的升高,ΔGθ的值变小,说明升高温度,有利于吸附过程的发生。另外,ΔGθ的值为负,表明发生了自发的物理吸附过程[29]。对于HAP-APB@CaCO3和改性HAP-APB@CaCO3复合材料,ΔHθ和熵ΔSθ都为正值,ΔHθ的正值表明Cu2+在材料上发生的吸附过程是吸热的,ΔSθ的正值反映了吸附材料对Cu2+具有较好的亲和力。
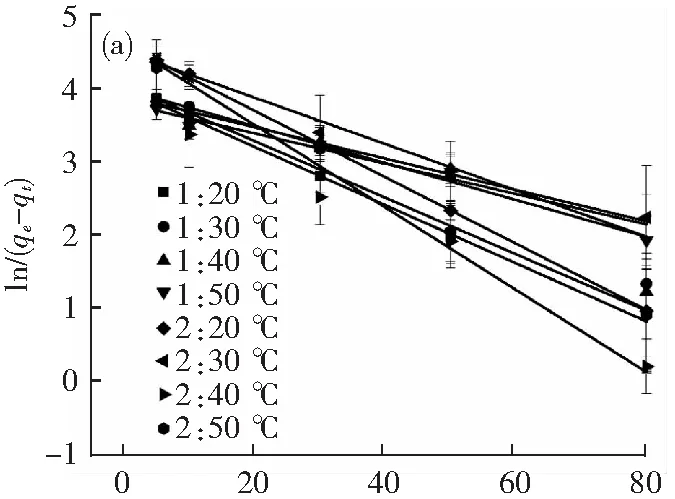
t/min(a) 准一级动力学

表4 吸附热力学参数

1/T/K-1图8 lnKc与1/T之间的线性拟合关系图
3 结论
本文采用共混法,将无水氯化钙和石灰石粉末、磷酸氢二铵混合反应制备得到改性HAP-APB@CaCO3复合材料,通过XRD、FT-IR、BET、SEM等表征技术对材料进行表征,并用于水溶液中Cu2+的吸附研究,结果表明:XRD、FT-IR等表征技术表明复合材料中合成了HAP,并且合成的HAP相良好。BET、SEM等表征技术表明无水氯化钙的加入改善了HAP-APB@CaCO3复合材料的形貌和结构,增大其比表面积。当石灰石粉末、磷酸氢二铵、无水氯化钙三者质量比为25:50:15时,改性HAP-APB@CaCO3复合材料对Cu2+具有最佳吸附效果。
准二级动力学模型能够很好的解释改性HAP-APB@CaCO3复合材料对Cu2+的吸附过程。
无水氯化钙改性的HAP-APB@CaCO3复合材料对Cu2+表现出更大的吸附性能,当pH为5.52,吸附剂用量为0.01g,Cu2+初始浓度为20 mg·L-1,吸附时间为120 min时,HAP-APB@CaCO3和改性HAP-APB@CaCO3复合材料(25:50:15)对Cu2+的吸附量分别为90.90和155.88 mg·g-1。
