敲低干细胞关键转录因子FoxD3对胃癌细胞SGC-7901的影响
2021-07-16刘世光田伶伶史冬梅
刘世光,田伶伶,史冬梅,王 聪,刘 聪
(1.辽阳市中心医院肿瘤内科,辽宁 辽阳 111000;2.辽宁省肿瘤医院肿瘤内科,辽宁 沈阳 110000;3.铁岭市中心医院肿瘤内科,辽宁 铁岭 112000)
胃癌是一种起源于胃黏膜上皮的消化系统恶性肿瘤,发病率居所有恶性肿瘤的第5位[1]。胃癌根据癌灶部位分为胃底贲门癌、胃体癌、胃窦癌等[2]。当前胃癌的治疗方案主要包括手术和化学治疗,但术后辅助化学治疗长期治疗效果并不理想,据报道大约50%的胃癌手术患者肿瘤会复发[3],且不良反应多,耐药率高,中位总生存期不尽如人意[4]。因此,传统的胃癌治疗方案不能满足临床需求,必须探索新的治疗方法。
在胃癌的研究进展中,已经发现了许多与胃癌发生、发展、侵袭和转移有关的蛋白,但却很少被实际应用于临床,因此,加强对功能基因应用的研究将有益于胃癌治疗策略的制定。叉头框蛋白D3(Forkhead box D3,FoxD3)是FOX家族成员之一,具有保持胚胎干细胞多能性,调节肿瘤的增殖、侵袭、血管形成和迁移的作用,且在多种肿瘤中异常表达[5-6]。已有研究表明FoxD3在胃癌组织中高表达,并可能通过Wnt/β-catenin信号促进胃癌的发生发展[7]。但FoxD3在胃癌中的具体作用机制仍不清楚。本文通过干扰FoxD3,探讨其对胃癌细胞SGC-7901生长、运动及上皮间质转化的影响。
1 材料与方法
1.1 试验试剂
RPMI 1640培养基(61870-127)、胎牛血清(10099-141)、胰蛋白酶(15050-057)和青—链霉素(15140-122)均购自美国赛默飞世尔科技公司;永生化胃黏膜上皮细胞系GES和人胃腺癌细胞SGC-7901购自美国典型培养物保藏中心;二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(P0012S)购自上海碧云天生物技术研究所;Transwell(3374)购自美国Corning公司;兔抗FoxD3(ab64807)、Ki67(ab15580)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA,ab18197)、上皮钙黏蛋白(E-cadherin,ab15148)、神经钙黏蛋白(N-cadherin,ab18203)、波形蛋白(Vimentin,ab137321)、β-actin(ab8227)单克隆抗体购自英国Abcam公司。
1.2 细胞培养
将GES细胞和SGC-7901细胞置于37 ℃、5% CO2恒温培养箱中用高糖RPMI 1640培养基(含10%胎牛血清和1%青—链霉素)培养,每3 d更换1次培养基,收集细胞时用0.25%胰蛋白酶消化,试验选用对数生长期细胞。
1.3 细胞处理及分组
设计3条不同的shRNA序列干扰片段(FoxD3-shRNA1、FoxD3-shRNA2和FoxD3-shRNA3)转染至SGC-7901细胞干扰FoxD3表达。通过Western blot和RT-PCR实验选择最佳干扰序列shRNA2进行后续实验。细胞随机分为Control组、shRNA-NC组和FoxD3-shRNA2组。Control组不作处理,shRNA-NC组转染空质粒,FoxD3-shRNA2组转染shRNA2。
1.4 RT-PCR检测相关mRNA表达
用TRIzol法从各组SGC-7901细胞中提取总RNA,于37 ℃、5% CO2恒温培养箱中培养,使用FastKing RT试剂盒通过标准反应进行mRNA的逆转录,使用Fast qPCR Mix进行实时PCR,反应条件为:95 ℃ 2 min,95 ℃ 15 s,55 ℃ 30 s,72 ℃ 15 s。FoxD3-shRNA1 F:5’-AGCAAGCCCAAGAATAGC-3’,R:5’-TC CAGGGTCCAGTAGTTG-3’;FoxD3-shRNA2 F:5’-AGC GCCAGCGATATGTCCG-3’,R:5’-TGCCAGGGCTTGC GGTTGA-3’;FoxD3-shRNA3 F:5’-ACTCTGCCTCTCC CCAATTT-3’,R:5’-CCATCCCCACGGTACTAAGA-3’;β-actin F:5’-GTGGGGCGCCCCAGGCACCA-3’,R:5’-CTTCCTTAATGTCACGCACGATTTC-3’。以β-actin为内参,用2-ΔΔCT方法进行定量计算。
1.5 克隆形成法检测细胞克隆形成率
将SGC-7901细胞接种至6孔板,每孔约500个细胞,培养7 d后弃掉上清液,4%多聚甲醛固定20 min,0.1%结晶紫染色15 min,洗净干燥后于显微镜下观察各组克隆形成数目,计算克隆形成率。细胞克隆形成率(%)=细胞克隆总数/接种细胞数×100%。
1.6 Transwell检测侵袭细胞数
取无血清培养基稀释的人工基底膜,加入Transwell上室,37 ℃风干。取对数生长期的SGC-7901细胞,上室中加入200 μL细胞悬液,下室中加500 μL含血清的RPMI 1640培养基。37 ℃、5% CO2下培养24 h,棉签擦去基质胶和上室细胞,多聚甲醛固定后染色。光学显微镜下计数并拍照,每个样本随机选取5个视野。
1.7 划痕实验检测细胞划痕愈合率
按1.3所述方法分组处理SGC-7901细胞后,将细胞接种于6孔板,当细胞长满约80%时用中枪头垂直于6孔板水平划线,PBS缓冲液清洗3次后,加入无血清的培养基于37 ℃、5% CO2培养箱中培养24 h后取样拍照。划痕愈合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.8 上皮间质转化形态学观察
取各组对数生长期细胞,通过显微镜观察各组细胞上皮间质转化形态学变化。
1.9 Western blot检测相关蛋白表达
各组细胞加入含蛋白酶抑制剂的细胞裂解液提取总蛋白,BCA法测定蛋白含量。SDS-PAGE凝胶电泳分离蛋白转移至PVDF膜。4 ℃下加入FoxD3、Ki67、PCNA、E-cadherin、N-cadherin、Vimentin一抗(1∶1 000)孵育过夜,TBST清洗后加入HRP-IgG(1∶10 000),加入电化学发光显色液显色。以β-actin为内参,Image J V1.8.0.112软件分析各组细胞目的蛋白与β-actin比值。
1.10 统计学分析

2 结果
2.1 FoxD3 mRNA和蛋白表达水平
与GES细胞比较,SGC-7901细胞中FoxD3 mRNA水平升高,差异有统计学意义(P<0.05),见图1a;与Control组比较,FoxD3-shRNA1组、FoxD3-shRNA2组、FoxD3-shRNA3组细胞中FoxD3 mRNA水平均降低,FoxD3-shRNA2组mRNA水平最低,差异有统计学意义(P<0.05),见图1b。选择最佳干扰序列shRNA2进行后续实验,结果显示,与Control组比较,FoxD3-shRNA2组FoxD3蛋白水平降低,差异有统计学意义(P<0.05),见图1c。
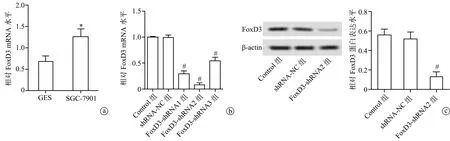
a:RT-PCR检测GES细胞和SGC-7901细胞中FoxD3 mRNA水平;b:RT-PCR检测3个FoxD3 shRNA中FoxD3 mRNA水平;c:Western blot检测FoxD3蛋白表达水平 *:与GES细胞比较,P<0.05;#:与Control组比较,P<0.05
2.2 shRNA-FoxD3抑制SGC-7901细胞增殖
与Control组比较,FoxD3-shRNA2组细胞克隆形成率降低,差异有统计学意义(P<0.05),见图2。
2.3 shRNA-FoxD3下调SGC-7901细胞中Ki67、PCNA蛋白表达水平
与Control组比较,FoxD3-shRNA2组Ki67、PCNA蛋白水平降低,差异有统计学意义(P<0.05),见图3。
2.4 shRNA-FoxD3降低SGC-7901细胞侵袭能力
与Control组比较,FoxD3-shRNA2组侵袭细胞数减少,差异有统计学意义(P<0.05),见图4。
2.5 shRNA-FoxD3抑制SGC-7901细胞迁移
与Control组比较,FoxD3-shRNA2组细胞划痕愈合率降低,差异有统计学意义(P<0.05),见图5。
2.6 shRNA-FoxD3抑制SGC-7901细胞上皮间质转化
Control组及shRNA-NC组细胞呈分散的类圆或纺锤体样,细胞之间黏附力降低,大量细胞由上皮向间质转化,FoxD3-shRNA2组细胞排列紧密,少数细胞呈间质细胞形态,与Control组比较,FoxD3-shRNA2组上皮间质转化受到抑制,见图6。
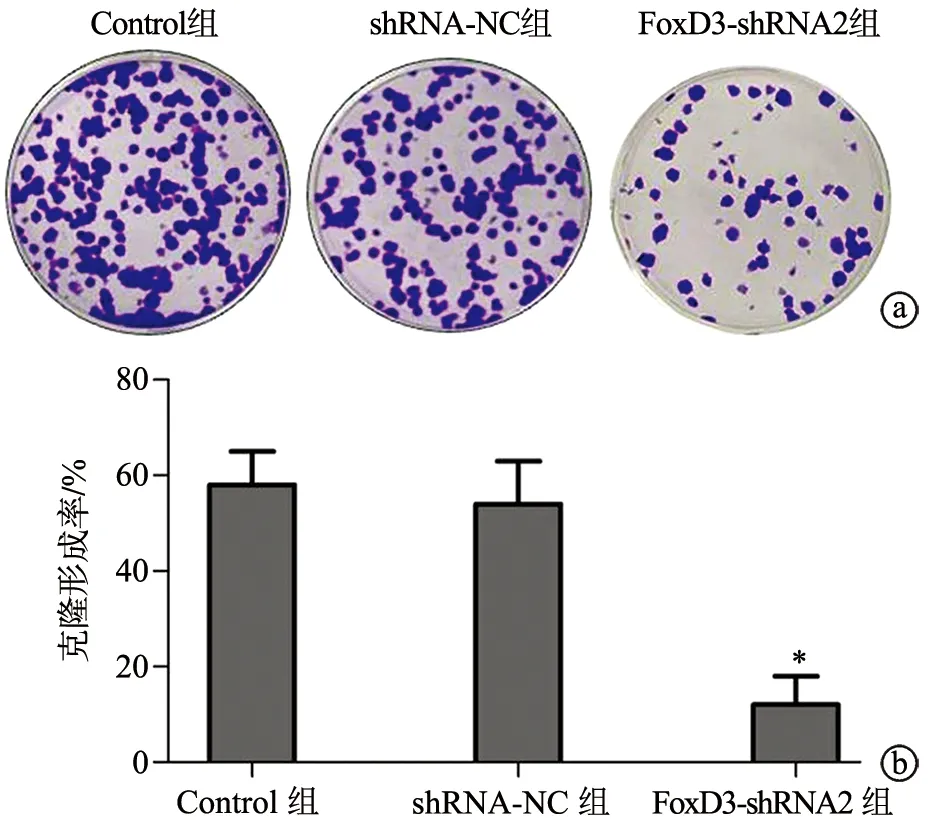
a:克隆形成实验检测各组SGC-7901细胞克隆情况(×200);b:半定量分析各组SGC-7901细胞克隆形成率 *:与Control组比较,P<0.05
2.7 shRNA-FoxD3上调SGC-7901细胞中E-cadherin蛋白表达,下调N-cadherin、Vimentin蛋白表达
与Control组比较,FoxD3-shRNA2组E-cadherin蛋白表达升高,差异有统计学意义(P<0.05);N-cadherin、Vimentin蛋白表达降低,差异有统计学意义(P<0.05),见图7。
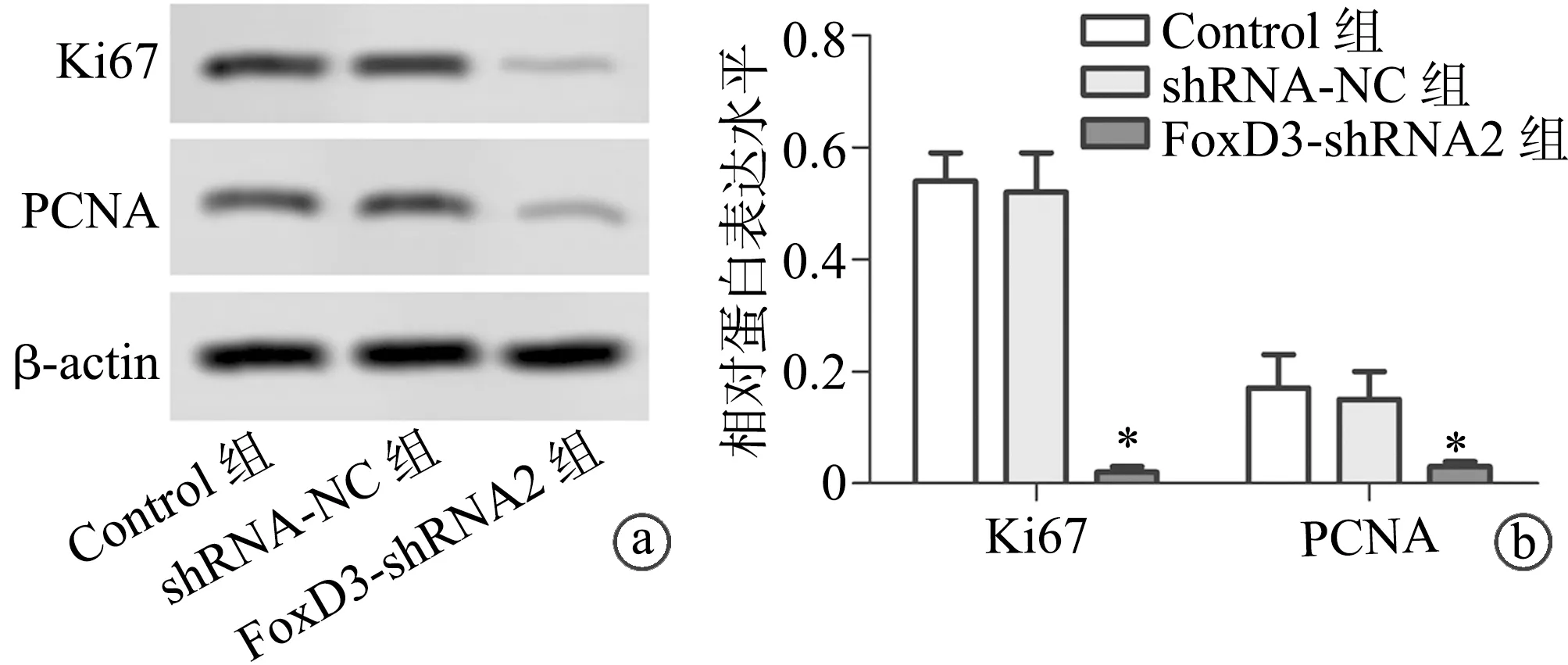
a:Western blot检测各组SGC-7901细胞中Ki67、PCNA蛋白表达;b:半定量分析各组SGC-7901细胞Ki67、PCNA蛋白表达 *:与Control组比较,P<0.05
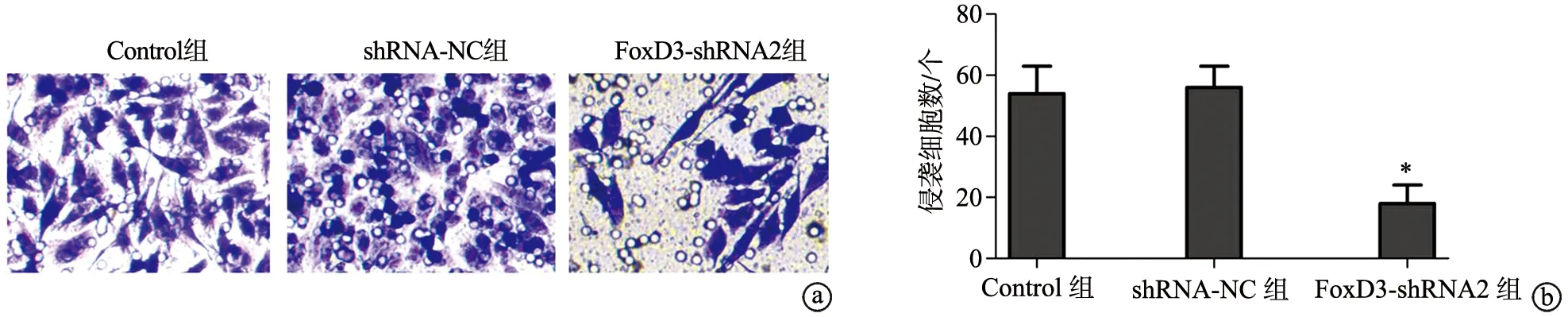
a:Transwell检测各组SGC-7901细胞侵袭细胞数(×200);b:半定量分析各组SGC-7901细胞侵袭细胞数 *:与Control组比较,P<0.05
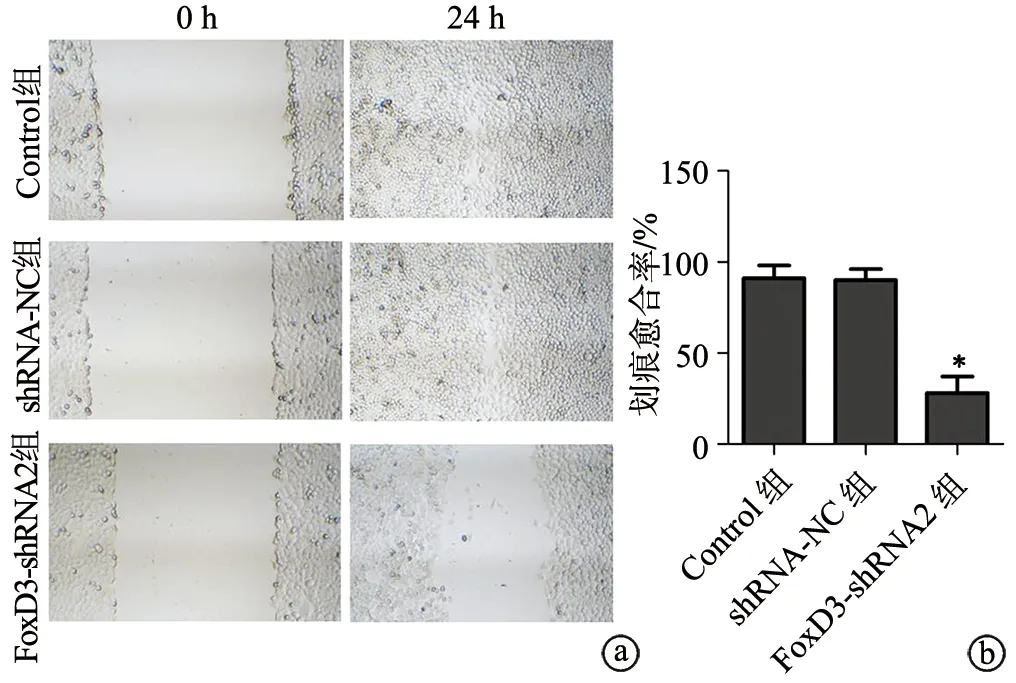
a:划痕实验检测各组SGC-7901细胞迁移(×200);b:半定量分析各组SGC-7901细胞划痕愈合率 *:与Control组比较,P<0.05
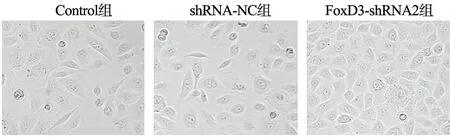
图6 shRNA-FoxD3对SGC-7901细胞上皮间质转化的影响(×200)
3 讨论
胃癌是具有高度侵入性和攻击性的恶性肿瘤,严重威胁人类的生命和健康[8]。寻找胃癌早期诊断及治疗的方案具有重要意义。已有研究表明,FoxD3可预测胃癌患者的预后[9]。FoxD3可能是继CD44v6的另一种特异性胃癌干细胞表面标记物,在胃癌的发生、发展、侵袭、转移、分化、增殖和凋亡中起重要作用[10]。

a:Western blot检测各组SGC-7901细胞中E-cadherin、N-cadherin、Vimentin蛋白表达;b:半定量分析各组SGC-7901细胞中E-cadherin、N-cadherin、Vimentin蛋白表达 *:与Control组比较,P<0.05
胃癌细胞早期就易发生转移,主要是由于胃癌细胞增殖能力极强[11]。抑制胃癌细胞增殖是控制胃癌进展的关键。Ki67是一种增殖细胞核相关抗原,其水平高低可反映细胞的增殖状态,相关研究表明Ki67在胃癌组织中高表达[12]。PCNA是一种与细胞增殖状态有关的核蛋白,随着临床分期增加和淋巴结转移的发生,其表达水平逐渐增高,可反映癌细胞增殖情况及所处细胞周期[13]。本研究Western blot结果显示,转染shRNA-FoxD3载体后,SGC-7901细胞中Ki67、PCNA蛋白表达降低,提示敲低FoxD3表达可抑制SGC-7901细胞增殖。
胃癌细胞的高迁移率致使患者术后易发生局部侵袭甚至转移,这也是造成胃癌患者死亡的直接原因[14]。刘四卫等[5]研究发现,FoxD3过表达可抑制肺癌细胞增殖、迁移和侵袭。朱婧等[15]研究发现,原发性直肠癌组织中FoxD3蛋白表达低于正常组织,且与结肠癌肿瘤的发展及预后相关。本研究通过Transwell和划痕愈合实验发现,转染shRNA-FoxD3载体后,SGC-7901细胞侵袭细胞数和划痕愈合率均降低,提示敲低FoxD3表达可抑制SGC-7901细胞侵袭和迁移。
上皮间质转化是正常上皮细胞转变为间质表型细胞的过程,胃癌细胞的侵袭转移及肿瘤干细胞特性与上皮间质转化过程密切相关[16]。上皮间质转化在胃癌组织和细胞中均表现为上皮细胞标志蛋白E-cadherin表达的降低和间充质细胞标志蛋白N-cadherin、Vimentin的过表达[17]。Benayoun等[18]研究发现,FoxD3可通过介导上皮间质转化及肿瘤干细胞的形成,维持肿瘤干细胞特性及肿瘤耐药。本研究通过Western blot实验发现,转染shRNA-FoxD3载体后,SGC-7901细胞E-cadherin蛋白表达上调,N-cadherin、Vimentin蛋白表达下调,提示敲低FoxD3表达可抑制SGC-7901细胞上皮间质转化。
综上所述,shRNA-FoxD3具有抑制SGC-7901细胞增殖、侵袭、迁移和上皮间质转化的能力。敲低FoxD3表达对防止胃癌的进展具有重要意义。
