上海市主城区生活饮用水中非挥发性有机物的潜在致突变性分析
2021-07-15张慧君陶功华洪新宇马武仁肖萍
张慧君,陶功华,洪新宇,马武仁,肖萍
上海市疾病预防控制中心 a.实验室质量管理处 b.化学品毒性检定所 c.健康危害因素监测与控制所,上海 200336
上海是一个国际化的特大城市,人口数量巨大,生活饮用水的安全性成为备受关注的焦点。青草沙原水系统自2011年投入使用后为上海市主城区中816万浦西居民供应生活用水。有数据表明近年来上海市生活饮用水的状况有逐年好转的迹象,但是反映水质的指标依然有不合格的现象[1],如水源水的耗氧量、消毒剂余量等指标存在超标的情况。水体中耗氧量指标正是反映水体受到有机物污染的重要指标,有机物经过氯化消毒后产生消毒副产物(drinking water disinfection byproducts,DBPs),消毒剂余量过高会造成水体中产生更多DBPs。多项研究表明DBPs 具有致突变性[2-3],长期摄入含有DBPs 的饮用水与膀胱癌等疾病相关,因此生活饮用水中有机物含量是城市饮用水安全性至关重要的指标。
按照GB 5749—2006《生活饮用水卫生标准》对生活饮用水进行评价时,需对微生物指标、毒理指标、化学指标和感官性状等106 项指标进行测定,其中53项为有机物的毒理学指标。对53 项指标逐一测定的过程极为繁琐,运用细菌回复突变试验可直接筛查生活饮用水的致突变性,能简单快捷且较为全面地反映生活饮用水的污染程度[4]。本次研究拟对不同水位、不同环节的上海市主城区生活饮用水进行致突变性测定,为生活饮用水的安全性管理保障提供科学数据。
1 材料与方法
1.1 试验菌株
鼠伤寒沙门氏菌TA98 和TA100 菌株购自美国Molecular Toxicology 公司,产品质量保证证书批号分别为4599D 和4600D,经生物学特性鉴定合格后,日常保存于液氮罐中。生物学特性鉴定包括:组氨酸缺陷型、脂多糖屏障缺损、氨苄青霉素抗性和切除修复缺损。菌株扩增:取冻存菌株复融后使用接种环划线培养制成主平板,从主平板上选取分离性好的单独菌落接种于灭菌肉汤培养基,置于37℃,震荡培养12 h,测定菌液浓度约为(1.1~1.6)×109个·mL-1。
1.2 试验试剂
底层平板和顶层培养基购自上海申启生物科技有限公司,氯化钾和氯化镁购自国药集团化学试剂有限公司,活化代谢系统所使用的S9 混合液购自美国Molecular Toxicology 公司,二甲基亚砜、丙酮、辅酶Ⅱ、6-磷酸葡萄糖、组氨酸、葡萄糖、生物素、氨苄青霉素、4-硝基喹啉-N-氧化物、甲基甲烷磺酸酯和2-氨基芴等试剂购自美国Sigma 公司。
1.3 水样采集和非挥发性有机物的收集
参考全国饮用水水质卫生监测信息系统对饮用水进行分类采集,按照水位高低分为3 个水期,于枯水期(2015年12月—2016年2月)、平水期(2016年3—5月)、丰水期(2016年6—9月)采集水样,水源水为青草沙水库的原水,出厂水由上海市青草沙水库辐射范围内3个水厂的出厂水组成,管网水和末梢水分别由浦西7个区的10个监测点采集的水样组成。每个水期采样1次,采集4种类型水样,每次采集5 L水样。
采用XAD-2 树脂对水样进行富集,水样缓慢通过装有XAD-2树脂的层析柱后,用丙酮进行树脂柱洗脱,洗脱液于60℃水浴条件下,用减压旋转蒸发仪浓缩至丙酮完全挥发,用二甲基亚砜进行定容。
1.4 试验分组
每个水期每种类型(每份)水样均设置3 个剂量组,分别用二甲基亚砜定容,使每0.1 mL 溶液中含有原水样的体积为0.25、0.50、1.00 L。本研究按照所使用菌株的不同,分为TA98 菌株体系和TA100 菌株体系,同时按照使用活化代谢系统的情况进行分组,分别为不加用活化代谢系统的组别(-S9组)和加用活化代谢系统的组别(+S9组)。每个剂量组设3 个平行样,同时设阴性对照、阳性对照和溶剂对照。
1.5 细菌回复突变试验
参照GB 15193.4—2014《食品安全国家标准 细菌回复突变实验》,检测水样的致突变性。
细菌回复突变试验利用组氨酸缺陷型/色氨酸缺陷型菌株无法在缺少组氨酸/色氨酸的培养基上生长的特性,通过观察平皿上菌落形成的数量来判断该水样中是否存在能使缺陷型菌株回复成非缺陷型菌株的物质,以此来判定水样是否具有潜在的致突变性。通过对致突变物质的研究发现某些物质需要在活化代谢后,方可使缺陷型菌株回复成非缺陷型菌株,因此在检测时需在加用和不加用活化代谢系统(S9)的条件下进行。在已知检测方法中基于组氨酸缺陷型鼠伤寒沙门氏菌的检测体系中可分为两种类别,其中TA97、TA98、TA102 菌株可用于检测移码型突变,TA100 和TA1535 菌株可用于检测碱基对置换型突变。根据CJ 3023—1993《活性炭净水器》要求选用TA98 和TA100菌株进行检测,根据GB 15193.4—2014《食品安全国家标准 细菌回复突变实验》,TA98 菌株用于检测移码型突变,TA100菌株用于检测碱基对置换型突变,活化代谢系统(S9)用于确认是否为直接致突变物质。
试验采用平板掺入法,取用无菌试管,加入2 mL顶层琼脂置于45℃水浴中,加入0.1 mL 富集水样和0.1 mL 增菌液,按照是否需要活化代谢,选择加入0.5 mL S9 混合液(S9 体积分数为10%)或二甲基亚砜,混匀后平铺在底层培养基上,固化后倒覆37℃培养48 h 后观察结果进行菌落计数。肉眼观察各平皿的表面是否平整无污染,菌落生长分布是否均匀,同时显微镜下观察背景菌苔的形态是否致密且大小均匀,记录观察值即为该平皿的菌落回变数。
1.6 统计学分析
运用Excel 2007 建立数据库,记录每个平皿的回变菌落数后计算回复突变率(mutation ratio,MR),即试验组回变菌落数/自发回变菌落数,其中阴性对照组的菌落回变数为自发回变菌落数,MR 值可以反映该水样致突变的强度。定量资料采用±s描述。运用SPSS 20 软件对各组别水样的回变菌落数进行分析,同一份水样的回变菌落数采用配对t检验,不同类型和不同水期水样的回变菌落数分别进行单因素方差分析,进一步两两比较采用两独立样本t检验,检验水准α=0.05。采用二倍法则[5]对试验结果进行判定,当任一剂量组的MR ≥2 并呈现剂量-反应关系或具有可重复性,可判定为细菌回复突变试验结果阳性。
2 结果
2.1 不同水期不同水样对TA98菌株的致突变性比较
各组别TA98 菌株的实验结果见表1。不同水期水样处理的TA98 菌株的MR 值差异具有统计学意义(F=6.235,P=0.002);将不同水期的水样两两比较,枯水期和平水期之间MR 值的差异具有统计学意义(t=2.861,P=0.005),枯水期和丰水期之间MR 值的差异具有统计学意义(t=2.646,P=0.009),平水期和丰水期之间MR 值的差异没有统计学意义(t=-0.441,P=0.660)。
表1 各组别TA98菌株的MR值(±s,n=3)Table 1 The mutation ratio of TA98 strains in different groups (±s,n=3)
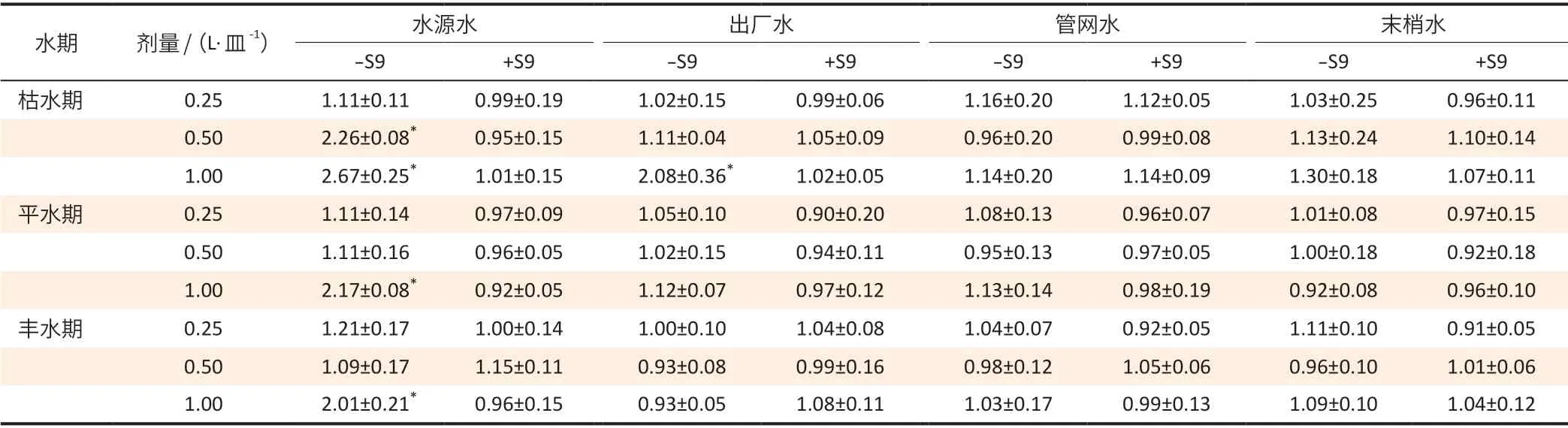
表1 各组别TA98菌株的MR值(±s,n=3)Table 1 The mutation ratio of TA98 strains in different groups (±s,n=3)
[注]*:细菌回复突变试验结果阳性。
水期 剂量/(L·皿-1) 水源水 出厂水 管网水 末梢水-S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9枯水期 0.25 1.11±0.11 0.99±0.19 1.02±0.15 0.99±0.06 1.16±0.20 1.12±0.05 1.03±0.25 0.96±0.11 0.50 2.26±0.08* 0.95±0.15 1.11±0.04 1.05±0.09 0.96±0.20 0.99±0.08 1.13±0.24 1.10±0.14 1.00 2.67±0.25* 1.01±0.15 2.08±0.36* 1.02±0.05 1.14±0.20 1.14±0.09 1.30±0.18 1.07±0.11平水期 0.25 1.11±0.14 0.97±0.09 1.05±0.10 0.90±0.20 1.08±0.13 0.96±0.07 1.01±0.08 0.97±0.15 0.50 1.11±0.16 0.96±0.05 1.02±0.15 0.94±0.11 0.95±0.13 0.97±0.05 1.00±0.18 0.92±0.18 1.00 2.17±0.08* 0.92±0.05 1.12±0.07 0.97±0.12 1.13±0.14 0.98±0.19 0.92±0.08 0.96±0.10丰水期 0.25 1.21±0.17 1.00±0.14 1.00±0.10 1.04±0.08 1.04±0.07 0.92±0.05 1.11±0.10 0.91±0.05 0.50 1.09±0.17 1.15±0.11 0.93±0.08 0.99±0.16 0.98±0.12 1.05±0.06 0.96±0.10 1.01±0.06 1.00 2.01±0.21* 0.96±0.15 0.93±0.05 1.08±0.11 1.03±0.17 0.99±0.13 1.09±0.10 1.04±0.12
不同类型水样处理的TA98 菌株MR 值的差异具有统计学意义(F=9.479,P=0.000);将不同类型的水样进行两两比较,水源水与出厂水之间MR 值的差异具有统计学意义(t=2.893,P=0.005),水源水与管网水之间MR 值的差异具有统计学意义(t=3.612,P<0.001),水源水与末梢水之间MR 值的差异具有统计学意义(t=3.674,P<0.001),其余组别间没有统计学意义。同一份水样TA98 菌株的-S9 组和+S9 组的MR值之间差异具有统计学意义(t=6.380,P<0.001)。
2.2 不同水期不同水样对TA100菌株的致突变性比较
各组别TA100 菌株的实验结果见表2。不同水期TA100 菌株MR 值的差异具有统计学意义(F=43.593,P<0.001)。将不同水期的TA100 菌株MR 值两两比较,枯水期和平水期之间MR 值的差异具有统计学意义(t=2.842,P=0.005),其余组别间差异没有统计学意义。不同类型水样TA100 菌株的MR 值没有统计学意义(F=1.533,P=0.207)。同一份水样TA100 菌株的-S9组和+S9组的MR值之间差异不具有统计学意义。
表2 各组别TA100 菌株的MR值(±s,n=3)Table 2 The mutation ratio of TA100 strains in different groups (±s,n=3)
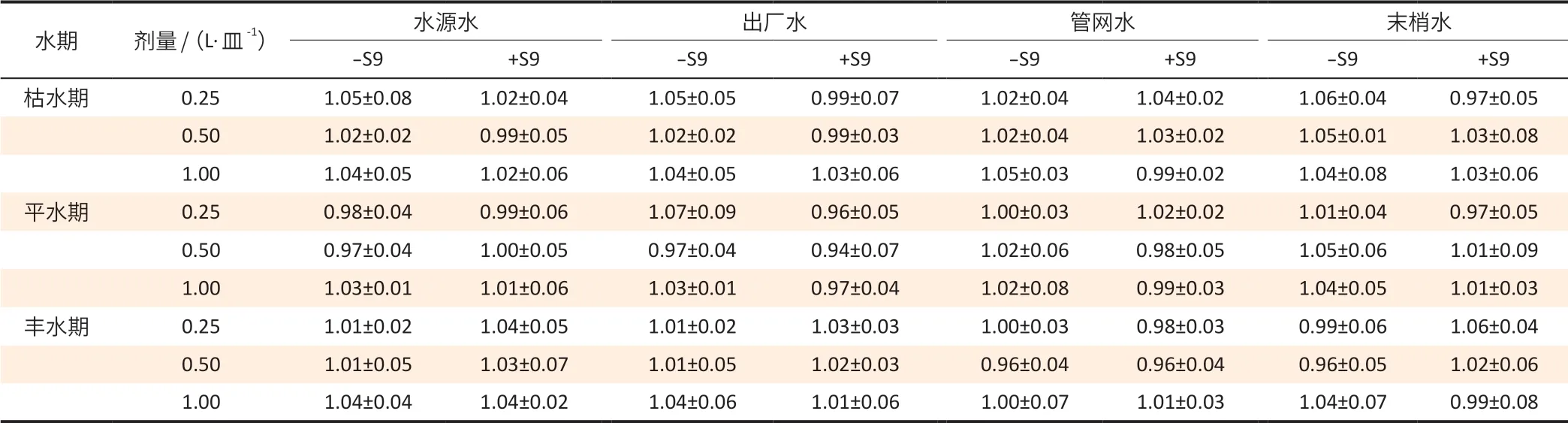
表2 各组别TA100 菌株的MR值(±s,n=3)Table 2 The mutation ratio of TA100 strains in different groups (±s,n=3)
水期 剂量/(L·皿-1) 水源水 出厂水 管网水 末梢水-S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9枯水期 0.25 1.05±0.08 1.02±0.04 1.05±0.05 0.99±0.07 1.02±0.04 1.04±0.02 1.06±0.04 0.97±0.05 0.50 1.02±0.02 0.99±0.05 1.02±0.02 0.99±0.03 1.02±0.04 1.03±0.02 1.05±0.01 1.03±0.08 1.00 1.04±0.05 1.02±0.06 1.04±0.05 1.03±0.06 1.05±0.03 0.99±0.02 1.04±0.08 1.03±0.06平水期 0.25 0.98±0.04 0.99±0.06 1.07±0.09 0.96±0.05 1.00±0.03 1.02±0.02 1.01±0.04 0.97±0.05 0.50 0.97±0.04 1.00±0.05 0.97±0.04 0.94±0.07 1.02±0.06 0.98±0.05 1.05±0.06 1.01±0.09 1.00 1.03±0.01 1.01±0.06 1.03±0.01 0.97±0.04 1.02±0.08 0.99±0.03 1.04±0.05 1.01±0.03丰水期 0.25 1.01±0.02 1.04±0.05 1.01±0.02 1.03±0.03 1.00±0.03 0.98±0.03 0.99±0.06 1.06±0.04 0.50 1.01±0.05 1.03±0.07 1.01±0.05 1.02±0.03 0.96±0.04 0.96±0.04 0.96±0.05 1.02±0.06 1.00 1.04±0.04 1.04±0.02 1.04±0.06 1.01±0.06 1.00±0.07 1.01±0.03 1.04±0.07 0.99±0.08
2.3 水样的致突变性和类型
运用二倍法对各组别的实验结果进行判定,在4 份水样中有五个组别的MR ≥2,根据判定要求,对MR ≥2 的组别进行重复试验,结果与先前一致,可判定为细菌回复突变实验阳性。此4 份阳性结果均为TA98 菌株阳性结果,TA100 菌株没有阳性结果;且均为不加活化代谢系统(-S9)的阳性结果。结果表明水样中的非挥发性有机物是一组可导致移码突变的直接致突变物质。
在4 份出现阳性结果的水样中,3 份为水源水和1 份出厂水,其中枯水期水源水的水样在0.50 L·皿-1和1.00 L·皿-1剂量组均为阳性结果(-S9 的TA98 菌株的MR 为2.26±0.08 和2.67±0.25),其 余3 份 阳 性 的水样分别为1.00 L·皿-1剂量组的平水期水源水水样(-S9 的TA98 菌 株 的MR 为2.17±0.08),1.00 L·皿-1剂量组的丰水期水源水水样(-S9 的TA98 菌株的MR 为2.01±0.21),1.00 L·皿-1剂量组的枯水期出厂水水样(-S9 的TA98 菌株的MR 为2.08±0.36)。二倍法结果表明,3 个水期的水样中枯水期水样的阳性率较高,4 种类型的水样中水源水的阳性率较高。将每份水样中TA98 菌株-S9 MR 值的均值进行分析,可观察致突变性强度MR的变化,见图1。
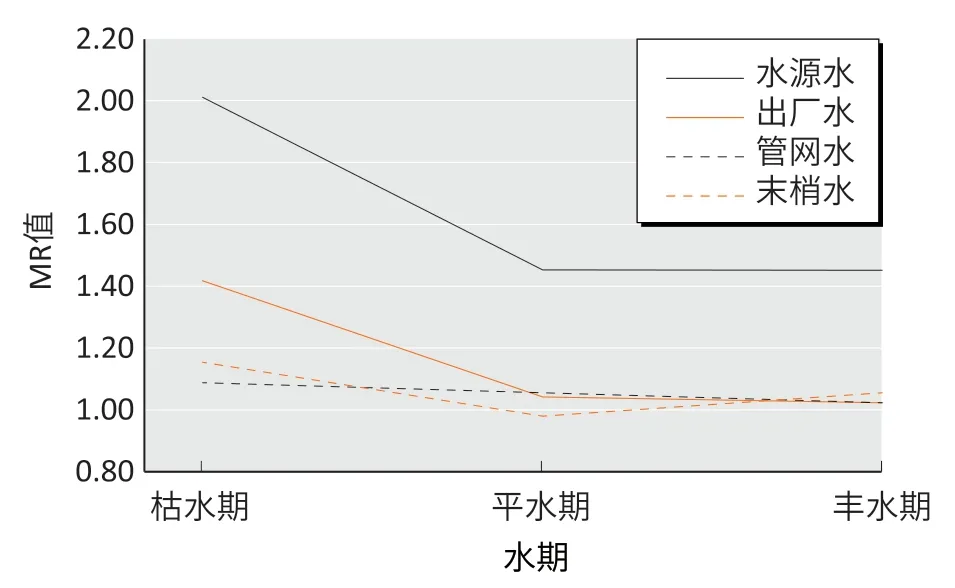
图1 不同水期、类型饮用水的致突变强度Figure 1 The mutagenic intensity of different drinking water types in different water periods
3 讨论
运用二倍法则[5]对实验结果进行判定,本次研究中有4 份水样5 个组别为阳性结果,均为-S9 的TA98菌株阳性,TA100 菌株的组别全部为阴性结果,表明水样中的非挥发性有机物是一类可致移码突变的直接致突变物质。其中枯水期的水源水能在较低剂量出现阳性结果,平水期和丰水期的水源水只在高剂量出现阳性结果,平水期的出厂水也在高剂量组出现阳性结果,其余组别均为阴性结果。
在3 个不同水期分别采集水样,每个时期采集4种类型水样,其中以枯水期的水样的阳性结果为多,4组枯水期的水样中有2种类型具有致突变性(阳性率为50%),平水期和丰水期的水样中各有1 种类型具有致突变性(阳性率为25%),所有阳性结果均为TA98 菌株阳性,枯水期的致突变性最强,平水期和丰水期较弱。不同水期的水样在TA100 菌株的结果均为阴性,经统计学分析发现TA100 菌株虽未达到阳性判定的要求,但是MR 值变化的趋势与TA98 菌株一致。董双谊[6]和许宁等[7]对上海市生活饮用水的调查发现丰水期水质情况好于枯水期,与本次研究结果一致。刘弢等[8]和Xiao 等[9]对长江水系上游城市的生活饮用水的致突变性进行研究,发现平水期的致突变性最高,枯水期次之,丰水期最低,此结果与本次研究不同。上海具有地势低平、水网密布的特点,丰水期有大量河流水资源补给,使水中的有机物浓度有所稀释,在枯水期地表水资源枯竭令水中有机物富集,生活饮用水致突变性与河流补给形成正相关。
本次研究按照生活饮用水的类型分别采集4 种类型的水样,每一种类型采集3 个水期水样。二倍法判定的结果中3 个水期水源水全部为阳性结果(阳性率为100%),3 个水期出厂水中仅有1 个为阳性结果(阳性率为33.3%),管网水和末梢水全部为阴性结果。上海市生活饮用水的水源水具有较强的潜在致突变性,经过水厂处理后的管网水和末梢水的水样不具有致突变性。有学者对南京、湖州、衢州[10-12]等上游城市生活饮用水的致突变性进行研究,发现出厂水具有较高的致突变性,水源水次之,末梢水的致突变性较弱,此结果与本次研究不一致。现阶段我国用于饮用水消毒的方法主要是氯化消毒,水中有机物经氯化消毒后产生的DBPs 具有致突变性[13]。在传统水消毒模式中通过加入过量氯来保证末梢水中余氯浓度,会导致水中DBPs 含量增多进而影响饮用水的安全性[14]。上海自来水厂采用新型的消毒工艺[15],在供水管网中进行二次加氯消毒,通过多点加氯消毒的方式减少水厂中加氯的浓度从而控制出厂水中DBPs 的含量[16],保证经处理后生活用水的安全。
值得关注的是,本次研究发现高剂量组的枯水期出厂水的水样具有致突变性,平水期和丰水期则不具有致突变性。经过调查发现上海的自来水厂采用预氯化的工艺对饮用水进行加氯消毒,氯作为参与三卤甲烷生成反应的反应物之一,加氯量的浓度与三卤甲烷生成量具有相关性。氯与水中的消毒副产物前驱物质的反应是吸热反应,三卤甲烷的反应速率会随水温的升高而加快,故自来水厂在夏季和冬季采用不同的加氯浓度,冬季采用较高的加氯浓度[17],由此导致在冬天的出厂水的水样中致突变物质增多具有较强的致突变性。待气温上升后采集的平水期和丰水期出厂水都不具有致突变性,验证了此工艺带来的区别。此项结果提示在生活饮用水消毒处理工艺的研究上还需进一步验证以确保饮用水的安全性。
综上所述,上海主城区生活饮用水的在枯水期具有较强的致突变性,平水期和丰水期次之;饮用水中的水源水具有较强的潜在致突变性,而居民使用的管网水和末梢水在各个水期所采集的样本都未检测出致突变性。同时值得关注的是采用XAD-2 树脂吸附法,仅能将饮用水中不挥发性的有机污染物进行富集并检测其致突变性,对于饮用水中的挥发性有机污染物无法进行检测,这也是运用细菌回复突变试验反映生活饮用水致突变性的局限性所在。
