环糊精金属有机骨架的制备及应用
2021-07-15陈雨露袁芳
陈雨露,袁芳
(中国农业大学食品科学与营养工程学院,北京 100083)
对营养、健康食品的追求不仅是新时代食品工业的主流趋势,也顺应着“实施健康中国战略”的发展方向。 食品功能因子可以通过激活酶的活性或其它途径调节人的生理机能,但大多数功能因子在水中的溶解度低、自然条件下的理化稳定性差,这些均限制了它们在食品领域的应用[1]。 已证实乳液[2-3]、脂质体[4-5]、纳米聚合颗粒[6-7]等纳米传递可以通过包埋的方法将功能因子与外界环境隔离,从而解决上述难题。 因此,为了扩大功能因子在不同食品体系中的应用,探索与开发新型传递体系是功能因子保护领域的重要研究内容之一。
金属有机骨架(metal-organic frameworks,MOFs)是由有机桥连配体和金属连接点构成的周期性多孔材料,其具有尺寸和孔径分布范围广、结构可控、孔隙率和比表面积大、功能多样等特点[8-9]。 目前大多数金属有机骨架是由有机再生分子和过渡族金属离子合成,其潜在的毒性和不可降解性限制了它们在食品领域的应用。 有研究使用酶[10]、抗体[11]、核酸[12]等生物分子用于MOFs 的合成之中, 但它们主要应用于药物的封装,并且这些材料价格昂贵,不适合工业化生产。
环糊精(cyclodextrin,CD)是直链淀粉在环糊精葡萄糖基转移酶的酶解作用下产生的一类环状糊烃[13],它们由若干个α-D-吡喃葡萄糖通过1,4-糖苷键连接而成,最常见的是α-CD、β-CD 和γ-CD,分别由6、7、8 个α-D-吡喃葡萄糖构成[14]。 基于环糊精独特的结构特征和化学性质,Smaldone 等[15]首次以γ-CD 和KOH为原料制备了天然结构的环糊精金属有机骨架(cyclodextrin-metal-organic frameworks,CD-MOFs)。 CDMOFs 的合成方法简单、原料均为食品级、生成物无有毒试剂残留,是一类绿色、可食用的金属有机骨架,目前已将其应用于药物运输、物质分离、样品制备和物理传感等领域。
尽管CD-MOFs 在食品领域的应用尚处于起步阶段, 但其已经突显出作为食品活性物质传递体系的巨大潜力。 本文综述了关于环糊精金属有机骨架的结构特性、制备方法、在封装活性物质领域的应用及提高其稳定性的研究, 最后对目前环糊精金属有机骨架应用于食品领域所面临的挑战及未来的研究方向进行讨论,以期为今后的研究和应用提供参考。
1 CD-MOFs
1.1 CD-MOFs 的结构
CD 的分子结构及CD-MOFs 的球棍模型见图1。

图1 CD 的分子结构及CD-MOFs 的球棍模型Fig.1 Molecular structure of CD and ball-and-stick model of CD-MOFs
环糊精分子形貌为“截断”的中空锥形,内部深为7.8 Å(1 Å=10-10m)的空腔,分布有亲脂性的亚甲基(-CH2-)和醚键,分子外部表面分布的-OH 朝同一方向排布构成亲水性外壁,因此环糊精分子具有“外亲水、内疏水”的结构特性[16-17]。 α-CD、β-CD 和γ-CD 分子的主平面直径分别如图1a~图1c 所示, 其中γ-CD内外表面均有-OCCO-基团,更易与金属或碱金属离子结合形成络合物[18]。
与β-CD 和α-CD 相比,γ-CD 结构更对称, 因此目前关于γ-CD-MOFs 的研究较多[19]。 环糊精金属有机骨架的种类取决于环糊精的种类(α-CD、β-CD、γ-CD)和金属离子的选择(K+、Ca2+、Rb+、Cs+、Na+)。 不同组合形成的CD-MOFs 的空间结构不同。
α-CD-MOFs 在单斜P 21 空间群中结晶, 也有研究报道称α-CD-MOFs 在正交晶体系统中以P 21 的空间群结晶, 该空间群包含有左旋手性螺旋双通道(图1d)[20]。
β-CD-MOFs 在单斜P 21 空间群中结晶, 相比于γ-CD 分子的对称结构,β-CD 由7 个吡喃葡萄糖单元组成,β-CD 的不对称性使得以其为基础合成的β-CD-MOFs 的晶体结构与γ-CD-MOFs 有显著差异。Lu等[21]以β-CD 和Na+为原料首次合成了β-CD-MOFs,X 射线衍射结果显示β-CD-MOFs 为3D 骨架结构,左旋螺旋通道贯穿骨架之中(图1e)。
γ-CD-MOFs 晶体是具有I 432 空间群的立方结构。 6 个γ-CD 被8 个K+连接形成对称的(γ-CD)6立方体结构单元,其中每个单元中的γ-CD 主平面向内,金属离子与其C6上的-OH 和糖苷上的氧原子配位。8个K+不仅协助(γ-CD)6单元的组建,还参与三维多孔结构的形成。(γ-CD)6单元以立方堆积的形式扩展延伸(图1f)[15]。
1.2 CD-MOFs 的特性
基于CD 分子固有的可食用性、生物可降解性、疏水性空腔和大量羟基的存在,CD-MOFs 迅速成为一种具有生物应用潜力的多孔材料,可通过改变金属离子和环糊精的种类来设计CD-MOFs 的拓扑结构、 稳定性(热稳定性、机械稳定性、化学稳定性等)和孔隙率[22]。当碱金属离子相同,而CD 分子不同时,所制备的CDMOFs 表现出不同的微观形貌和孔隙率。 也有研究表明选用不同金属离子制备的γ-CD-MOFs 也表现出不同的孔径尺寸、 微观形貌以及孔隙率(γ-KCD-MOFs为24.13 Å,γ-NaCD-MOFs 为32.86 Å,γ-FeCD-MOFs为30.19 Å)[23]。根据近几年针对CD-MOFs 结构和性质的研究,表1 总结了CD-MOFs 独特的优良性能。

表1 CD-MOFs 的特性Table 1 Properties of CD-MOFs
1.3 CD-MOFs 的合成
1.3.1 影响因素
在一定温度和气相压力的碱性条件下,少量的环糊精分子便可与碱性金属离子通过配位键结合,并按照一定规律延伸[22]。 根据Lamer 等[24]所述的颗粒生长模型,可将MOFs 的形成分为核的形成、生长和终止3个过程。 MOFs 的合成对外界环境要求较高,晶体结构和尺寸受溶剂比、环境温度、反应时间、尺寸调节剂等因素的影响。
1.3.1.1 溶剂比
一定气相压力的存在可以加速CD-MOFs 的形成,气相压力可通过在密闭容器中添加易挥发性有机试剂获得,可通过调节溶剂比(有机相和水相之比)获得不同的气相压力。 这种方法可缩短合成时间,不需高温即可直接得到结晶粉末,且合成过程中所使用的有机溶剂有不同的官能团、极性、沸点,可以用于调节生成物的结构。 甲醇是最简单的饱和一元醇,沸点低,常用于CD-MOFs 的合成[25]。
1.3.1.2 环境温度
热力学相关的因素是促进晶体成核和生长的主要驱动力,反应物成核和生长需要热能,快速升温可加快MOFs 晶体成核和生长过程之间的转换[26]。此外,向溶剂中添加有机试剂时,CD 的溶解度降低,升高温度可适当提高CD 的溶解度。
1.3.1.3 反应时间
虽然尚未有研究证明CD-MOFs 的成核及生长过程是独立存在的, 但前期研究已证明该MOFs 的合成是通过从有机试剂中析出获得,晶体前体的形成需要能量, 延长加热时间有可能导致更多CD-MOFs 前体的生成,从而得到纳米级别的CD-MOFs[24]。
1.3.1.4 尺寸调节剂
抑制晶体的生长过程也是获得纳米级MOFs 晶体的方法之一, 表面活性剂可通过覆盖在MOFs 前体的表面,影响金属离子和有机物的配位,进而抑制MOFs的生长[27],其中阳离子表面活性剂可作为电荷调节剂或空间填充的模板用于室温(25℃) 和水热条件下MOFs 晶体的合成。 已有研究用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)[28]和聚乙二醇20000(polyethylene glycol, PEG 20000)[29]用于缩小γ-CD-MOFs 的尺寸,可分别将晶体尺寸控制在(4.1±1.3)μm 和100 nm~300 nm。
1.3.2 合成方法
1.3.2.1 慢速蒸发法
溶剂的缓慢蒸发通常在密封环境中并于特定温度下发生,这是制备MOFs 的常规方法,无需任何外部能量供应,且操作简便。 Smaldone 等[15]在室温(25 ℃)条件下用一周的时间合成了直径范围为40 μm~500 μm的γ-CD-MOFs。 为了获得尺寸较小的晶体,Furukawa等[30]通过向水相中加入少量甲醇获得了粒径约为1 μm~10 μm 的γ-CD-MOFs。也有研究以α-CD 和RbOH 为原料,在二异丙基醚蒸汽环境中合成了肉眼可见的针状晶体[31]。但上述方法都存在耗时较长的缺点,不利于工业化过程生产。
1.3.2.2 溶剂热法
溶剂热法是制备MOFs 最常见的方法, 这种方法制备的金属有机骨架的产率较高, 可以精确地控制晶体的尺寸、形状和结晶度,因此这种方法对温度、反应物浓度和环境pH 值的要求极高[22]。 母液中的金属离子和有机分子在高温高压下配位结合, 因此合成过程中环境温度应高于有机溶剂沸点以便于溶剂挥发并提供环境压力[22]。 SHA 等[32]使用该方法以天然β-CD 和Na+/K+为原材料快速制备了β-CD-MOFs。 基于此方法,Liu等[33]以Cs+为金属离子,开发出一种新型的模板诱导法合成了两种螺旋结构的β-CD-MOFs。 去除MOFs 晶体中残留的有机试剂是一个复杂的过程, 可通过真空干燥或用乙醇、甲醇洗涤的方式将其去除。
1.3.2.3 微波合成法
微波照射反应物可以极为明显地加快MOFs 的合成过程,这种方法用于制备纳米级的CD-MOFs。 微波合成法的优点是操作简便、效率高、反应时间短、所获晶体的尺寸较小以及可短时间控制晶体形态等[19,22]。Liu等[29]使用微波合成法探究时间、温度、溶剂比和尺寸调节剂添加量对晶体结晶度和微观形貌的影响,实现了快速制备微米级和纳米级的γ-CD-MOFs。 但是该方法操作复杂、成本较高,在工业化生产中具有一定的局限性。
1.3.2.4 其它方法
尽管溶剂热合成法和微波合成法均可以快速有效地合成CD-MOFs,但晶体生长过程和洗涤过程中需要加入大量甲醇、乙醇、二氯甲烷等有机试剂帮助晶体生长和去除残留有机分子,因此从环境保护和节约资源角度来看,这些方法仍存在一定局限性。 为了快速合成环境友好型的纳米CD-MOFs,近年来研究人员尝试使用种子介导法、超声法和水系合成法制备环糊精金属有机骨架。
在种子介导法中,研究人员使用短链直链淀粉作为晶种,使得γ-CD 和K+在其表面进行组装,该方法通过增加γ-CD 在母液中的有序性、 减少分子聚集而获得(1.8±0.4)μm 的γ-CD-MOFs,且通过介导合成的晶体的热稳定性和结晶度均优于传统制备方法[34];超声法是在种子介导法的基础上,通过增加超声处理制备具有尺寸更小(234 nm ~894 nm)的γ-CD-MOFs,该方法实现了在数分钟内合成纳米级的γ-CD-MOFs,且γ-CD-MOFs 晶体的尺寸随超声时间的增加逐渐减小[35];水系合成法即通过快速降温的手段获得致密的晶体,然后通过加入乙醇将致密晶体分散,最终获得γ-CD-MOFs[36]。
2 CD-MOFs 递送功能成分的研究进展
70%~90%的环糊精应用于食品工业,其疏水性空腔可以容纳水不溶性食品添加剂或功能成分并形成环糊精包合物,环糊精包合物形成的机制可以描述为“客体分子”进入“宿主”之中,其形成的驱动力可能是环糊精分子内部具有高焓值的水分子的释放,也可能是主客体之间氢键、范德华力、疏水相互作用、环张力等多种作用力作用的结果[37]。 将活性成分与环糊精形成包合物,可以提高这类物质的水溶性、稳定性以及生物利用度。
在CD-MOFs 晶体中, 除了CD 分子的内部空腔外,晶体中的多孔结构也可以基于“主-客体”形式对活性物质进行封装。 如果客体分子(活性成分)的大小和形状与CD-MOFs 的孔径大小和形状相匹配, 那么客体分子也可以通过氢键、范德华力、配位键等作用力封装或吸附在CD-MOFs 的多孔框架内部及表面[22,38]。
2.1 功能成分的封装方法
CD-MOFs 在水溶液中的结构不稳定,因此其对活性物质的封装常在有机溶剂中进行。 常见的封装方法有浸渍法、超声法、共结晶法和研磨法等。
2.1.1 浸渍法
浸渍法是CD-MOFs 封装活性物质常用的方法,通常包括3 个步骤:1)首先对合成的CD-MOFs 进行活化,或根据需要对碱性CD-MOFs 进行中性化处理;2)将活性物质溶于乙醇、甲醇等有机试剂后,加入干燥的CD-MOFs 粉末,并在室温(25℃)条件下匀速搅拌或摇晃溶液;3)一段时间后离心去除上清液并收集沉淀。这种封装方法虽然操作简单,但是耗时较长。Yang等[39]使用β-CD-MOFs 封装槲皮素和大黄素,发现48 h 后二者均达到最大包封量;使用β-CD-MOFs[33]和α-CD-MOFs[20]对5-氟尿嘧啶进行封装则分别需要7 d和2.5 d 的时间。
2.1.2 超声法
超声法是在浸渍法的基础上对混合溶液增加超声处理,一方面使混合物均匀分散,另一方面为体系提供能量以加快活性物质与CD-MOFs 的结合。 有研究将200 mg γ-CD-MOFs 粉末加入4 mL 三氯蔗糖乙醇溶液中,通过超声处理使得固体粉末分布均匀并实现高浓度反应物条件下的封装处理[29]。
2.1.3 共结晶法
CD-MOFs 是在碱性条件下合成的,一般需要对合成后的CD-MOFs 进行中性化处理才能用于活性成分的封装, 已有研究证实中性化处理不改变CD-MOFs的结晶度和结构[40]。但对于耐碱性的活性成分,也可在CD-MOFs 合成过程中进入多孔结构中,即共结晶法封装。 共结晶法是一种新兴的活性物质封装方法,Sun等[41]将该方法分为溶剂介导的共结晶、固态共结晶、高通量共结晶三类, 其中溶剂介导的共结晶被应用于CD-MOFs 封装活性物质。
有报道将阿魏酸(ferulic acid,FA)添加进γ-CD 和KOH 的去离子水混合溶液中(摩尔比为γ-CD∶KOH ∶FA=1 ∶8 ∶8), 随后在甲醇蒸汽中孵育14 d, 得到包封有FA 的γ-CD-MOFs。 在上述试验中,荧光显微镜和差示扫描量热分析结果显示部分FA 封装在γ-CD 中,剩余FA 则被封装在γ-CD-MOFs 的多孔结构中[42]。 Li 等[43]通过在5.0 mL 水溶液中混合兰索拉唑(81.3 mmol/L)、γ-CD(0.125 mmol/L)和KOH(200 mmol/L),成功制备出包封有兰索拉唑的γ-CD-MOFs 晶体,与空载的γ-CDMOFs 相比,复合晶体的尺寸、结晶度和微观形貌均无明显变化。 不过Hartlieb 等[44]指出使用β-CD-MOFs 封装布洛芬时,浸渍法优于共结晶法。
2.1.4 研磨法
活性物质也可以通过机械式的研磨进入CDMOFs 中。典型的操作为按照一定化学计量比称取活性物质和CD-MOFs 并溶于有机试剂中,然后在特定温度下研磨一定时间,最后对所得沉淀洗涤、烘干即可得到复合物。 在使用该法进行β-CD-MOFs 封装FA 的研究中,FA 的最佳封装条件为:FA 与β-CD-MOFs 摩尔比3 ∶1、研磨时间1 h、研磨温度40 ℃[41];在阿奇霉素的研磨封装试验中,最佳的制备条件为:摩尔比1 ∶1,封装时间2 h,封装温度40 ℃[45]。
2.2 CD-MOFs 封装功能因子的结构表征手段
对功能因子进行封装之后,为了进一步了解CDMOFs 对功能因子的封装机理, 以便于纠正或改进试验操作, 需要对所形成的复合物进行结构上的表征,常用的表征方法有电子扫描电镜(scanning electron microscope,SEM)、X-射线衍射分析(X-ray diffraction,XRD)、傅立叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)、差示扫描量热(differential scanning calorimetry,DSC)、热重(thermal gravimetric,TG)分析及气体吸附-解吸分析(gas absorption operation)等,表2 总结了各个表征方法的目的[28-36]。
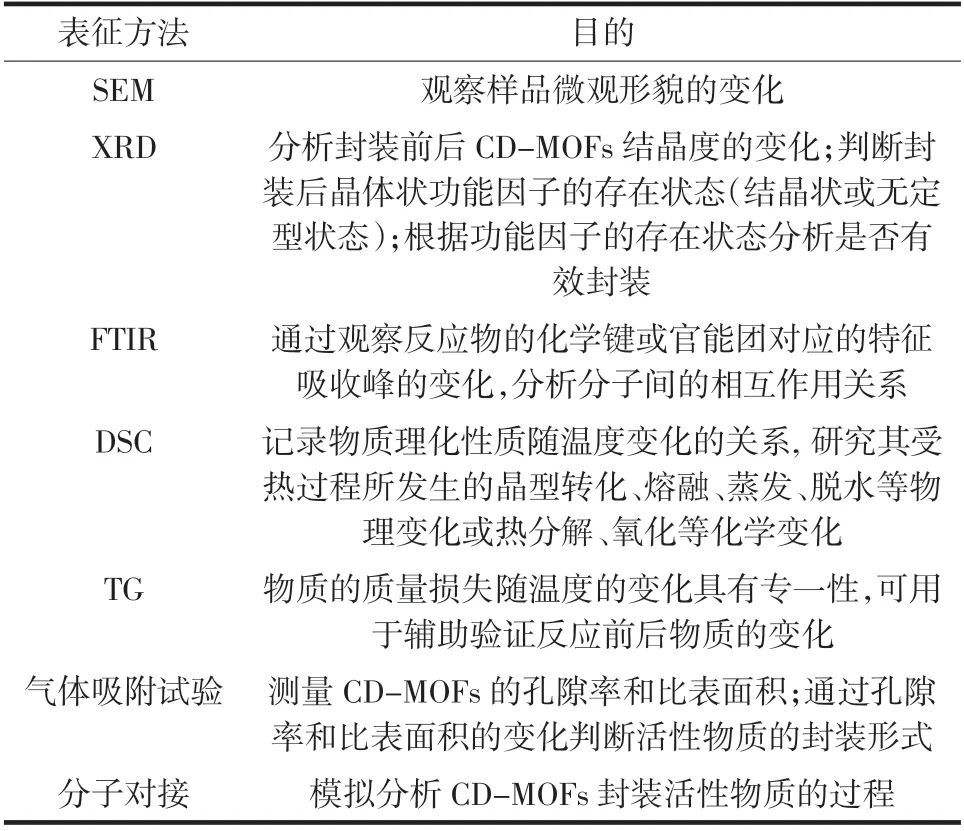
表2 CD-MOFs 的常用表征方法Table 2 Characterization method of CD-MOFs
2.3 CD-MOFs 提高活性物质稳定性及生物利用度的研究
CD-MOFs 封装活性物质的示意图见图2。
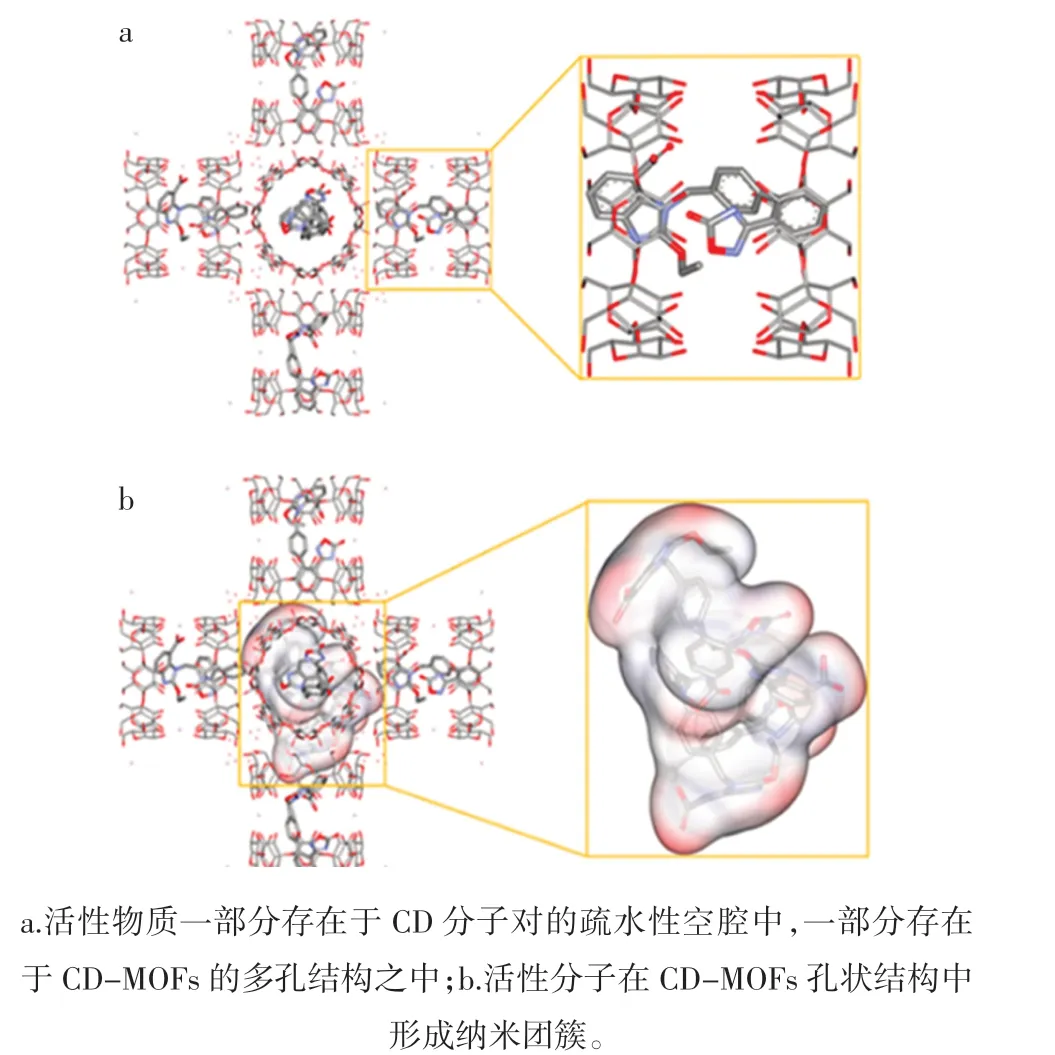
图2 CD-MOFs 封装活性物质的示意图Fig.2 Schematic diagram of CD-MOFs encapsulating active substance
为了直观地揭示活性成分在CD-MOFs 中的存在状态,已有学者使用分子对接技术解释了活性物质在CD-MOFs 中的包封原理, 即部分活性物质存在于CD分子对的疏水性空腔中, 剩余部分存在于CD-MOFs的多孔结构之中(图2a)[46]。 也有研究指出CD-MOFs的高效封装归因于多个活性分子在其孔状结构中形成纳米团簇,这种结构的形成有助于提高活性物质的包封率、溶解度和生物利用度(图2b)[46]。
CD-MOFs 作为宿主的包封目的主要是提高药物的溶解性和稳定性,从而在实际应用中提高生物利用度。 基于上述特殊的封装方式,CD-MOFs 在提高活性物质溶解度、稳定性、包封率和生物利用度方面已取得突出的成果。
2.3.1 提高溶解度
如何提高活性物质的溶解度、拓宽它们在不同食品基质中的应用一直是传递载体研究领域的热点。Moussa 等[47]使用慢速蒸发法制备γ-CD-MOFs,并在甲醇溶液中成功进行姜黄素的封装。FTIR 结果显示二者的结合是由于姜黄素的酚羟基与γ-CD-MOFs 中的羟基形成氢键导致,XRD 结果显示姜黄素的加入没有改变γ-CD-MOFs 的结晶度, 封装后姜黄素在水中的溶解度和稳定性均极大提高,这主要归因于姜黄素在γ-CD-MOFs 的封装。 有报道称经γ-CD-MOFs 封装后,阿齐沙坦的溶解度可提高至原来的340 倍[46]。
Sha 等[48]以5-氟尿嘧啶(5-fluorouracil,5-FU)、水飞蓟素(silymarin,SL)、甲氨蝶呤(methotrexate,MTX)、阿魏酸(ferulic acid, FA)和槲皮素(quercetin, QT)等活性成分为模型鉴定Na-α-CD-MOFs 的封装对活性物质溶解度的影响, 同时以单一α-CD 的封装作为对照组。结果显示Na-α-CD-MOFs 和α-CD 的封装均能有效提高上述活性物质的溶解度,但Na-α-CD-MOFs的提高效果更明显, 且Na-α-CD-MOFs 的负载率为α-CD 的负载率的2 倍~5 倍,结果如表3 所示。

表3 Na-α-CD-MOFs 封装后各个活性物质的负载率和溶解度Table 3 Loading efficiency and solubility of each active substance encapsulated by Na-α-CD-MOFs
2.3.2 提高稳定性
提高活性物质在食品加工、运输、储存过程中的稳定性也是食品工业关注的重要内容。 三氯蔗糖是一种新型蔗糖氯化衍生物产品,也是唯一用蔗糖制作的无热量的高倍甜味剂,但它在高温条件下容易分解为有毒的氯代芳烃,限制了它在热加工产品中的应用。 Lv等[49]用γ-CD-MOFs 包封三氯蔗糖,复合物中的三氯蔗糖热稳定性显著提高,表现为90 ℃时,天然三氯蔗糖1 h 内降解(86.2±0.2)%,而复合物中的三氯蔗糖在24 h 内仅降解了(13.7±0.7)%。 白藜芦醇(resveratrol,Res)作为天然多酚物质,具有抗癌和抗菌活性,但具有生物活性的反式-Res 在可见光照射、 高温和某些pH值条件下易发生异构化或降解反应,Qiu 等[50]使用种子介导法合成γ-CD-MOFs 用于封装Res, 结果显示,Res 在酸性条件下的稳定性显著提高。 段效晖[51]使用K2CO3制备微米级和纳米级的K2CO3-γ-CD-MOFs 用于封装奥美拉唑,发现在高温、高湿和强光照条件下奥美拉唑的稳定性均有改善,表现为在10 d 的单因素稳定性试验中未见明显差异。
2.3.3 提高包封效率
高效的封装是食品传递体系的首要参考标准。 Liu等[29]使用γ-CD-MOFs 封装芬布芬(fenbufen,FBF),首先在30 ℃条件下,将25 mg 的CD-MOFs 加入到50 mL的FBF 溶液(600 μg/mL)中,随后将悬浮液摇动并温育24 h,最后达到了196 mg/g(FBF/CD-MOFs)的包封效率。 Qiu 等[52]以尼罗红作为疏水性活性物质的模型,探究γ-CD-MOFs 的包封能力,结果显示尼罗红与其形成了摩尔比为1∶1 的复合物。
2.3.4 提高生物利用度
陈雨露等[17]采用释放动力学研究α-CD-MOFs 对胸苷酸酶合成抑制药(5-fluorouracil,5-FU)在体外模拟消化中的释放, 结果显示50 min 内5-FU 的释放量达93.9%,直到350 min 时仍残留大量5-FU。 He 等[46]使用USP II 释放仪对γ-CD-MOFs 封装后的阿齐沙坦(azilsartan,AZL)进行体外模拟释放试验,结果显示在pH 6.8 的磷酸盐缓冲液中,90%以上的AZL 在最初30 min 内释放; 在pH 4.5 的乙酸盐缓冲液中,(45.54±3.55)%的AZL 从γ-CD-MOFs 中快速释放; 在pH 1.0的HCl 溶液中实现(29.64±0.55)%的AZL 快速释放。此外, 大鼠口服给药实验显示γ-CD-MOFs 封装后的AZL 的生物利用度约是游离AZL 的9.7 倍、 是γ-CD封装后的1.5 倍。 研究证实辅酶Q10 可高效封装于γ-CD-MOFs 中,在蒸馏水和禁食状态的模拟胃液中,γ-CD-MOFs 中的辅酶Q10 的溶出速率均显著高于游离辅酶Q10[53]。
因此,CD-MOFs 在控制活性物质的释放和提高活性物质生物利用度方面是有效的,这可能归因于CDMOFs 对活性物质的包封同时发生在其内部CD 的疏水性空腔及多孔结构之中。
3 改善CD-MOFs 稳定性的研究进展
CD-MOFs 在传递和保护活性物质、提高活性物质溶解度和生物利用度等方面已初显功效,但对于以水为基质的食品体系来说, 提高CD-MOFs 的水稳定性显得至关重要。 有研究采用胆固醇包覆和交联的方法提高γ-CD-MOFs 的水稳定性[40,51]。前者的试验中将胆固醇包覆于封装有奥美拉唑(omeprazole,OME)的γ-CD-MOFs 表面,发现复合样品不溶于水,能明显改善OME 在酸性条件下的稳定性,且胆固醇的包覆不会影响原复合物在储存条件下的稳定性[51]。 后者则通过加入交联剂制备了不溶于水,且形态、粒径大小几乎没变化的γ-CD-MOFs[40]。
Hartlieb 等[54]采用后修饰法,通过双分子亲核取代反应用氨基官能化CD-MOFs,从而制备出水不溶性的CD-MOFs 用于CO2的吸附。立方凝胶颗粒的制备示意图见图3。
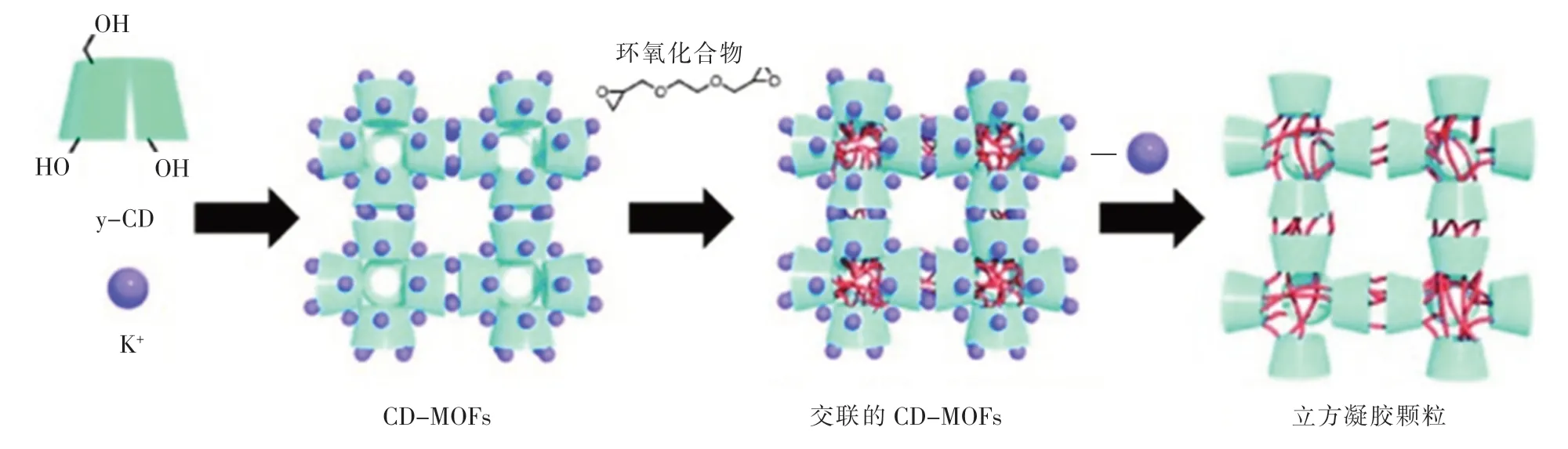
图3 立方凝胶颗粒的制备示意图Fig.3 Schematic illustration of the synthesis of cubic gel particles
如图3 所示,Furekawa 等[30]采用自下而上的方法使用环氧化合物在γ-CD-MOFs 中将γ-CD 分子交联,最后去除配位的金属离子从而得到不溶于水的纳米级或微米级的环糊精立方凝胶颗粒,该立方凝胶颗粒保留了原始γ-CD-MOFs 的形状和尺寸, 为多面体凝胶颗粒的制备提供理论依据。
4 总结
本文总结并讨论了环糊精金属有机骨架的制备及应用,值得关注的是,CD-MOFs 已经在传递和保护活性物质方面崭露头角。 CD-MOFs 的原料可选择性强、来源广、价格低廉,可根据宿主(CD-MOFs)和客体(活性物质)的理化性质和结构特征,选择恰当的封装方式将同一种甚至不同种活性物质封装进入CD-MOFs 中。通过总结过去的研究, 发现与单一CD 分子的封装相比,CD-MOFs 可以更快速高效地封装活性物质,同时起到改善活性物质不良理化性质、溶解度、释放速率和生物利用度的作用。但CD-MOFs 在食品领域的应用尚处于起步阶段,针对今后的研究方向提出如下几点建议:1)在合成方面, 可尝试使用高价态的生物相容性金属离子(Fe3+、Mg2+、Ca2+等)制备CD-MOFs,实现晶体结构和尺寸的可控化制备;2)在活性物质的封装方面,制定出一套合理的匹配方案, 以便于在了解活性物质结构和性质的条件下, 即可快速选择合适的CD-MOFs 种类、封装方法和封装条件;3)开发无毒、简便、高效的方法提高CD-MOFs 在水中的稳定性;4)在理化研究的基础上,探究封装有活性物质的CD-MOFs 对食品体系的质构特性、稳定性和感官特性的影响;5)尝试将CD-MOFs应用于食品保鲜、防腐、检测等领域。
