爱玉子上幼期爱玉子榕小蜂与虫瘿的协同发育
2021-07-15吴婷婷吴文珊陈友铃周莲香
吴婷婷, 吴文珊, 陈友铃,*, 黄 镇, 周莲香
(1. 福建师范大学生命科学学院, 福建省发育与神经生物学重点实验室, 福州 350117;2. 台湾大学生态学与演化生物学研究所, 台北 10617)
爱玉子Ficuspumila.var.awkeotsang雌雄异株,隶属于桑科(Moraceae)榕属Ficus,分布于我国台湾、福建、浙江,分布在海拔800-1 800 m的山地(中国植物志编辑委员会, 1998)。20世纪80年代,经过野生驯化实现了爱玉子立地栽培,现已成为我国南方特有果树,其瘦果含有大量的果胶和果胶酶,可以制成风味独特、清凉消暑的冷饮(林赞标等, 1990; 赖柏全, 2010)。爱玉子榕小蜂Wiebesiasp. nr.pumilae(薜荔榕小蜂Wiebesiapumilae的相近种)属膜翅目(Hymenoptera)榕小蜂科(Agaonida),是爱玉子的专性传粉榕小蜂(江少华, 2011; 吴文珊等, 2013a),没有榕小蜂传粉爱玉子无法结实,没有爱玉子提供瘿花为产卵场所,榕小蜂就无法繁殖后代,榕小蜂与榕树间维持着长期稳定的互利共生关系(林赞标等, 1990; 吴文珊和陈友铃, 2008; 赖柏全, 2010)。榕小蜂幼虫在虫瘿中发育阶段漫长,与榕树互动最为亲密(Jansen-González and Sarmiento, 2008; Jansen-Gonzálezetal., 2012, 2014; Yangetal., 2012; Jiaetal., 2014; Yadav and Borges, 2018),但由于榕小蜂个体小,生活隐蔽,对其幼期发育研究几乎空白。为了解爱玉子榕小蜂与虫瘿之间的互作机制,本研究将探讨:(1)爱玉子榕小蜂与虫瘿协同发育的动态变化;(2)爱玉子榕小蜂在虫瘿内的营养来源及位置变化;(3)爱玉子榕小蜂体长与虫瘿大小的发育相关性;(4)冬、夏季爱玉子榕小蜂发育历期的差异。开辟昆虫-植物互作研究的新视角,为进一步揭示榕树-榕小蜂协同进化的内在机制奠定基础。
1 材料与方法
1.1 供试昆虫
已被产卵的爱玉子雄果采集于福建省泉州市爱玉子种植园,雌、雄株一年均有2次花期。夏季样品采集始于2018年4月10日,选定6棵爱玉子雄株,密切关注榕果发育状态,4月20日对A期未进蜂的榕果进行套袋,防止小蜂和其他昆虫进入榕果内。2018年5月10日通过放蜂获得80个同期被产过卵的进蜂榕果,此后每隔3~4 d采集3个进蜂榕果带回实验室备用,采样每周两次,直至2018年8月20日小蜂全部出飞结束。冬季样品采集时间为2018年8月1日至2019年5月30日,8月15日通过套袋放蜂获得150个同期进蜂果。
1.2 虫瘿和传粉榕小蜂发育的观察和测量
纵向切开榕果,观察虫瘿发育状况,从单个榕果中随机挑取30个虫瘿,在体视显微镜下(Nikon SMZ1500)用游标卡尺测量虫瘿的长径和短径(图1),然后用解剖针对虫瘿进行逐层解剖。使用生物显微镜(Olympus BX51)观察虫瘿结构、爱玉子榕小蜂发育状态及其在虫瘿内的位置,运用景深扩展软件(Image-Pro Plus)和成像系统(SteREO Lumar V12)进行拍照和测量。记录虫瘿上小蜂交配孔和出飞孔的位置。榕小蜂发育历期计算:参考王芳等(2016)的统计方法,以放蜂时间为小蜂发育起点,记录小蜂的发育阶段和日龄,根据日龄表得出各阶段的发育历期。记录实验期间样地每月的平均气温和平均降水量。
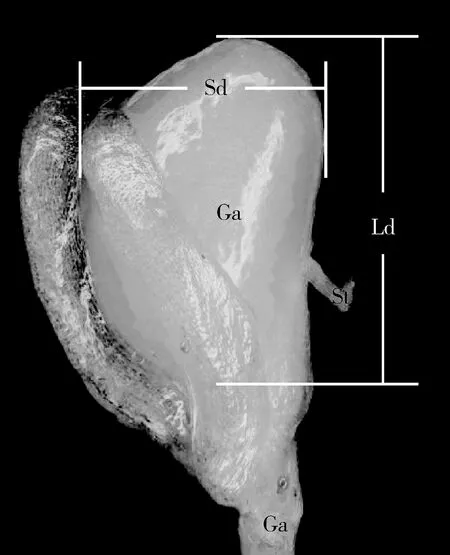
图1 虫瘿形态结构示意图
1.3 虫瘿壳和瘦果果壳的形态结构比较
选取幼虫期各阶段的虫瘿和成熟的瘦果样品进行固定,固定方法参见Jia等(2014),再经临界点干燥后取出,用铜导电胶带粘于样品台上,用离子溅射仪镀膜,放入扫描电子显微镜的样品箱进行观察。
1.4 数据分析
用SPSS17.0和EXCEL2003软件对数据进行统计学分析和作图。
2 结果
2.1 幼期爱玉子榕小蜂与虫瘿协同发育过程
爱玉子榕小蜂的产卵针插入瘿花花柱,产卵于花柱基部子房内珠被与珠心间隙中(图2: A),瘿花花柱被产卵后枯萎(图2: B)。在产卵后的1-3 d(孵化期),珠心组织的细胞迅速膨大,细胞液剧增,使原本紧实的珠心组织快速转化为营养薄壁组织。子房不对称膨大,导致花柱位置下移至侧方,扁圆形的子房转变为长椭球形虫瘿(图2: B),同时,虫瘿柄也快速伸长。
爱玉子榕小蜂发育分为卵期、幼虫期和蛹期,幼虫分为5龄(虫龄划分另文发表),无法分辨雌雄,幼虫虫体呈圆柱形,头端大,尾端小,体表光滑,躯体柔软,具13体节;1龄(图2: C)、2龄(图2: D)幼虫虫体直,3龄(图2: E)、4龄(图2: F)、5龄(图2: G)幼虫虫体弯曲呈“C”型;1-3龄幼虫虫体白色半透明(图2: C, D, E),可看到中肠充满了白色或黄色颗粒,4、5龄幼虫的体壁肌肉组织发达,呈不透明的白色(图2: F, G)。小蜂幼虫停止取食后,排的蛹便,进入预蛹阶段(图2: H)。蛹期分为3个阶段:初期蛹(图2: I, J)、中期蛹(图2: K, L)和成熟蛹(图2: M, N),雌雄蛹异形分化,复眼最早呈现色彩,且雄蛹发育早于雌蛹1.34±0.27 d (n=236)。

图2 幼期爱玉子榕小蜂和虫瘿的发育过程
幼虫期小蜂营养由珠心分化而来的营养层供给。在小蜂1-3龄幼虫期,营养层的细胞壁薄,细胞液含水量高(解剖虫瘿时,由于薄壁细胞被挤压或切割造成细胞液外流,故通常观察到幼虫位于透明的营养层组织液中)。4龄幼虫期虫体与白色半透明粘胶状营养层的颜色和状态十分相似(图2: F),进入5龄幼虫期后营养层越发粘稠,呈半固态啫喱状(图2: G)。电子显微镜下,可见营养层表面存在球状分泌颗粒,其直径在小蜂1-3龄幼虫期约10~50 μm(图3: A),在小蜂4-5龄幼虫期约5-10 μm,且分泌颗粒在泌出后再次堆叠在一起(图3: B),推测可能是由于发育初期营养层的细胞液含水量高,易分泌,故分泌颗粒较大。由此推断,榕小蜂幼虫发育以营养层的分泌物为食。营养层在小蜂发育至5龄幼虫末期(预蛹期)时消失(图2: H),蛹期的小蜂不再摄取食物。

图3 虫瘿和瘦果结构比较
虫瘿壳(图3: C)由表皮层、保护层和内皮层组成(图3: D),虫瘿表皮层由子房壁外层分化而来,幼虫期白色透明,蛹期始颜色逐渐变黄,小蜂羽化时呈褐色。虫瘿内皮层由珠被分化而来,随着卵的孵化,珠心膨大,内皮层变薄并紧贴于保护层。表皮层和内皮层均胶质化,富含水分,为小蜂提供良好的湿度保障。虫瘿保护层由子房壁内层分化而来,由长管状厚壁细胞(图3: E, F)组成,细胞从虫瘿柄端向远柄端延伸,并在汇合处发生折叠(图3: G),因此,两端保护层较厚,中部保护层较薄(图3: C)。在小蜂1-2龄幼虫期,虫瘿保护层厚壁化程度低,虫瘿壳透明(图2: C, D),保护层各个部位的厚度较一致(图3: H);进入3龄幼虫期,保护层细胞厚壁化明显,瘿壳透明度降低(图2: E),3龄幼虫末期虫瘿体积已接近最大值;4龄幼虫期后虫瘿壳呈不透明的米白色。保护层是瘿壳的骨架,主要起保护作用,为小蜂提供相对独立和安全的生存空间,并对非传粉榕小蜂有一定的防御作用。
在电子显微镜下对虫瘿壳(图3: C)和瘦果果壳(图3: I)的形态结构进行比较,结果表明:(1)二者虽然均为长椭圆形,但虫瘿较为浑圆,而瘦果细长;虫瘿长(3.21±0.23 mm,n=30)和宽(1.55±0.06 mm,n=30)均显著大于瘦果的长(2.34±0.09 mm,n=30)和宽(0.89±0.11 mm,n=30);虫瘿长宽比为2.07∶1,瘦果长宽比为2.62∶1,两者存在显著差异(P<0.05)。(2)与瘦果果壳(图3: I)比较,虫瘿壳(图3: C)保护层的厚度显著增厚,尤其在端部约增厚2倍(P<0.05)。(3)营养层功能差异,只有虫瘿营养层具备向榕小蜂幼虫输送营养液的作用。综上可见爱玉子榕小蜂的造瘿作用,既改变了壳的形态,又改变了营养输送功能。
2.2 幼期爱玉子榕小蜂在虫瘿内的位置变化
爱玉子榕小蜂1、2龄幼虫位于花柱基部(图2: C, D),3龄幼虫迁移至虫瘿上侧(图2: E),随着小蜂发育,愈来愈大的虫体由上侧向下扩展(图2: F, G)。1-4龄幼虫能蠕动和翻转,故虫体的头尾和背腹方向随机,但5龄前中期幼虫“C”型虫体的头尾在下(图2: G),而末期5龄幼虫会发生“翻转”,故预蛹头尾在上,且占满整个虫瘿(图2: H)。蛹期中雌蛹的体位均“头尾在上”(100%,n=235)(图2: I, K, M),而雄性蛹的体位多为“头尾在上”(图2: J, L, N),少数“头尾在下”(1.67%,n=120)。
统计结果表明,97%的雌、雄爱玉子榕小蜂的出飞孔和81%的雄峰所打的交配在图中所示位置(图2: M, N,红框所示位置),虫瘿保护层在该位置较薄,便于钻孔,也表明虫瘿内部空间狭小,小蜂活动范围有限,小蜂在化蛹时就已确定好体位,便于羽化出飞。
2.3 爱玉子榕小蜂体长与虫瘿直径的发育动态
爱玉子榕小蜂幼虫在1-4龄期生长速度较快,增长率为25.91 μm/d;5龄期生长较缓慢,增长率为6.26 μm/d;5龄末期幼虫体长增长进入平台期;蛹期小蜂体长略有增加,但增幅不大(图4)。在1-3 龄幼虫期虫瘿快速膨大(1龄幼虫期增幅尤其明显),在小蜂发育至4龄时,虫瘿直径增长进入平台期,即虫瘿发育进入平台期的时间早于小蜂,为小蜂发育提供充足的生长空间。由于虫瘿长径增长较快(长径增长率为短径的1.80倍,长径增长率为26.43 μm/d,短径增长率为14.67 μm/d,卵期的虫瘿为扁球形,随小蜂发育至4龄初期,虫瘿变为长椭球形;虫瘿在小蜂羽化期可能由于虫瘿壳脱水,以及小蜂活动,导致长径稍缩短,而短径稍增长(图4)。

图4 爱玉子榕小蜂体长与爱玉子上虫瘿直径的发育动态
2.4 夏季和冬季爱玉子榕小蜂发育历期比较
在福建地区爱玉子榕小蜂一年2代,世代历期明显不同,夏季世代历期(5月中旬-8月中旬)约112 d,幼虫期约80 d;冬季世代历期(8月中旬-翌年5月中旬)约253 d,幼虫期约192 d。冬季各阶段幼虫的发育历期均比夏季长,尤其是5龄幼虫的发育历期,冬季(91 d)比夏季(25 d)延长了66 d,小蜂以5龄幼虫越冬,延长进食期有利越冬。从图5可知,在气温高、水分充足的夏季,爱玉子榕小蜂发育历期较短;而在气温较低、水分较少的秋冬季,爱玉子榕小蜂发育历期较长。
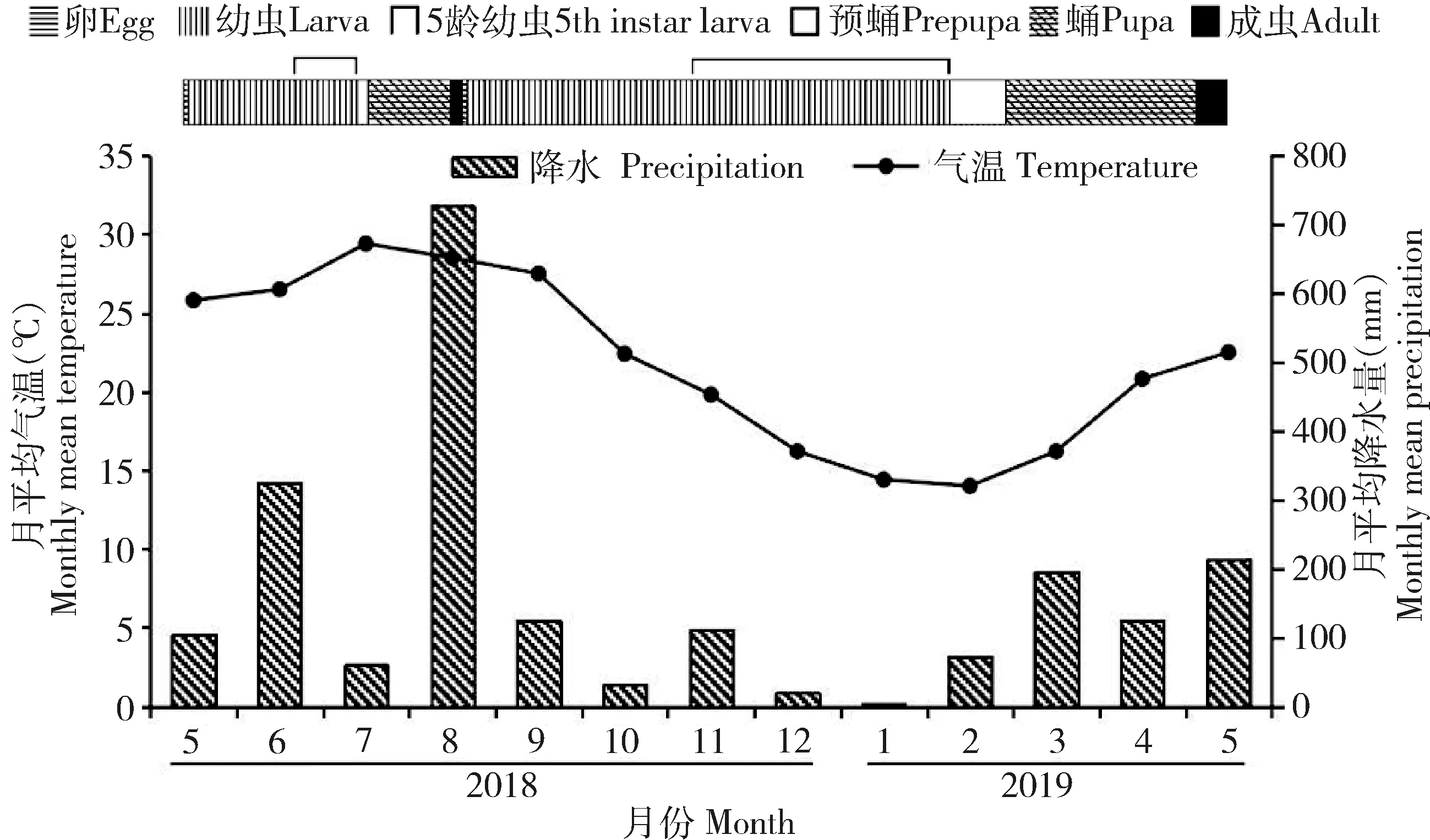
图5 两代爱玉子榕小蜂发育历期及水热条件比较
3 讨论
3.1 榕小蜂幼虫的摄食方式
关于榕小蜂幼虫在榕果虫瘿内的摄食方式,目前没有直接的实验研究结果,均是通过对幼虫期榕小蜂虫瘿显微解剖(Leclerc du Sablon, 1908; 姚若洁, 1998; Jiaetal., 2014)和组织切片的观察结果(Jansen-Gonzálezetal., 2012, 2014)推测榕小蜂幼虫依赖植物胚珠和胚乳组织存活,认为榕小蜂孵化后进入珠心组织中,直接摄食植物组织。但本研究根据对虫瘿结构的电镜观察可知,虫瘿营养层向爱玉子榕小蜂生存的空间分泌球状颗粒,爱玉子榕小蜂位于分泌液中;运用4%多聚甲醛对虫瘿进行固定,其结果也证明爱玉子榕小蜂幼虫与营养层(即早期为珠心组织)一直都处于分离状态。因此,我们推测:(1)榕小蜂孵化后并没有进入珠心组织中,而是依然位于珠心与珠被之间,避免伤害胚珠,让被产卵的瘿花子房仍能完成初期的发育(Verkerke, 1989),同时也避免导致寄主植物产生抗性反应(严盈, 2008)。(2)建群蜂在产卵时将多肽、蛋白质和其他化合物混合组成的产卵分泌物注入寄主植物的组织中(Moreau and Guillot, 2005; Asgari and Rivers, 2011),导致珠心组织的细胞迅速膨大,细胞液剧增,使原本紧实的珠心组织快速转化为柔软营养薄壁组织,为幼虫提供活动空间,虫瘿切片显示孵化后的榕小蜂位于珠心组织中(Jansen-González, 2012),可能仅仅是幼虫与珠心组织相对位置叠加产生的现象。(3)榕小蜂幼虫并不是直接取食植物组织,而是吸食通过建群蜂产卵分泌物(Moreau and Guillot, 2005; Asgari and Rivers, 2011)和幼虫摄食分泌物(Miles, 1999; 严盈等, 2008; 郭瑞等, 2012)刺激植物组织分泌的营养液。
有人认为榕小蜂幼虫从花柱基部迁移至虫瘿上侧(远柄端胚乳所在位置),与小蜂取食胚乳有关(Leclerc du Sablon, 1908; Verkerke, 1989; 姚若洁, 1998; Jansen-Gonzálezetal, 2008, 2012; Jiaetal., 2014),但不以胚乳为食的重寄生肉食性非传粉榕小蜂的幼虫在3龄期也一样移动至远柄端(Galiletal., 1970; Eliasetal., 2012; Jansen-Gonzálezetal., 2014),因此,我们推测小蜂幼虫在虫瘿内的位置变化并非由于幼虫摄食胚乳所致,而是因为榕果的胚珠为斜挂式胚珠,胚囊位于远柄端(Verkerke, 1989),此处空隙较大,小蜂幼虫选择进入结构松散的区域,便于虫体活动。
3.2 影响榕小蜂发育历期的因素
榕小蜂寄生于榕果中,因此寄主榕果发育期是影响小蜂发育历期的首要因素。不同种类的榕树,榕果发育周期明显不同,如爱玉子榕果的发育周期长,一年结实2次,榕果的发育历期3~10月,榕小蜂的发育期与寄主榕果的发育期同步,历期亦长(吴文珊和陈友铃, 2008);细叶榕Ficusmicrocarpa榕果的发育周期短,单株一年结实1~4次,榕果发育历期较短,其榕小蜂的发育期亦短(吴文珊等, 2013b)。在西双版纳,木瓜榕Ficusauriculata间花期约70 d,海南榕Ficushainanensis间花期约40 d,Yang等(2012)交换了木瓜榕和海南榕的传粉榕小蜂之后,发现在木瓜榕中发育的海南榕传粉榕小蜂Ceratosolensp.发育历期增长,而在海南榕榕果中发育的木瓜榕传粉榕小蜂Ceratosolenemarginatusy发育历期缩短,表明寄主榕树的繁殖特性决定小蜂发育历期。
其次,繁殖地的水热条件影响榕果发育历期,从而影响小蜂发育历期。即同一地区的同种榕树在一年中不同的季节榕果发育期不同,小蜂发育历期亦不同。例如,爱玉子榕果的发育期在水热条件较好的夏季为3~4个月,而在秋冬季为8~10个月,其传粉榕小蜂的发育历期与果同步,本实验结果表明,冬季爱玉子榕小蜂发育的各阶段历期均比夏季的长,尤其是5龄幼虫期明显延长,即延长了摄食期以应越冬(图5)。
榕小蜂发育历期还与食物源相关,寄主相同的造瘿蜂、重寄生蜂和寄居蜂,产卵时间不同(通常造瘿蜂先产卵,重寄生蜂和寄居蜂后产卵)但出飞时间相近(Cruaudetal., 2013; Yadav and Borges, 2018),表明植食性造瘿蜂的发育历期较长,而肉食性和植食性兼具的重寄生蜂和寄居蜂发育历期较短,推测同源性食物有利于小蜂对营养成分的吸收。
