“三角度”解析工艺流程题型
2021-07-15黑龙江马德喜
黑龙江 马德喜 李 颖
一、工艺流程题高考考情分析
近两年全国卷、地方卷,及2021年各省新高考适应性考试中,工艺流程题型考查情况统计如表1:

表1
从命题情景素材方面,情境材料来源主要可以分为两类:一是矿石开发利用类,如钛铁矿、铬铁矿、软锰矿、菱镁矿、铁硼矿、铝土矿、磷矿石、白云石、萤石等天然矿石;二是废弃资源回收利用类,如废铁屑、废铝片、废钒催化剂、废玻璃、废旧锂离子电池、废旧锌锰电池、粉煤灰、银铜合金废料等。
涉及知识:环境保护,化学用语,物质间的转化,基本实验操作,电化学应用,速率平衡原理及计算等。
涉及主要元素和高频化合物:情境素材中常考查变价元素、两性元素和陌生元素的单质和化合物,如Fe、Cr、Mn、Cu、V、N、P、Cl、Al、Zn等元素,备考中重点积累相关知识。
试题中的高频化合物,主要可以分为两类:一是原料所含杂质类,如SiO2、Al2O3、FexOy、MgO、MnO2、CaO等。二是外加试剂类,如H2O2、KMnO4、K2Cr2O7、H2C2O4、NaBH4、ZnS、FeS、MnS、NH4HCO3、NaF等。备考中,相关知识也应给予重点关注。
二、解题框架分析新思路——“三角度”
从近几年全国卷以及各地模拟试卷中可知,工艺流程题型已成为高考必考题型,说明该类题型符合《中国高考评价体系》的要求,重能力轻记忆,这种要求因无固定的解题思路使得得分率较低。下面笔者探讨一种解题框架分析新思路——“三角度”法。
解题框架分析思路(三角度):
1.宏观角度(大方向)
①首尾呼应:通过原料与目标产物进行对比,确定有用元素,这种元素在流程中是可以增加的,同时也能确定外来元素及其化合价情况;
②中间受“弃”:确定有用元素的基础上删除其余元素。
2.微观角度(“弃”场)
一般工艺流程题设计思路为原料(矿石或废渣)→粉碎→高温→溶解→除杂(“弃”无用元素)及制备→目标产物(溶液)→目标产物固体。解题时,通常会将难溶性物质转换为自由移动离子,再除去无用离子。
“弃”无用元素或元素改价或制备:工艺流程除杂工序部分为去除多余元素和调整元素的化合价需要通过外加试剂进行除杂和改变化合价。
外加试剂(“七剂”):溶解剂(酸溶或碱溶),氧化剂,还原剂,抑制剂,沉淀剂、调pH剂和核心剂,外加试剂时要注意杂质引入的问题,再结合目标产物中元素价态和外加元素进行相应试剂的选择。
3.设问角度(小方向)
①化学用语、物质间的转化和电化学应用
主要考查陌生化学反应方程式书写,尤其是氧化还原的离子方程式书写。
②基本实验操作
主要考查仪器名称、分离提纯的操作、滴定实验等。
③速率及平衡原理
化学反应速率与化学平衡、水溶液中离子平衡(K、Ka、Kw、Kh、Ksp的应用)。
④环境保护
物质的循环使用,是否产生有害气体。
⑤计算
计算转化率、产率、纯度及方程式有关计算。
三、“三角度”法应用示例
【例1】(2020·全国Ⅰ·26)钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。

图1
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表2所示:

表2
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是________________。
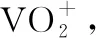
(3)“中和沉淀”中,钒水解并沉淀为V2O5·xH2O,随滤液②可除去金属离子K+、Mg2+、Na+、________,以及部分的________。
(4)“沉淀转溶”中,V2O5·xH2O转化为钒酸盐溶解。滤渣③的主要成分是________。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是________________。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是________________。
【答案】(1)加快酸浸和氧化反应速率(促进氧化完全)

(3)Mn2+Al3+和Fe3+
(4)Fe(OH)3

(6)利用同离子效应,促进NH4VO3尽可能析出完全
【分析】解题框架分析思路(三角度):
宏观角度

图2
确定有用元素为:钒;
无用元素:钾、镁、铝、硅和铁;
外加元素:氮;
价态变化元素:钒
微观角度
设计思路:
原料(矿石)→溶解→除杂(“弃”硅钾镁铝铁氯钠元素)→目标产物固体
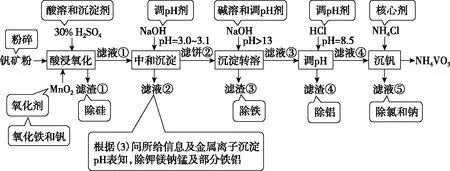
图3

沉淀转溶:滤饼②中加入NaOH溶液调至pH>13时,V2O5·xH2O转化为钒酸盐,Al(OH)3转化为NaAlO2而溶解,则滤渣③的主要成分为Fe(OH)3。
调pH:滤液③中含钒酸盐、偏铝酸钠,加入HCl调至pH=8.5,NaAlO2转化为Al(OH)3沉淀从而除去。
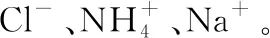
设问角度
1.化学用语、物质间的转化和电化学应用
第(2)(3)(4)(5)问。
2.速率及平衡原理
第(1)(6)问。
【解析】(1)速率:“酸浸氧化”需要加热的原因是温度升高,酸浸和氧化反应加快,并且使浸出和氧化更完全,故答案为加快酸浸和氧化反应速率(促进氧化完全)。
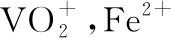
(3)物质间的转化:根据设问提示及金属离子沉淀pH表分析,“中和沉淀”中,钒水解生成沉淀V2O5·xH2O,随滤液②可除去的金属离子有K+、Mg2+、Na+、Mn2+,以及部分的Fe3+、Al3+,故答案为Mn2+,Fe3+、Al3+。
(4)物质间的转化:根据设问提示及金属离子沉淀pH表分析,滤渣③的主要成分是Fe(OH)3,故答案为Fe(OH)3。

四、工艺流程设计模块总结
工艺流程题型宜采取“三角度”法去分析问题,实际解决问题时要注重答题的技巧和细节,大多数问题的解决都有一定的模块化。现将部分答题技巧和模块总结如下:
一般工艺流程题设计思路:
原料(矿石或废渣)→粉碎→高温→溶解→除杂(“弃”无用元素)及制备→目标产物(溶液)→目标产物固体
1.粉碎或研磨:增大固液(或固气或固固)接触面积,加快反应(溶解)速率,增大原料的转化率(或浸取率)。
2.高温(灼烧、焙烧、煅烧):一般是将元素转化为氧化物。
(1)灼烧:不易转化的物质转为容易提取的物质;其他物质转化为氧化物;除去有机物;除去不稳定的杂质。
(2)煅烧:改变结构,使一些物质在后续过程中易溶解,并使一些杂质(如有机物)在高温下氧化、分解。
(3)控制温度范围:确保催化剂的催化效果,兼顾速率和转化率,追求更好地经济效益,防止副反应发生;防止某种物质温度过高时会分解或挥发;为了使某物质达到沸点挥发出来;降温或减压可以减少能源成本,降低对设备的要求,达到绿色化学的要求。
(4)加热的目的:加快反应速率或溶解速率;减少气体生成物的溶解并使其逸出;使平衡向需要的方向移动;趁热过滤,防止某物质降温时因析出而损耗或带入新的杂质;除杂,除去热不稳定的杂质,如NaHCO3、Ca(HCO3)2、KMnO4、I2、NH4Cl等物质;使沸点相对较低的原料气化。
3.溶解:将氧化物转化为盐(一般溶于水),酸溶或碱溶时抑制离子水解。
(1)水浸:与水接触溶解或反应,通过增加水浸时间、搅拌或适当升高温度提高浸出率。
(2)酸浸:溶解、去氧化物(膜)、调节pH促进水解。
(3)碱溶:去油污,去铝片氧化膜,溶解铝、二氧化硅,调节pH促进水解。
4.外加试剂(“七剂”):溶解剂(酸溶或碱溶),氧化剂,还原剂,抑制剂,沉淀剂、调pH剂和核心剂,外加试剂时要注意杂质引入的问题,判断目标产物中元素价态和外加元素进行相应试剂的选择。
(1)溶解剂:利用特殊溶剂把杂质溶解而除去,如Fe(Al)可用过量的NaOH溶液而除去Al,CO2(HCl、H2O)先通过饱和食盐水,再通过浓H2SO4。
常见的氧化剂:Cl2、Br2、HNO3、浓H2SO4、O2、H2O2、KMnO4/H+、ClO-、Fe3+。
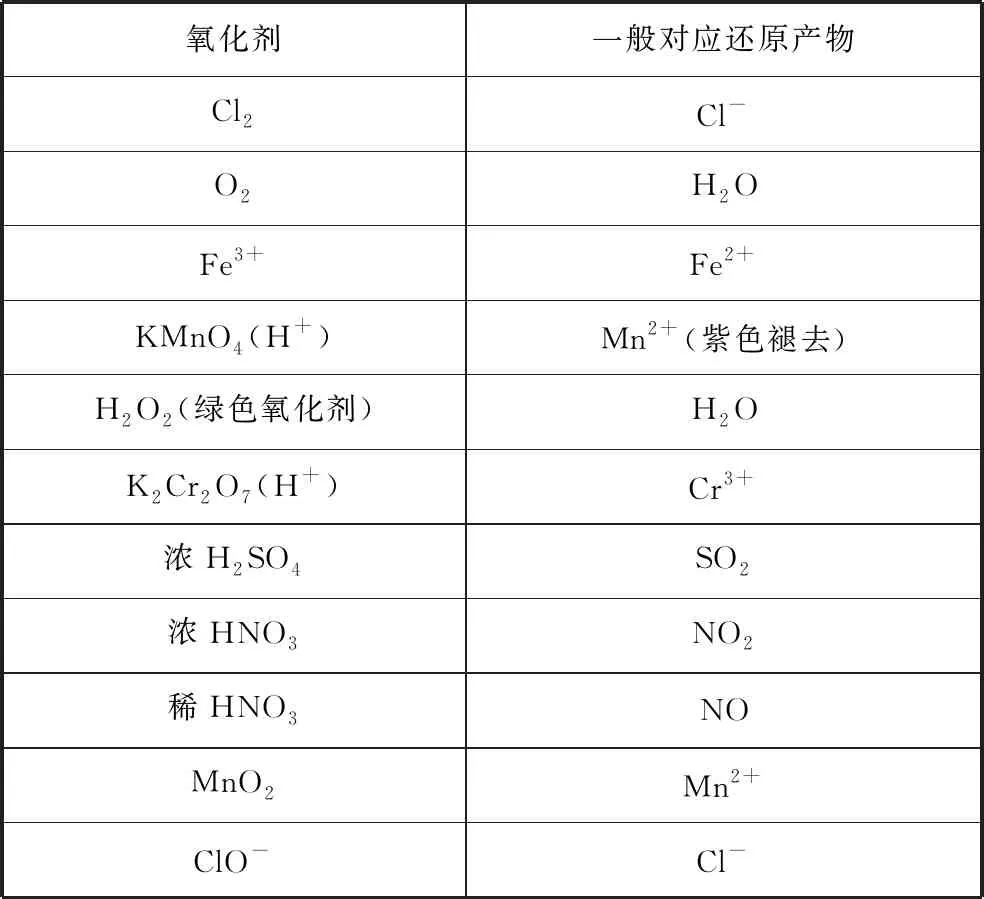
表3
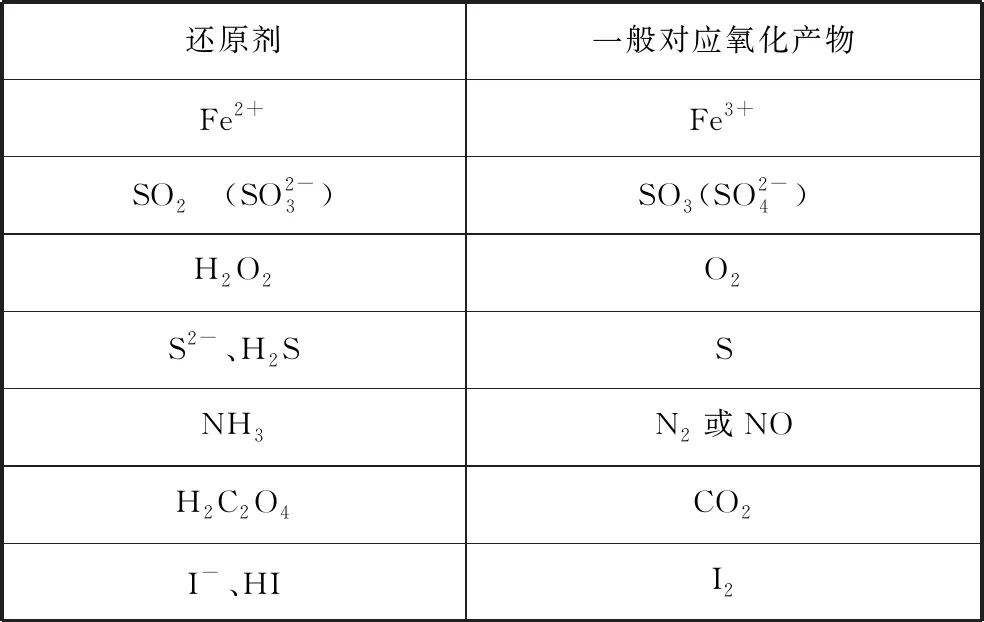
还原剂一般对应氧化产物Fe2+Fe3+SO2 (SO2-3)SO3(SO2-4)H2O2O2S2-、H2SSNH3N2或NOH2C2O4CO2I-、HII2
(3)沉淀剂:①加合适的沉淀剂(要使杂质离子充分沉淀,加入的沉淀剂必须过量,且在后续步骤中易除去)。②调节溶液的酸碱性。
(4)调pH剂:
①控制溶液的酸碱性使某些金属离子形成氢氧化物沉淀,调pH剂的选择一般应满足两点:能与H+反应,使溶液pH增大;不引入新杂质。
②抑制某微粒水解。
5.目标产物(溶液)→目标产物固体:
思路简图
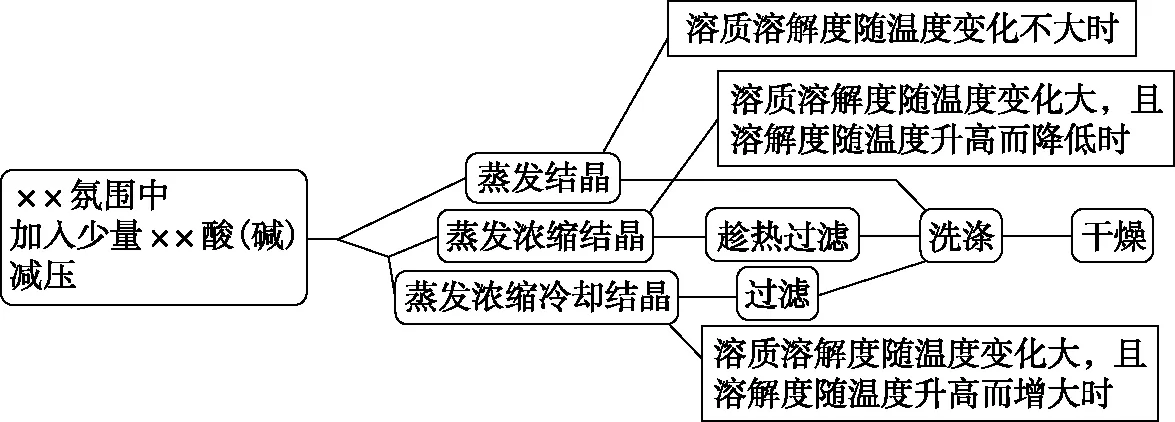
图4
五、工艺流程题答题技巧及规范总结
化工生产流程和综合实验题中经常会出现一些表述性词语,这些表述性词语即为隐性信息,它可以暗示试题的考查角度及方向。通常用到的表述性词语:
(1)“控制较低温度”——从物质的挥发性和不稳定性等考虑。
(2)“加过量试剂”——从反应完全或增大转化率、产率等考虑。
(3)“能否加其他物质”——从引入杂质或影响产物的纯度考虑。
(4)“分离”“提纯”——从过滤、蒸发、萃取、分液和蒸馏等常规操作考虑。
(5)“溶液呈酸性或碱性”——从电离或水解产生的H+或OH-考虑,使溶液呈酸性或碱性。
(6)“利用率”——从经济性或环保性考虑。
(7)“在空气中或在其他气体中”——从O2、H2O、CO2或其他气体是否参与反应或达到防氧化、防水解、防潮解等目的进行考虑。
(8)“判断沉淀是否洗净”——取少量最后一次洗涤液于试管中,向其中滴加某试剂,以检验其中的某种离子。
(9)“检验某物质的设计方案”——取少量液体于试管中,加入另一试剂产生某现象,从而得出结论。
(10)“控制pH”——从防水解、促进生成沉淀或除去杂质等方向考虑。
(11)“用某些有机试剂清洗”——从降低物质溶解度有利于析出、减少损耗和提高利用率等方向考虑。
(12)“控制温度”——可考虑加热加快反应速率或温度过高使物质会分解或挥发。

