饲料锌对长江鲟幼鱼肠道微生物组成的影响
2021-07-15吴金平杨代勤朱建强危起伟
吴金平,杨代勤,杜 浩,罗 江,熊 伟,刘 源,朱建强,危起伟
(1.长江大学农学院,湖北荆州,434025;2.中国水产科学研究院长江水产研究所,农业农村部淡水生物多样性保护重点实验室,武汉, 430223)
锌是动物机体代谢中的一种重要营养素,几乎存在于所有的生物组织中[1]。锌也是鱼类必需的微量元素之一,其作为体内100多种酶的组成成分或激活因子,参与核酸和蛋白质的合成、能量代谢、氧化还原等生化代谢过程;还可以通过调节激素、酶和生长因子的活性及参与骨细胞核酸和蛋白质的代谢进而影响鱼体的骨骼发育[2]。养殖鱼类缺锌会表征出生长抑制、厌食、高死亡率、降低蛋白质与碳水化合物的消化率、降低机体抵抗力与DNA损伤及氧化应激一系列症状[3-8]。近些年,许多养殖鱼类对饲料锌的需要量已有研究,且不同的养殖鱼类对饲料锌的需要量也不一致,如部分草食性鱼类饲料锌需要量为32.6~190.39 mg/kg[2,9-10]、部分杂食性性鱼类饲料锌需要量为32.37~79.51 mg/kg[3,5,11]及部分肉食性鱼类饲料锌需要量为15.0~84.6 mg/kg[4,12-15]。关于养殖鱼类对饲料锌的需要量主要以增重率、锌的蓄积量或其它生化指标作为评判依据。脊椎动物肠道微生物群落是一个复杂的微生态系统,其数目庞大,种类繁杂,包含了各种各样的细菌、真菌、古生菌及病毒[16]。已有研究表明纳米氧化锌离子投喂鲤(Cyprinuscarpio)6周后,处理组的Chao1平均数、Observed OTUs 平均数较对照组升高[17],而饲料锌对鱼类肠道微生物组成的影响还鲜见报道。
动物肠道菌群具有影响和调节宿主肠道的多种功能,包括合成维生素,调节新陈代谢,营养吸收,免疫系统发育及防止病原体定植等[18]。有学者提出调控养殖鱼类肠道菌群是改善养殖鱼类的饲料效率、生长与健康的重要途径之一[19]。Ringø等[20]报道一些鱼类摄取益生元后,可以促进其生长与存活,有益于丰富肠道细菌,提高免疫反应和降低对病原菌的敏感性。基于此,本研究采用16S rRNA高通量测序方法检测分析了三种不同锌处理水平的饲料投喂长江鲟(Acipenserdabryanus)幼鱼8周后,其肠道菌群多样性及菌落结构组成,以期从营养与微生物学的角度探索饲料锌是否对鱼类肠道菌群多样性及菌落结构组成具有调控作用,从而为饲料锌的合理添加提供理论依据。
1 材料和方法
1.1 饲料制作
本实验采用酪蛋白-明胶、糊精与鱼油、豆油作为实验饲料的蛋白源、糖源与脂肪源,其配方与营养成分组成见表1。以ZnSO4·7H2O为锌源,各组锌添加浓度分别为0、40 和320 mg/kg 饲料,经检测各组实测值分别为14.77 mg/kg(A组),57.71 mg/kg(B组) 和364.5 mg/kg(C组)饲料,检测方法参照GB/T(13885-2017),锌的检出限为5 mg/kg。饲料制作前,所有的干物质原料经粉碎机粉碎后,过60目分级筛,按照饲料配方表分别称取不同的原料,混匀。最后加20%左右的纯净水,待充分混匀后,用绞肉机加工制作成直径4 mm的长条圆形颗粒;饲料在室内阴凉风干后置于-20 ℃冰箱保存备用。
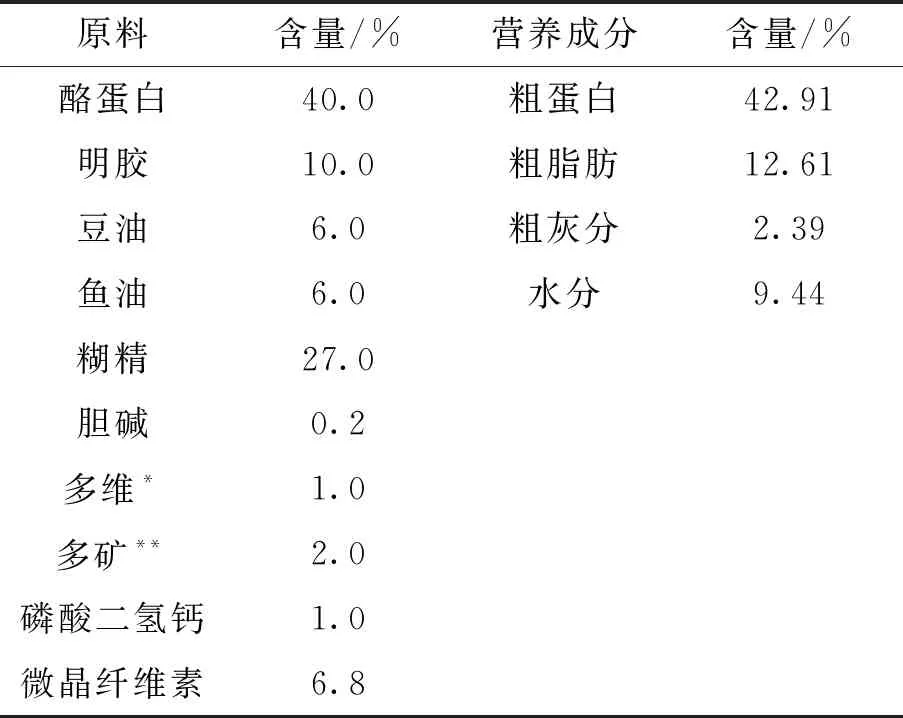
表1 饲料配方组成与营养成分
1.2 实验鱼养殖与样品采集
实验所用的长江鲟幼鱼来源于长江水产研究所太湖试验场当年繁殖的子二代。实验开始前用基础饲料投喂实验鱼2周。正式实验开始前,随机挑选初始体质量为(52.88 ± 0.98)g,规格一致、体质健壮的幼鱼135尾分养于9个直径105 cm,体积0.43 m3的养殖桶中,每个处理组3个重复,每重复15尾鱼,饲养8周。采取表观饱食法投喂,每日投喂3次。饲养期间的水温为18.1~20.8 ℃,溶氧大于5 mg/L,pH为7.90~8.05,氨氮质量浓度小于0.5 mg/L,养殖用水为经过曝气与过滤后的地下井水。每天测量水温与溶氧,每天排污1次,每次排掉养殖桶中水体积的1/3。
养殖实验结束后,每个处理随机取5尾鱼,测量体重、体长与全长(见表2),麻醉,解剖后取出后肠,剥离后肠的粪,液氮速冻后立即置于-80 ℃冰箱保存。

表2 实验鱼的体重与体长(N=5,平均值±标准差)
1.3 样本DNA提取,PCR扩增与高通量测序
将保存好的样品送往武汉迈维代谢生物科技公司进行样品DNA提取、建库和16S rRNA扩增子高通量测序。流程为:利用16S V3-V4变异区引物(515F-806R)对提取样品的DNA进行扩增;对目的条带使用qiagen公司提供的胶回收试剂盒回收产物;使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用NovaSeq6000进行上机测序。
1.4 数据分析
从下机数据中拆分出各样本数据,经截去Barcode和引物序列后使用FLASH[21]对每个样本的reads进行拼接,得到的拼接序列为原始Tags;拼接得到的Raw Tags经过滤处理[22]得到高质量的Tags数据,参照Qiime[23]的Tags质量控制流程操作。经过处理后得到的Tags需要进行去除嵌合体序列的处理,Tags序列通过(https://github.com/torognes/vsearch/)[24]与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到最终的有效数据(Effective Tags)。利用Uparse软件[25]对所有样本的全部 Effective Tags进行聚类,默认以97%的一致性(Identity)将序列聚类成为OTUs(Operational Taxonomic Units),同时选取OTUs的代表性序列。对OTUs序列进行物种注释,用Mothur方法与SILVA132[26]的SSUrRNA数据库[27]进行物种注释分析。使用Qiime软件计算Observed-otus,Chao1,Shannon,Simpson,ace,Goods-coverage,PD_whole_tree 指数。本实验中所有数据采用IBM 22.0统计软件中的单因素方差分析(one-wany ANOVA)和Duncan’s均值多重比较法进行差异显著性分析,P<0.05为差异显著,结果以平均值±标准差表示
2 结果
2.1 饲料锌对长江鲟幼鱼肠道α-多样性的影响
从表3可知,饲料锌对长江鲟幼鱼肠道α-多样性产生了影响,且所有样品的Good_coverage(覆盖率)均在0.995 4以上,表明本次实验中各处理组的样品微生物种类均已检测到。随着饲料锌水平的升高,ACE指数、Chao1指数与Observed species指数出现了下降的趋势,三种指数均在饲料锌364.5 mg/kg时最低,364.5 mg/kg组与14.77 mg/kg组之间差异显著,与57.71 mg/kg组之间无显著差异。香浓指数、辛普森指数与PD-whole tree值也表现出随饲料锌水平的升高而出现下降的趋势,且三种指数均在364.5 mg/kg时最低,但各组之间无显著性差异。

表3 饲料锌对长江鲟幼鱼肠道α-多样性的影响
2.2 饲料锌对长江鲟幼鱼肠道菌群群落结构组成的影响
从图1可以发现,在科水平下, A、B、C处理组梭杆菌科分别占到了37.55%、32.44%、42.63%,表明饲料中锌含量达到364.5mg/kg时,长江鲟幼鱼后肠的梭杆菌科的相对丰度最高。肠杆菌科分别占到了11.24%、41.56%、36.93%,表明饲料中锌含量达到57.71 mg/kg时,长江鲟幼鱼后肠的肠杆菌科的相对丰度最高。随饲料锌水平的升高,梭菌科类的百分比出现了下降的趋势,发现14.77 mg/kg组的百分比值最高为32.03%,而B、C处理组中分别占到了18.90%、13.80%。上述3个科在A、B、C 3个处理组中分别占80.82%、92.89%、93.37%,表明在不同锌饲料处理水平下,上述3个科在鱼类肠道菌群的组成中占据了优势。同样发现,希万氏菌科在A、B、C 3个处理组中分别占2.04%,0.21%,0.62%,且随着饲料锌水平的增加而出现降低的趋势。而相对丰度不在前10的科中,其他的科在A、B、C 3个组分别占9.15%,3.86%,5.21%。综上可知,饲料中锌含量不同对细菌科的组成有影响。
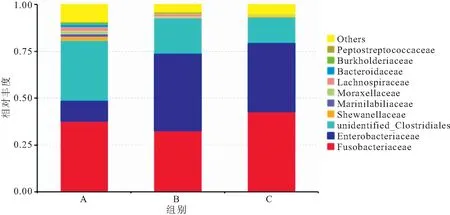
图1 科水平下不同处理组长江鲟幼鱼肠道菌群组成的相对丰度
从图2可以发现,在属水平下,A、B、C处理组鲸杆菌属分别占到了31.28%、27.57%,35.71%;梭菌属类分别占到了36.87%,18.55%,14.05%;邻单胞菌属分别占到了8.76%,33.60%,18.92%;柠檬酸杆菌属分别占到了1.42%,1.84%,20.60%;上述4种细菌属总和百分比分别达78.32%,81.56%,89.28%,表明这4种细菌属是优势属。在前10种细菌属之外的属中,A、B、C 3个处理组,分别占到了14.28%,14.44%,8.96%,上述结果表明饲料中锌含量的不同也会对细菌属的比例组成产生显著影响。
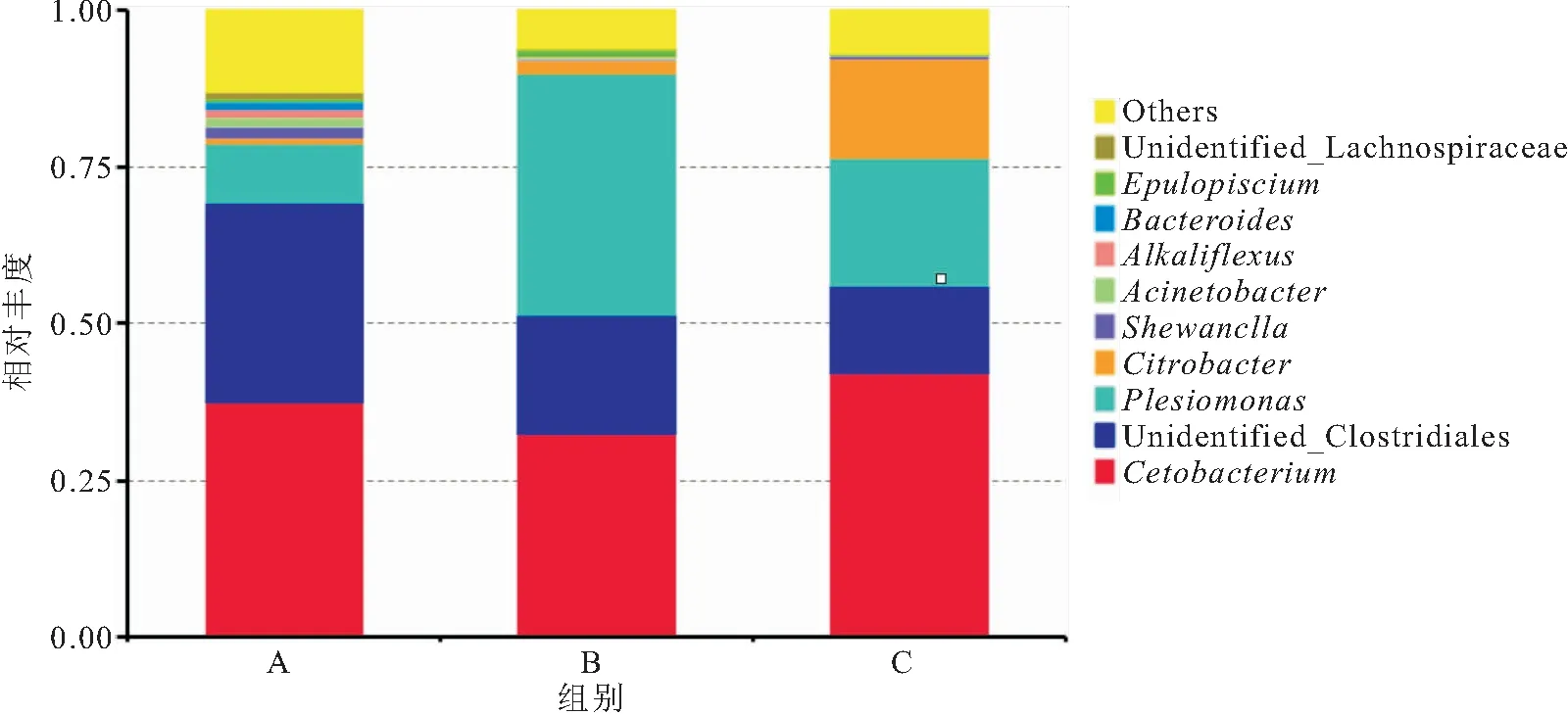
图2 属水平下不同处理组长江鲟幼鱼肠道菌群组成的相对丰度
2.3 饲料锌对长江鲟幼鱼肠道OTU数量的影响
从图3可知,不同锌处理下的饲料对长江鲟幼鱼肠道OTU数量产生了显著影响。A、B、C处理组中总OTU数量随饲料锌含量的上升出现降低的趋势。其中,A、B、C 3个处理组中总OTU数分别为1 160,790,654。A与B组共有的OUT数为622;B与C组共有的OUT数为400;A与C组共有的OUT数为510;A、B、C 3个处理组共有的OUT数为371。
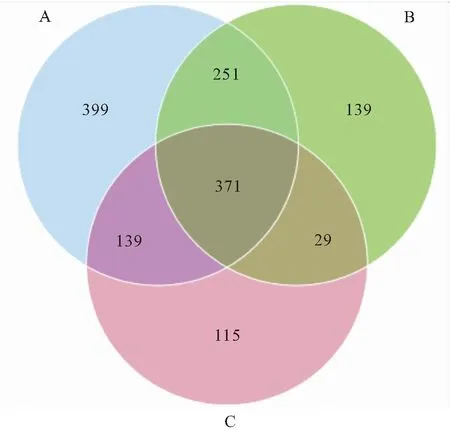
图3 不同锌饲料处理下的OTU分布
3 讨论
鱼体肠道微生物对鱼的大小、代谢、摄食行为及免疫反应都有影响[28];同时肠道菌群对肠道形态、营养吸收及代谢机制有着重要影响,有益菌与有害菌的动态平衡及正常分布与否是保证宿主能否健康生长的重要基础[29]。因此,维持鱼体健康的肠道菌群,对于养殖鱼类的健康生长有着重要的意义。Alpha多样性用于分析样本内(Within-community)的微生物群落多样性[30],通过单样本的Alpha 多样性分析可以反映样本内的微生物群落的丰富度和多样性。本实验结果表明不同锌含量的饲料对长江鲟幼鱼肠道菌群的ACE、Chao1与Observed species 指数均产生了显著影响,3种指数均表现出随饲料锌含量的增加而出现下降的趋势,且低剂量与高剂量锌处理组差异显著,这表明肠道菌群的丰富度受到饲料锌含量的影响,特别是饲料高剂量锌组的肠道菌群丰富度明显下降,表明饲料锌含量过高不利于鱼类肠道健康,与Chuapani等[17]报道纳米氧化锌离子投喂鲤6周后处理组的Chao1平均数、Observed OTUs 平均数较对照组升高的研究结果不一致,上述实验结果不一致可能与处理物质的类型及浓度、实验对象的种类与规格、实验持续时间、养殖环境与营养条件等是否一致而密切有关。鲟鱼营养研究发现,不同的鲟类摄食相同的饲料,其肠道菌群的丰富度与多样性也是不一致的[31],表明了每种特定的鱼类可能有着独有的肠道微生物组成结构。本次实验中,Shannon、Simpson与PD-whole tree等指数的趋势均是降低的,但与对照组相比差异不明显,表明本次实验中饲料锌含量还不足以对上述3种肠道菌群的多样性指数产生显著性影响。
测序结果显示,在科水平上排名前10的梭杆菌科、肠杆菌科与梭菌科3个科的总和百分比在不同锌含量的饲料组分别达到了80.82%、92.89%、93.37%,表明不同锌处理水平下肠道核心的菌落种群结构并未发生大的变化。阮瑞等[32]对人工养殖达氏鳇(Husodauricus)幼鱼肠道菌群组成进行了分析,发现梭菌科占科分类中的98.137%,同时也发现了少量的梭杆菌科与肠杆菌科。Geraylou等[19]在关于西伯利亚鲟(Acipenserbaerii)投喂阿拉伯木聚糖寡糖实验中也发现了梭杆菌科与梭菌科,并且发现鱼摄食含阿拉伯木聚糖寡糖的饲料后梭杆菌科的丰度是降低的,而梭菌科的丰度是上升的,这些结果表明梭杆菌科、肠杆菌科与梭菌科是鲟鱼肠道菌落中比较重要的科之一,其百分占比可能因饲料营养与养殖环境不同而表现出异同性。进一步在属水平上分析发现,鲸杆菌属、梭菌属类、邻单胞菌属与柠檬酸杆菌属等4种细菌属总和百分比分别达78.32%,81.56%,89.28%,表明这4种细菌属可能是优势属。Han等[33]报道的鲸杆菌属是肉食性鱼类主要的属之一,本实验结果与之相符;同时有研究表明,属的水平上草食性鱼类肠道中主要以具有降解纤维素功能的梭菌属、柠檬酸杆菌属和纤毛菌属(Leptotrichia)为主[33],本研究中梭菌属与柠檬酸杆菌属也是长江鲟幼鱼肠道菌优势属之一,这主要与鲟鱼是一种杂食偏肉食的食性而密切有关。在前10种细菌属之外的属中,3个处理组分别占到了14.28%,14.44%,8.96%,表明了饲料中锌达到一定水平时(364.5 mg/kg)会影响肠道菌群的组成结构。另外通过venn图发现不同锌处理下的饲料对长江鲟幼鱼肠道OTU数量产生了影响,随饲料锌含量的增加,长江鲟幼鱼肠道OTU数量从1 160下降到654;而三种饲料锌处理下三个组共有的OTU数为371个,占三者总和的25.71%,这表明在相同养殖环境下,长江鲟幼鱼后肠肠道菌群的相似性受饲料锌处理的影响比较大;这与水晓梅等[34]报道的大豆浓缩蛋白对大黄鱼生长和肠道微生物菌落的影响中大豆浓缩蛋白替代鱼粉为0%、25%与100%时三者共有的OTU数为64个,占三者总数的68.08%的结果不一致。
