大鲵虹彩病毒病灭活疫苗安全性与免疫效力研究
2021-07-15索钰杰李逸群范玉顶刘文枝薛明洋曾令兵
索钰杰,林 格,江 南,李逸群,范玉顶 ,刘文枝,孟 彦,薛明洋,曾令兵,周 勇
(1.中国水产科学研究院长江水产研究所,武汉 430223;2.华中农业大学水产学院,武汉 430070)
大鲵(Andriasdavidianus)俗称“娃娃鱼”,隶属有尾目(Caudata)隐鳃鲵科(Cryptobranchidae)大鲵属(Andrias),是世界上现存最大的两栖动物,具有很高的科研与营养价值[1-2]。随着大鲵养殖技术的日趋成熟、规模的持续扩大、集约化程度的不断提高,大鲵养殖过程中的病害问题日益突出[3-4]。其中,由大鲵虹彩病毒(Giant salamander iridovirus,GSIV)引起的大鲵病毒性疾病危害最为严重,死亡率最高达100%,给大鲵养殖业造成了巨大的经济损失[5]。
疫苗免疫被认为是预防大鲵虹彩病毒病发生的最有效途径[6-9]。曾宪辉等[6]以GSIV的主衣壳蛋白(major capsid protein,MCP)为靶点构建的DNA疫苗,在免疫后28 d仍可从大鲵的肌肉、肝、脾和肾组织中检出MCP基因,该DNA疫苗的相对免疫保护率为73.3%。Zhou等[7]根据酵母密码子偏好性优化GSIV MCP基因序列后,利用酵母表达了MCP蛋白,将蛋白纯化后免疫大鲵,其相对保护率可达78.0%。Liu等[8]使用1.0×106TCID50/mL的剂量灭活疫苗免疫大鲵,其相对免疫保护效力为72.0%,证明了灭活疫苗也有较好的免疫保护效果。孙建滨等[9]用β-丙内酯灭活病毒制备了大鲵虹彩病毒灭活疫苗,明确了灭活的最适条件为0.1%的β-丙内酯于4 ℃灭活细胞培养的GSIV 72 h。虽然已有多种疫苗被证实能有效的预防大鲵虹彩病毒病,但由于疫苗的安全性和免疫效力研究不完善,制约了上述疫苗的产业化与推广,因此未能从根本上解决大鲵虹彩病毒病对大鲵养殖业的影响。
本研究以大鲵虹彩病毒灭活疫苗为对象,探究疫苗的不同免疫剂量、免疫时间、免疫次数对大鲵的安全性以及免疫后大鲵体内相关免疫基因的表达特征、血清中和抗体滴度与免疫保护效果,以期为大鲵虹彩病毒病灭活疫苗的产业化推广提供有效的技术支撑。
1 材料与方法
1.1 实验大鲵
大鲵来源于湖北龙兴水产生物科技有限公司,9月龄,平均体重为(29.31±5.14)g,体长(15.62±5.20)cm。将大鲵饲养于规格为80 cm(长)×60 cm(宽)×15 cm(高)的塑料周转箱中,养殖室内温度维持在20~22 ℃,养殖期间投喂新鲜鱼肉,每天换水一次。实验前随机抽样大鲵,采用PCR方法检测GSIV,确认GSIV阴性后用于实验。
1.2 病毒及细胞系
大鲵虹彩病毒(GSIV)由本实验室分离鉴定;鲤上皮瘤细胞系(Epithelioma papulosum cyprin,EPC)来自于武汉大学中国典型培养物保藏中心,保藏号为CCTCC GDC0174。
1.3 实时荧光定量PCR引物及反应程序
设计大鲵β-Actin、MyD88、TLR9和MHCIIA基因的荧光定量PCR引物(表1),由武汉天一辉远生物技术有限公司合成。采用Trizol Reagent提取大鲵组织RNA,反转录为cDNA后,以其为模板进行实时荧光定量PCR扩增,每个样品设3个平行。实时荧光定量PCR扩增条件为:95 ℃预变性5 min;95 ℃变性25 s;55 ℃退火25 sec;72℃延伸30 s,共40个循环。

表1 实时荧光定量PCR法扩增引物
1.4 大鲵虹彩病毒病灭活疫苗的制备
于T75细养瓶中(Corning,USA)培养EPC细胞。待细胞生长至汇合单层,以GSIV感染复数(Multiplicity of infection,MOI)为0.5的感染剂量接种EPC细胞,25 ℃培养并逐日观察细胞病变效应(Cytopathic effect,CPE),待细胞病变大于80%时收获病毒。于96孔板中测定病毒的TCID50,将收获的病毒液分为两份,一份用于攻毒实验和血清中和抗体效价的测定。另一份病毒液用缓冲液(PBS)稀释至1.0×106TCID50/mL后,加入体积分数为0.1%的β-丙内酯,4 ℃灭活72 h,即成大鲵虹彩病毒病灭活疫苗,置于4℃备用。
1.5 疫苗安全性实验
取健康大鲵180尾,平均分为6组,分别为:一次单剂量免疫组、超剂量免疫组、单剂量重复免疫组和3组对照,各组大鲵在相同条件下隔离饲养。暂养一周后,实验组和对照组通过腹腔注射途径,分别注射疫苗和PBS。一次单剂量免疫组注射0.2 mL灭活疫苗,超剂量免疫组注射1 mL灭活疫苗,单剂量重复免疫组连续注射3次0.2 mL灭活疫苗(每天注射1次),分别设置对照组(注射PBS)。每日观察实验大鲵的摄食和活动情况,14 d后剖检观测脏器。
1.6 最小免疫剂量的测定
取健康大鲵360尾,随机分为6组,分别为5个免疫组和1个对照组。将实验疫苗随机取样,采用腹腔注射接种途径,分别按照0.1、0.2、0.3、0.4、0.5 mL/尾的免疫剂量对大鲵进行免疫;对照组每尾注射0.5 mL的PBS,作为非免疫对照。免疫后第2 、4 、7 、14 、21 和28 天,从不同剂量免疫组与对照组中各取3尾大鲵,尾静脉取血,用于血清抗体效价的测定;采集脾脏,提取脾脏总RNA,检测样品中MyD88、TLR9和MHCIIA基因表达量的变化。将待检测的血清在56 ℃水浴30 min,用M199培养基将血清稀释10倍后,按2倍等比稀释,即血清从1∶10稀释至1∶1 280,取50 μL不同稀释度的血清与50 μL 100 TCID50/0.1 mL的GSIV病毒液在96孔板中混合,每个血清稀释浓度设六个复孔,并设阳性与阴性对照孔。混匀后置于25 ℃培养箱中孵育,每隔20 min混匀一次,2 h后每孔加入100 μL的细胞悬液,置25 ℃培养箱中培养,48 h后观察结果,以Reed-Muench 法计算血清的中和抗体滴度。免疫28 d后,实验组与对照组大鲵腹腔注射大鲵虹彩病毒0.3 mL(1.0×107TCID50/mL),每天观察并记录攻毒后大鲵的临床症状、剖检变化及死亡情况,连续观察14 d。实验结束后,测定疫苗的相对保护率(relative percent survival,RPS)。
RPS =( 1-免疫组死亡率/对照组死亡率)×100%
1.7 疫苗免疫期的测定
取健康大鲵130尾,随机分为2组,1个免疫组和1个对照组。将实验疫苗随机取样,采用腹腔注射接种途径,免疫组65尾,每尾注射0.2 mL灭活疫苗;对照组65尾,每尾注射0.2 mL的PBS。免疫后第35、42、49、56、90、120和150天,从免疫组与对照组中各取3尾,尾静脉取血,用于血清抗体效价的测定;采集脾脏,提取脾脏总RNA,检测样品中MyD88、TLR9和MHCIIA基因表达量的变化。免疫150 d后,实验组与对照组大鲵腹腔注射大鲵虹彩病毒0.3 mL(1.0×107TCID50/mL),每天观察并记录攻毒后大鲵的临床症状、剖检变化及死亡情况,连续观察14 d。实验结束后,测定疫苗的相对保护率。
1.8 第二次免疫最小间隔期的测定
取健康大鲵600尾,分别随机分为10组,分别为5个免疫组和5个对照组。将试验疫苗随机取样,采用腹腔注射接种途径,免疫组300尾,每尾注射2次0.2 mL灭活疫苗(1.0×106TCID50/mL);对照组300尾,每尾在一次免疫时注射0.2 mL的灭活疫苗(1.0×106TCID50/mL),但二次免疫时注射0.2 mL PBS。免疫组和对照组同时进行一次免疫,在第一次免疫后的第7、14、21、28和56 d分别对免疫组和对照组进行第二次免疫,并在二次免疫后的第7、14、21、28、56、90、120和150 d,随机从免疫组与对照组中各取3尾,尾静脉取血,用于血清抗体效价的测定;采集脾脏,提取脾脏总RNA,检测样品中MyD88、TLR9和MHCIIA基因表达量的变化。在第二次免疫150 d后试验组连同对照组的每尾大鲵各腹腔注射大鲵虹彩病毒0.3 mL(1.0×107TCID50/mL),每天观察并记录攻毒后大鲵的临床症状、剖检变化及死亡情况,连续观察14 d。实验结束后,计算二次免疫后大鲵的存活率。
1.9 数据分析
利用SPSS21.0数据分析软件对实验结果进行统计分析,用单因素方差分析进行组间差异性分析,以P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 疫苗安全性实验
大鲵经腹腔注射单剂量、超剂量和单剂量重复的大鲵虹彩病毒病灭活疫苗,通过14 d观察,免疫动物摄食和活动行为均正常,未出现临床症状以及局部反应。接种14 d后,对实验大鲵剖检发现,注射部位、肌肉及内脏器官未见异常。实验结果表明,大鲵虹彩病毒病灭活疫苗对大鲵的安全性较好。
2.2 最小免疫剂量实验结果
2.2.1 血清中和抗体效价结果
以不同剂量的疫苗免疫大鲵后,免疫组和对照组大鲵的血清抗体效价的变化如图1所示。在整个实验期间,对照组的血清抗体效价一直维持在1 ∶2左右,而免疫组的血清抗体效价随免疫剂量的增加而增加。0.1 mL剂量组血清抗体效价明显低于其它实验组,0.2 mL、0.3 mL、0.4 mL和0.5 mL剂量组的血清抗体效价相近,且差异较小。不同剂量免疫组的血清抗体效价都在免疫后第21 d达到最高值,0.1 mL时大鲵的血清抗体效价121.10±26.62,极显著高于对照组,而其他免疫剂量组的血清抗体效价,在252.48±28.01和265.03±29.23之间,极显著高于对照组。

图1 不同剂量疫苗免疫大鲵后的血清抗体效价
2.2.2 免疫相关基因的表达变化
免疫大鲵虹彩病毒病灭活疫苗后,MyD88、TLR9和MHCIIA基因在脾脏中的表达量均有上升,3种免疫基因的表达变化如图2所示。免疫剂量越高,各免疫相关基因表达量上升的幅度越大,且不同剂量的同一免疫相关基因表达含量的变化趋势相同,0.1 mL实验组免疫基因上调幅度最小,而其它4组实验组免疫基因上调幅度相近。免疫后第7 dMyD88基因达到峰值,0.1 mL免疫组升高1.99倍,0.2~0.5 mL免疫组升高范围为2.78~3.08倍;免疫后第4 dTLR9基因达到峰值,0.1 mL免疫组升高2.11倍,0.2~0.5 mL免疫组升高范围为2.78~3.30倍;免疫后第4 dMHCIIA基因达到峰值,0.1 mL免疫组升高1.93倍,0.2~0.5 mL免疫组升高范围为2.58~2.85倍,与对照组相比,均有显著性差异。
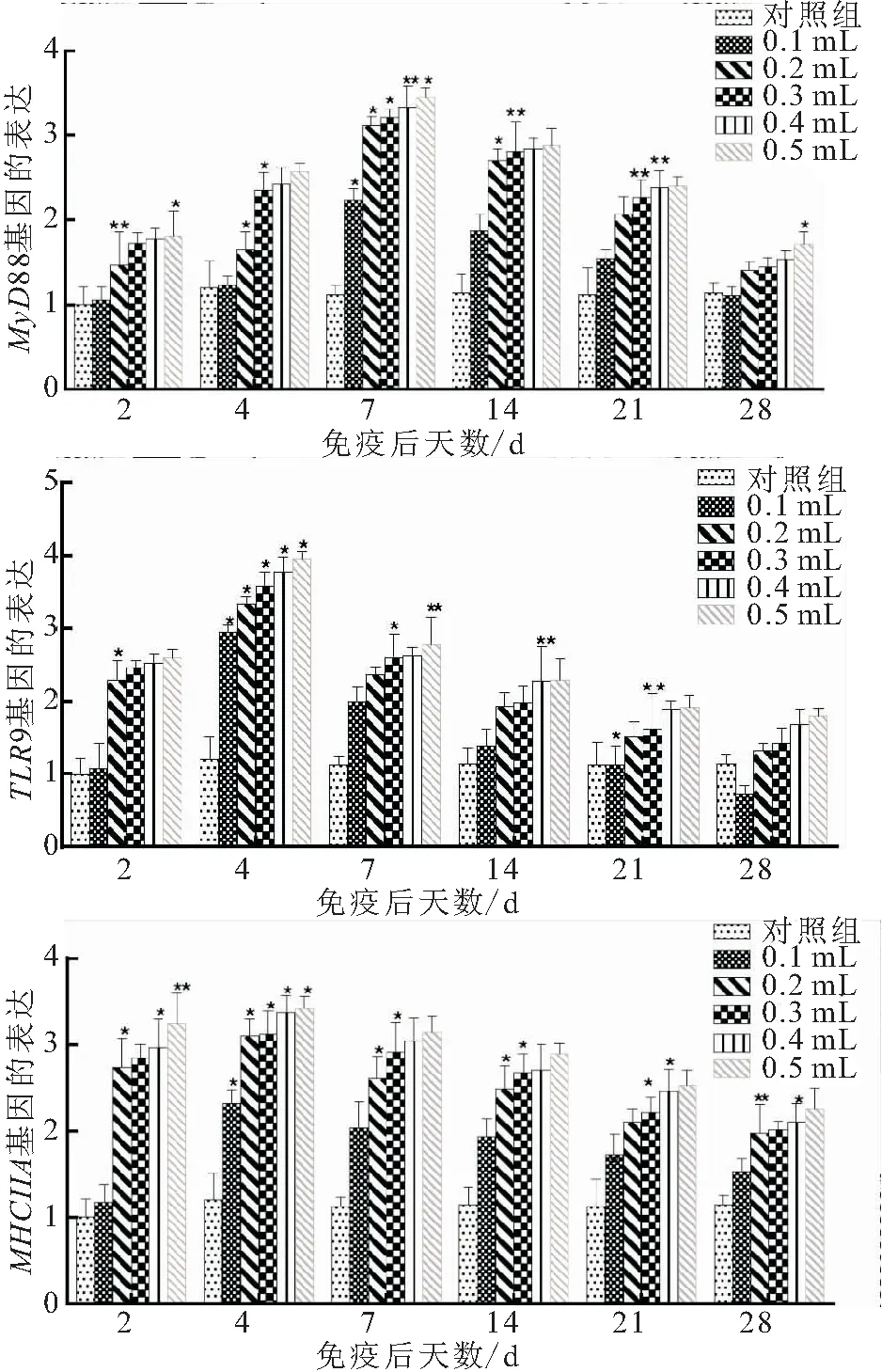
图2 不同剂量疫苗免疫大鲵后的相关免疫基因表达量的变化
2.2.3 相对免疫保护率
免疫不同剂量大鲵虹彩病毒病灭活疫苗28 d后,对实验组大鲵和对照组大鲵进行攻毒实验,检测其相对免疫保护率。0.1 mL免疫组,疫苗的相对免疫保护率为44.44%;0.2 mL、0.3 mL、0.4 mL免疫组疫苗的相对免疫保护率相同,均为72.22%;0.5 mL免疫组,疫苗的相对免疫保护率为77.78%(图3)。

图3 大鲵最小免疫剂量实验相对免疫保护率
2.3 免疫持续期实验结果
2.3.1 血清中和抗体效价结果
免疫0.2 mL大鲵虹彩病毒病灭活疫苗后,检测大鲵的血清抗体效价在150 d内的变化情况,实验结果如图4所示。对照组的血清抗体效价一直维持在1∶2左右,实验组的血清抗体效价呈现为先快速升高后保持相对稳定的趋势。免疫7 d后血清抗体效价开始显著增高,21 d实验组的血清抗体效价上升到最高水平252.48±28.01,极显著高于对照组。血清抗体效价在28 d到120 d维持稳定,从150 d开始下降,但仍显著高于对照组大鲵的血清抗体效价。

图4 大鲵虹彩病毒病疫苗免疫大鲵后血清抗体效价的变化
2.3.2 免疫相关基因的表达变化
免疫0.2 mL大鲵虹彩病毒病灭活疫苗后,检测150 d内大鲵脾脏中MyD88、TLR9和MHCIIA基因的表达情况。MyD88基因在免疫第7 d时达到峰值,TLR9基因在第4 d达峰值,MHCIIA基因在第4 d达到峰值(图5)。实验组的免疫基因表达呈现先快速升高后下降的趋势,下降后免疫基因表达量略高于对照组。

图5 大鲵虹彩病毒病灭活疫苗免疫大鲵后相关免疫基因表达量的变化
2.3.3 相对免疫保护率
免疫0.2 mL大鲵虹彩病毒病灭活疫苗150 d后,对实验组和对照组的大鲵进行攻毒实验,实验组相对免疫保护率为62.5%(图6)。
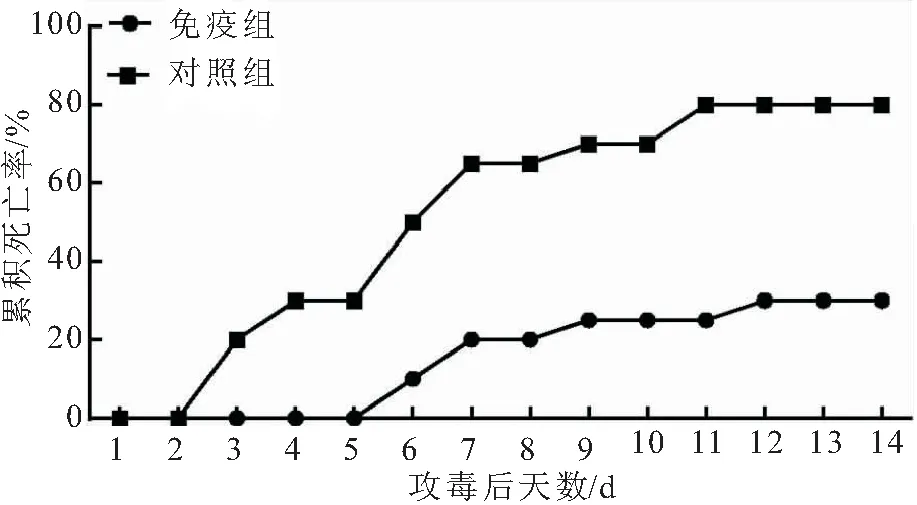
图6 攻毒后大鲵的死亡率和相对免疫保护率
2.4 第二次免疫最小间隔期实验结果
2.4.1 第二次免疫血清中和抗体效价结果
在不同第二次免疫间隔期实验组中,大鲵血清抗体效价的变化如表2所示。在一次免疫后第7 d或第14 d后进行第二次免疫,血清抗体效价都呈现出先增高后持平趋势,分别在二次免疫后的第7 d和第14 d血清抗体效价开始增高,在二次免疫后的第90 d达到最高值,最高值分别为261.38±18.23和265.03±22.34;在一次免疫后第21 d、28 d和56 d后进行二次免疫,血清抗体效价整体持平,但高于一次免疫时的最高血清抗体效价,一次免疫后的21 d进行二次免疫,可以最快达到最高血清抗体效价,最高值为274.37±25.23,极显著高于对照组。
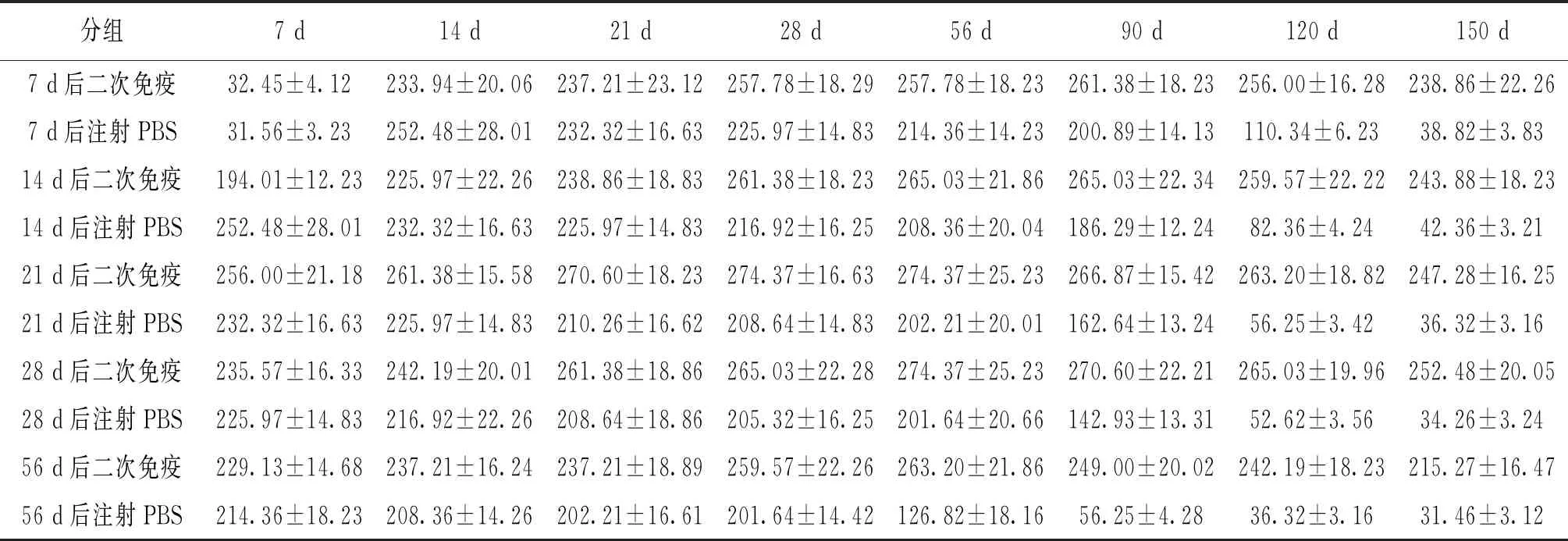
表2 不同二次免疫间隔期免疫后大鲵的血清抗体效价
2.4.2 免疫相关基因的表达变化
第二次免疫后MyD88、TLR9和MHCIIA基因均呈现出先升高后降低并持平的趋势(图7)。不同间隔期二次免疫后,免疫基因均呈先增高后下降的趋势。一次免疫后21 d进行二次免疫,MyD88、TLR9和MHCIIA基因的变化趋势最明显,二次免疫后第7 d免疫基因的增幅达到峰值,MyD88基因增高2.09倍,TLR9基因增高2.52倍,MHCIIA基因增高1.68倍,均显著高于对照组。

图7 一次免疫后不同时间二次免疫大鲵后的相关免疫基因表达量的变化
2.4.3 第二次免疫的存活率
在第二次免疫后150 d对大鲵进行攻毒实验,检测其存活率。一次免疫间隔7 d后和14 d后进行二次免疫的存活率都为66.67%。一次免疫间隔21 d后和28 d后进行二次免疫,其存活率分别为86.67%和80.00%。一次免疫间隔56 d后进行二次免疫的存活率为76.67%(表3)。

表3 大鲵第二次免疫最小间隔期实验存活率
3 讨论
疫苗免疫选择合适的免疫年龄至关重要,因为免疫系统在年龄较小时尚未发育成熟,无法产生有效的保护力,所以接种灭活疫苗的年龄不宜太小[10]。Jiang等[11]研究发现大鲵部分与免疫相关的器官在6月龄至9月龄发育完全。欧燎原[12]发现9月龄时,幼鲵体型上与成鲵一致,基本发育完全,外鳃呼吸功能萎缩并逐步脱落,但因为机体免疫和自我防御能力的下降,幼鲵极易患病。为了大鲵虹彩病毒病灭活疫苗的高效利用,本研究选择9月龄的大鲵开展疫苗的安全性与免疫效力的研究。
安全性是疫苗最为重要的数据,对疫苗开展安全性评价是任何一个新疫苗在研发阶段或者推向市场之前都必须要进行的[13]。崔艳丽[14]在研制了鸡新城疫、传染性支气管炎、减蛋综合征、禽流感(H9亚型)四联灭活疫苗(LaSota株+M41株+HS25株+HZ株)后,从单剂量接种、单剂量重复接种和一次性超剂量接种三个方面证明了疫苗的安全性,为疫苗的有效使用提供了安全保障。本研究对大鲵进行了一次单剂量接种、单剂量重复接种和超剂量接种实验,接种疫苗后发现实验大鲵摄食和行为正常,均未出现临床症状以及局部反应,剖检实验大鲵后观察发现,注射部位、肌肉及脏器未见异常,证明该疫苗安全。
过小的免疫剂量不能有效刺激机体产生充足的免疫力[15]。疫苗的免疫效果好、副反应小和生产成本少是疫苗生产应用与推广的关键参数。王晓丽等[16]将兔病毒性出血症、多杀性巴氏杆菌病二联蜂胶灭活疫苗以0.25、0.5和1 mL/只三种不同剂量组免疫健康易感兔,其测得最小免疫剂量为0.5 mL/只;刘泽文等[17]以1.2、1.6、2.0和2.4 mL的仔猪红黄痢疫苗免疫怀孕母猪,确定疫苗的最小免疫剂量为1.6 mL。本研究采用0.1、0.2、0.3、0.4和0.5 mL/尾的大鲵虹彩病毒病灭活疫苗,对健康大鲵免疫,28 d后对其进行攻毒,实验结果表明,不同免疫剂量均能触发大鲵产生保护率,免疫剂量越高,血清抗体效价越高,免疫基因表达量上调幅度越大,相对免疫保护率也越高。当免疫剂量为0.2 mL及以上时对大鲵虹彩病毒的攻毒保护率均不低于70%,因此确定该疫苗的最小免疫剂量为0.2 mL/尾,为生产中免疫程序的合理制定提供参考依据。
疫苗免疫动物后刺激机体产生免疫反应,从应答产生到免疫力产生需要一定的时间[18]。通过实验确定疫苗免疫产生时间和免疫持续时间可以帮助了解疫苗免疫后何时能产生有效保护,从而在免疫效力未达到或低于保护水平时可采取加强饲养管理、调整免疫程序提前免疫或加强免疫等措施来减少免疫空白期及低下期的产生[19]。李杰等[20]研究了鳗弧菌(Vibrioanguillarum)O1/O2血清型二价灭活疫苗免疫大菱鲆后的免疫保护期,发现大菱鲆获得的免疫保护持续期大于150 d。本研究在免疫后150 d测定其攻毒保护水平,测得大鲵的相对免疫保护率分别为62.5%。研究结果表明MyD88基因在免疫第7 d时达到峰值,TLR9基因、MHCIIA基因在第4 d时达到峰值,免疫21 d以后血清抗体效价达到最高值252.48±28.01,表明大鲵免疫21 d后可以建立预期的免疫保护。
二次免疫能够提高宿主的抗体水平、延长抗体持续时间,从而延长疫苗的免疫保护期[21-22]。丁山等[21]研究鳗弧菌三价灭活疫苗对大菱鲆的保护效果,发现二次免疫后,大菱鲆的相对免疫保护率高于70%,一次免疫的有效免疫保护期不低于120 d,二次免疫的有效免疫保护期不低于150 d。康慧鑫等[22]研究堆型艾美耳球虫疫苗虫株发现二次免疫可使抗体水平迅速提高,在最适时间进行二次免疫,对雏鸡有促生长作用,并可增强免疫力,实验结果表明二次免疫间隔为7 d时可达到良好的免疫效果;本研究分别于一次免疫后的第7、14、21、28和56 d进行二次免疫,研究结果表明,一次免疫后21 d进行二次免疫血清抗体效价可以最快达到最高水平274.37±25.23,相关免疫基因的表达也能较快达到最高水平并且维持较长时间。一次免疫后14、21、28和56 d进行二次免疫,大鲵的存活率均高于一次免疫后的存活率。因此,确定大鲵虹彩病毒病灭活疫苗的二次免疫最小间隔期为21 d。大鲵虹彩病毒病灭活疫苗二次免疫时间的确定,有效提高了疫苗的免疫效力和延长了疫苗的保护时间。
综上所述,本文围绕大鲵虹彩病毒病灭活疫苗的安全性与免疫效力开展了系统的研究,明确了疫苗的安全性,确定了大鲵虹彩病毒病疫苗的最小免疫剂量为0.2 mL/尾、二次免疫最小间隔期为21 d,为大鲵虹彩病毒病灭活疫苗的产业化应用提供了技术支撑。
