龙眼核多酚对LPS 诱导的ALI 小鼠肺组织的保护作用及机制
2021-07-15范风颖
范风颖,骆 姗,赵 莉
急性肺损伤(ALI)是临床常见的肺部疾病,以持续或急性肺部炎症为病理基础,因嗜中性粒细胞聚集,损伤肺泡-毛细血管屏障,导致出现肺间质水肿、非心源性肺水肿等病理特征[1]。该病发生机制主要是因体内炎性水平升高、氧化应激反应增强导致,氧化应激会增加体内活性氧簇分泌量,引起气道与血管重塑,并侵犯至肺间质,导致肺水肿发生[2]。在实验动物模型建立时,常采用脂多糖(LPS)诱导,LPS是革兰阴性菌主要细胞壁成分,是人体感染革兰阴性菌的重要病原菌,其诱导作用是诱导机体炎症反应过度激活,促进大量活性氧大量释放,引起氧化与抗氧化系统失衡,故会导致肺损伤[3]。目前肺损伤缺乏特异性治疗药物,研究相关治疗药物是重症科研究重点。龙眼也称为桂圆,肉质清脆、味美香甜,果肉内含有丰富的碳水化合物、氨基酸、维生素C、蛋白质等营养物质,并含有丰富的多酚、多糖、多肽、皂苷类活性成分,有双重的营养与药用成分。中医认为龙眼归心、脾经,有补气养血、安神定志、养心健脾功效。有研究[4]表明,除了龙眼肉,龙眼核有双重的营养、保健功效,核内含有的脂肪、生物碱等成分,经多种分离纯化技术并能从龙眼核内提取到多酚成分,起到抗氧化、抗炎、降血糖等作用。但龙眼核多酚是否能够作为治疗ALI 的相关药物,以及其肺组织保护机制缺乏研究报道。现本研究就分析眼核多酚对ALI 小鼠的作用机制,报道如下。
1 材料与方法
1.1 实验动物 雄性小鼠40 只(新疆医科大学动物实验中心提供),SPF 级,周龄6~8 w,体重18~22 g;饲养环境SPF 级,室温20~25 ℃,湿度40%~60%,自由摄食、饮水。
1.2 药物与试剂 龙眼核:高州产地;地塞米松片:广东华南药业,国药准字H44024469,0.75 mg/片;脂多糖:Sigma 公司;酶联免疫法试剂盒购自罗氏公司;MR-96A 酶标分析仪购自深圳迈瑞生物;1658001 蛋白印迹电泳仪购自美国BioRad 公司;TD5-Ⅱ型离心机购自长沙平凡;SW-CJ-1FD 型超净工作台购自苏州安泰。
1.3 龙眼核多酚提取 将龙眼核研磨成粉,精密称量后,过60 目筛,备用。粉末200 g,加入95%乙醇1 L,70 ℃环境下,对龙眼核粉末进行搅拌,提取3 次,每次作用3 h。合并提取液,离心15 min,3500 r/min,压缩提取液至无醇味浸膏。添加蒸馏水后分散,石油醚脱脂,对其分别加入氯仿、乙酸乙酯等溶剂萃取,合并萃取液,再压缩、回收,对不同浓缩物进行干燥,液-液萃取法分离出龙眼核多酚。
1.4 动物模型建立 动物模型建立:小鼠得到1 w适应性喂养,模型建立前连续灌胃3 d,对照组、模型组分别腹腔注射等量生理盐水,地塞米松组:腹腔注射地塞米松20 mg/kg;龙眼核多酚组:腹腔注射龙眼核多酚20 mg/kg,连续3 d,末次给药1 h 后于小鼠尾部静脉注射LPS 0.5 ml,建立ALI 模型,其中对照组仅注射等量生理盐水。
造模完成24 h 后,摘除小鼠眼球,留取血液标本,对血液标本离心15 min,3500 r/min,将血液标本置于-20 ℃环境内保存。将小鼠处死后,开胸取左肺组织,吸干血迹后,电子秤测量肺组织湿重,随后将肺组织置入60 ℃烘箱内,连续48 h 后测量干重,计算干湿重比值:湿重/干重。取肺组织,甲醛固定24 h,切片,HE 染色,用显微镜观察肺组织病理特征,对肺泡水肿、肺泡充血、肺间质水肿、肺泡壁增厚,分别计0~4 分:0 分:无改变;1 分:轻微变化;2分:中度变化;3 分:重度改变;4 分:极重度改变。小鼠处死后,分离器官,左肺用磷酸缓冲液冲洗,连续3 次,收集灌洗液,离心10 min,2000 r/min,收集上清液,磷酸缓冲液重悬,涂抹在载玻片,以Giemsa 染色,计算嗜中性粒细胞、白细胞的数量,酶联免疫吸附法检测肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6及IL-1β。留取的分离血液标本用WST-1 法检测血清氧化应激指标:包括超氧化物歧化酶(SOD),测定肺组织内丙二醛(MDA)。分离提取细胞总蛋白后,用增强化学发光法计算高迁移率族蛋白(HMG)B1、核因子(NF)-κB 表达。
1.5 统计学方法 应用SPSS20.0 统计软件分析。计量数据用x±s 表示,采用t检验;计数资料采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 肺组织病理特征 对照组小鼠肺组织结构完整,肺泡腔内无渗出物,肺间质正常,肺泡间隔无增厚;模型组肺泡结构被破坏,肺泡腔炎性浸润,肺间质水肿,肺泡间隔增厚明显,病理平均分为(12.51±3.48)分;地塞米松、龙眼核多酚组肺泡腔炎性减轻,肺间质水肿缓解,肺泡间隔增厚不明显,平均病理分分别为(4.81±1.63)、(5.02±0.65)分,地塞米松、龙眼核多酚组高于模型组(t=5.667,5.984;P=0.001,0.001);而两组比较无显著差异(P>0.05)。
2.2 湿重/干重比值 对照组肺组织湿重/干重比值明显低于其他3 组(P<0.05),而地塞米松、龙眼核多酚组较模型组下降(P<0.05),但地塞米松、龙眼核多酚组比较无显著差异(P>0.05),见表1。

表1 4 组肺组织湿重/干重比值
注:与对照组比较,①P <0.05;与模型组比较,②P <0.05
2.3 炎性水平 对照组嗜中性粒细胞、白细胞计数、TNF-α、IL-6 及IL-1β 均低于其他3 组(P<0.05),而地塞米松、龙眼核多酚组较模型组下降(P<0.05),但地塞米松、龙眼核多酚组比较无显著差异(P>0.05),见表2。
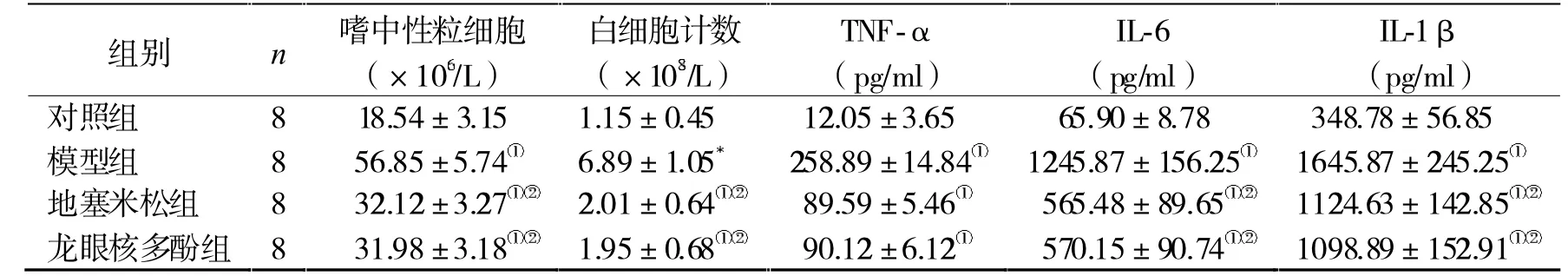
表2 4 组炎性水平比较
2.4 氧化应激反应 对照组SOD 表达高于其他3 组,MDA 表达低于其他3 组(P<0.05),而地塞米松、龙眼核多酚组SOD 表达高于模型组,MDA 表达低于模型组(P<0.05),但地塞米松、龙眼核多酚组比较无显著差异(P>0.05),见表3。

表3 四组氧化应激反应比较
2.5 HMGB1、NF-κB 表 达 模 型 组HMGB1、NFκB 表达较对照组升高(P<0.05),而地塞米松、龙眼核多酚组表达有所下降,较模型组低(P<0.05),见表4。
表4 不同H MGB1、N-?B 表达比较

表4 不同H MGB1、N-?B 表达比较
注:与对照组比较,①P <0.05;与模型组比较,②P <0.05
3 讨论
ALI 发病机制复杂、进展迅猛,其中革兰阴性菌感染是其主要致病因素,诱发肺部炎性细胞浸润及氧化应激反应,导致肺间质水肿、肺泡腔渗出[5-6]。脂多糖存在革兰阴性菌细胞壁外膜,在注射脂多糖后会建立ALI 模型,为动物实验展开奠定基础[7-8]。本组研究,在用脂多糖诱导肺组织损伤小鼠模型,经初死解剖肺泡结构被破坏,肺泡腔炎性浸润,肺间质水肿,肺泡间隔增厚明显。故采用脂多糖诱导,能成功建立ALI 小鼠模型。本组研究,3 组小鼠的肺组织病理评分、肺组织湿重/干重比值均高于对照组,其中模型组增加明显,地塞米松、龙眼核多酚有所下降(P<0.05)。结果证实采用地塞米松与龙眼核多酚能减轻小鼠肺组织病理损伤,缓解肺泡间质水肿,故肯定龙眼核多酚对肺组织有一定的保护作用。
ALI 是因炎症细胞浸润所致,外界环境改变,或促进嗜中性粒细胞活性,白细胞计数升高,产生过度炎症反应,损伤肺组织上皮细胞[9-10]。本组研究,ALI 小鼠建立成功后,嗜中性粒细胞、白细胞计数、TNF-α、IL-6 及IL-1β 水平均明显升高,且高于对照组,但在采用地塞米松、龙眼核多酚后其表达均明显下降(P<0.05)。结果表明龙眼核多酚能够下降小鼠炎症反应。龙眼核含有的生物碱、多酚等成分,具备理化除湿、止血镇痛作用,且在现代药理[11]研究中,通过提取龙眼核相关物质,对多种病原菌起到不同程度的抑制作用,而多酚成分占龙眼核主要部分,故能肯定该物质的作用。氧自由基增强过度是致ALI 的重要原因,而且炎症细胞通过浸润肺组织,会促进氧化应激反应[12-13]。SOD 是内源性抗氧化系统的重要因子,MDA 是体内自由基脂质过氧化反应后形成的产物,两者表达直接反映了肺组织损伤程度[14]。本组研究对照组SOD 表达高于其他3 组,MDA 表达低于其他3 组(P<0.05),而地塞米松、龙眼核多酚组SOD 表达高于模型组,MDA 表达低于模型组(P<0.05),但地塞米松、龙眼核多酚组比较(P>0.05)。结果证实在建立动物模型后,氧化应激反应明显,而在用药后可改善模型氧化损伤,以此能缓解肺组织炎性浸润,降低炎症水平。孙菡峥等[15]报道指出于龙眼核内提取多酚含量为53.68 mg/g,抗氧化性能高,对氧自由基的清除率(73.90±0.60)%。杨敦杰等[16]报道龙眼核内含有丰富的多酚类物质,50%乙醇萃取物之总多酚化合物含量最高,且清除超氧阴离子能力最高。本组研究,地塞米松、龙眼核多酚组HMGB1、NF-κB 表 达 均 低 于 模 型 组(P<0.05)。HMGB1 是反映肺损伤的重要因子,其表达可激活Toll 样受体4/NF-κB 通路,导致肺损伤的发生[17-18]。研究提示龙眼核多酚通过下降HMGB1、NF-κB 表达,而起到保护肺组织的作用。
基于此,本研究认为龙眼核多酚通过抑制小鼠氧化应激反应,降低肺组织炎症反应,起到肺组织保护作用,缓解肺损伤程度。虽然其作用与地塞米松的作用效果无明显差异,但在长期临床实践中发现,地塞米松不良反应多,会诱发呼吸困难、过敏性休克、低钾血症等严重并发症,此时为龙眼核多酚的临床应用奠定基础[19-20]。
综上所述,龙眼核多酚通过减轻因LPS 诱导的ALI 小鼠的炎症反应,抑制氧化应激反应,起到肺组织保护作用,缓解肺损伤程度。
