TRIF-NF-κB 信号通路参与TLR3 介导的胰岛β 细胞损伤
2021-07-15朱祎婧艾智华钟大鹏
朱祎婧,艾智华,钟大鹏
糖尿病的主要特征是体内的糖脂代谢发生紊乱,伴随着血葡萄糖的升高[1]。作为分泌胰岛素的重要来源,胰岛β 细胞在能量代谢平衡及糖尿病的发生、发展过程中扮演了重要角色[2]。近年来,针对糖尿病患者以及糖尿病动物模型的研究提示:胰岛β细胞损害及功能障碍,可能与体内过多营养物质的代谢产物所引发的慢性非特异炎症的持续有关[3-5]。Toll 样受体家族(Toll-like receptors,TLRs)可诱导多种炎症因子的释放,进而发挥免疫作用[6]。前期研究发现高糖高脂可抑制胰岛β 细胞的增殖,同时上调了TLR3、TNF-α、IL-1β 等炎症因子的表达,这表明TLR3 介导的炎症反应参与了高脂、高糖诱导的胰岛β 细胞的损伤[7]。予以TLR3 特异性激动剂聚肌胞(PIC)刺激可明显抑制胰岛β 细胞分泌胰岛素的功能,且炎性因子表达明显升高[8]。上述研究结果表明,激活胰岛β 细胞TLR3 会抑制其增殖和功能,潜在的机制可能与TLR3 激活诱导TNF-α,促进炎症因子的合成与释放有关[8]。但TLR3 受体激活诱导的炎症反应具体是如何影响胰岛β 细胞尚不清楚。
1 材料与方法
1.1 细胞培养与实验分组 选用含双抗(100 U/ml青霉素和100 mg/ml 链霉素)的DMEM 培养基(SH30243.01B,Hyclone 公司)培养小鼠胰岛β 细胞株(NIT-1,武汉普赛诺生命科技有限公司),观察细胞状态进行细胞传代。将细胞接种于96 孔板(每孔约7×103个的细胞)后改用含10% 胎牛血清的培养基培养24 h 后,换用含0.1% 胎牛血清的DMEM培养基予细胞同步化处理。所有细胞经同步化处理24 h 后观察细胞生长状况,待细胞贴壁后予以PIC(10108812001,Sigma)刺激48 h。实验分4 组:Blank 组、30 μg/ml PIC 组、60 μg/ml PIC 组、90 μg/ml PIC 组。
1.2 流式检测细胞周期 用不含乙二胺四乙酸(EDTA)的胰蛋白酶消化细胞后用PBS 洗涤。将细胞悬液离心(1000 r/min,5 min)处理(重复两次),弃上清留取细胞沉淀。将70%乙醇预冷处理,然后缓慢加入用PBS 重悬的细胞沉淀(约5×105~106个细胞),混匀后在4 ℃条件下固定过夜。次日细胞沉淀离心后加入PBS 后再次离心(1500 rr/min,10 min),重复两次取细胞沉淀,避光环境下向细胞沉淀中加入200 μl 预先配好的DNA 染液(PI solution 20 μg+Triton x-100 1 μl+Rnase A solution 0.2 mg+PBS 定容到1 ml),在室温下孵育15 min 后流式细胞仪检测(Cyt-Expert,Beckman 公司)。
1.3 PCR 检测NF-κB 及TRIF 的mRNA 表达 采用RNA 提取试剂盒(TaKaRa Mini BEST Universal RNA Extraction Kit,Cat.# 9767)进行RNA 提取。于冰上配制反应混合液(gDNA Eraser 1 μl,5X gDNA Eraser buffer 2 μl,Total RNA 7 μl),加入RNA 样品后立即在42 ℃反应2 min,然后置于4 ℃保持。2%琼脂糖凝胶电泳法对样品RNA 完整性进行检测并用DNA/RNA 测定仪测定混合物浓度和纯度。根据合成的引物检测TRIF 及NF-κB 的mRNA 表达量,检测方法严格按照RT-PCR 试剂盒(iQTMSYBRRGreen Supermix kit,Bio-Rad)说明书进行操作。根据Gene-bank 提供的基因序列设计相关引物序列(表1)。

表1 引物序列
1.4 检 测TRIF、NF-κB、CyclinD1 及Caspase-3 蛋白表达 各组细胞样本经RIPA 裂解后离心(12000 r/min,10 min)取上清,采用BCA 法测定蛋白浓度。制备分离胶和浓缩胶,待浓缩胶聚合后将待测样品与等体积蛋白loading 添加至加样孔,电泳后依次进行转膜、封闭、一抗孵育、洗涤、二抗孵育、洗涤、发光。一抗抗体稀释比例信息见表2。
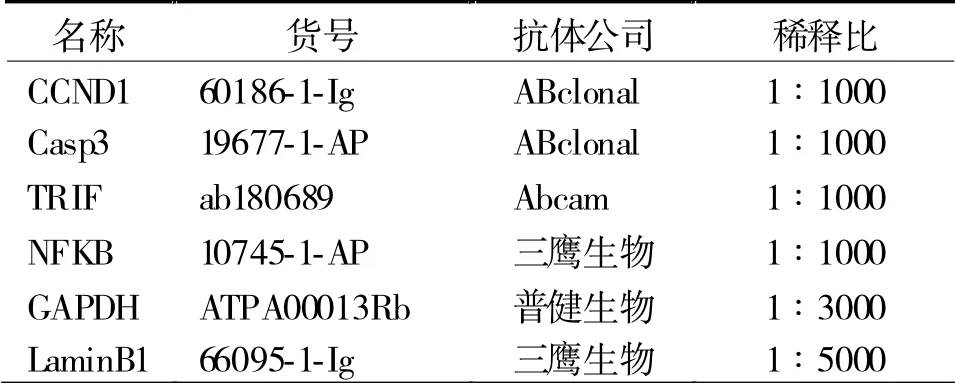
表2 一抗抗体稀释比例信息
1.5 统计学方法 应用SPSS 13.0 软件分析数据,计量资料以均数±标准差表示,两样本均数比较采用t检验,多样本均数间比较采用方差分析(one-way ANOVA),P<0.05 为差异有统计学意义。
2 结果
2.1 细胞周期检测 通过流式细胞计数方法检测细胞增殖的情况(图1),结果发现与空白对照组相比,随着PIC 刺激浓度的增加,NIT-1 细胞停留在G0/G1 期细胞的比例明显上调(P<0.01),而在S 期和G2/M 期的细胞比例出现明显下调(P<0.01)。

图1 流式细胞周期统计结果
2.2 TRIF、NF-κB mRNA 表达 与Blank 组比较,胰岛β 细胞TRIF 和NF-κB 的mRNA 表达量随着PIC 刺激浓度的升高而增高(图2)。在低浓度PIC(30 μg/ml)刺激时,mRNA 表达出现了上调趋势,但无统计学差异(P>0.05),而在中等浓度和高浓度时mRNA 表达量明显上调(P<0.01)。
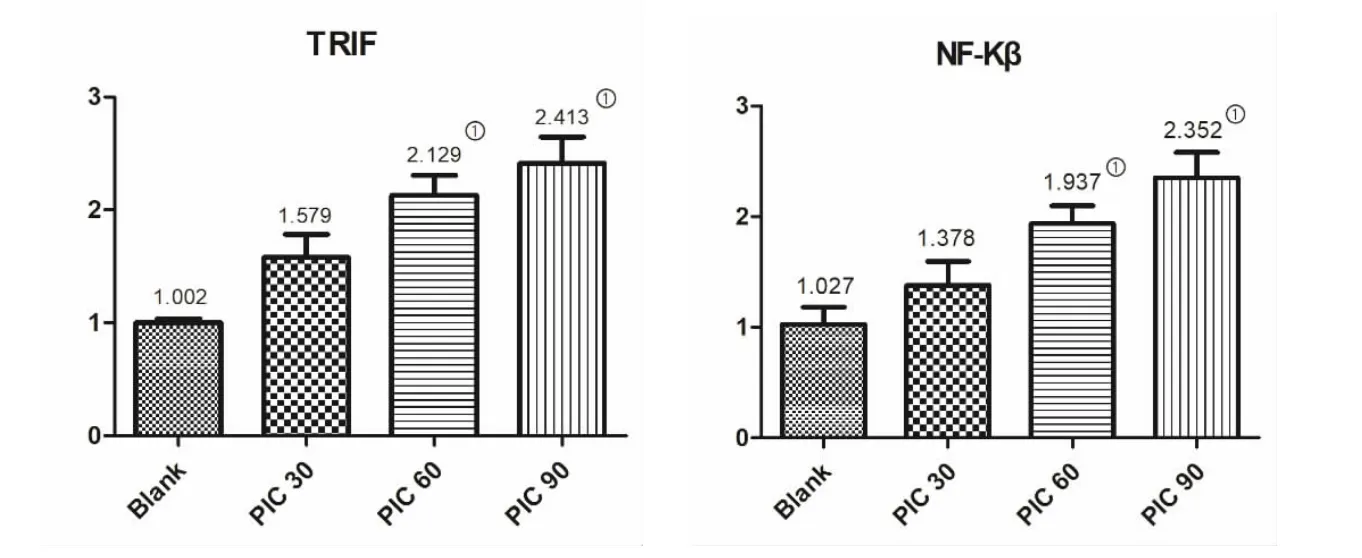
图2 TRIF 与NF-κB mRNA 表达情况
2.3 蛋白表达 细胞周期蛋白CCND1 表达量(图3)在不同浓度PIC 刺激下均明显下调(P<0.01),且与PIC 刺激浓度的升高呈现负相关;pro-CASP3在低浓度和中浓度PIC 刺激时表达量上调程度明显低于高浓度刺激(P<0.01),而cleaved-CASP3蛋白表达量的升高幅度呈浓度依赖性(P<0.01);TRIF 蛋白表达在经不同浓度PIC 干预后呈现明显上调(P<0.01);NF-κB 蛋白表达也呈现浓度依赖性上升(P<0.01)。
3 讨论
尽管引起糖尿病的原因众多,但似乎都与诱发组织细胞氧化应激的增加,进而引起一系列炎症因子的激活有关[9]。炎症因子的激活将导致胰岛β 细胞的结构和功能受到损伤、外周组织对胰岛素的敏感性降低即胰岛素抵抗的形成[10]。团队前期研究发现予以高脂高糖刺激会明显抑制NIT1 细胞细胞增殖,同时其分泌胰岛素的功能也受到了极大的抑制[7]。本研究证实了PIC 刺激NIT1 细胞株可使大量增殖细胞停留在细胞周期的G0/G1 期,而未能继续分裂成熟到S/G2 期,且对细胞增殖的抑制作用呈现浓度依赖性。有研究表明,CCND1 的表达对维持胰岛β 细胞的数量上发挥了重要作用,过表达CCND1 明显上调了人胰岛β 细胞的增殖[11]。而在此实验中,NIT1 细胞经PIC 刺激后,CCND1 的表达受到了明显抑制,且呈现浓度依赖的趋势,提示PIC 刺激在阻断胰岛β 细胞从G1 期进入S 期的过程中,CCND1 可能是TLR3 信号通路的作用靶点。
细胞凋亡是一种程序性细胞死亡的过程。目前的研究认为Caspase 家族是哺乳动物细胞凋亡过程中的重要分子[12],其中Caspase 3 被认为是细胞凋亡过程Caspase 级联反应中最重要的效应型Caspase[13]。本研究予以不同浓度PIC 处理后,凋亡相关蛋白分子Caspase3 的表达出现了明显改变,提示予以PIC刺激后激活了细胞凋亡的级联反应,使细胞增殖受抑制以及凋亡增加,这可能是导致胰岛β 细胞数量的减少和(或)胰岛素分泌不足的原因。
TLR3 参与了机体重要免疫作用,它可识别病毒来源的dsRNA 及其类似物PIC 触发促炎细胞因子的释放[14]。对比TLR3 敲除小鼠与野生型小鼠发现,高脂饮食喂养下,TLR3 敲除小鼠的糖耐量和脂质状况有所改善,还有促炎细胞因子和炎症趋化因子基因表达的下调,这表明TLR3 可能是糖脂代谢中的重要调节分子[15]。本课题前期研究结果证实,高脂高糖刺激会上调TLR3 的表达,而艾塞那肽可改善糖脂毒性对胰岛β 细胞的增殖抑制,下调糖脂毒性诱导的炎症因子的表达,可能与TLR3 信号通路被抑制有关[16]。在诱导炎症反应中,TLRS(除TLR3)都可通过髓样分化反应蛋白88(MyD88)依赖途径诱导相关炎症因子的释放[17]。除了MyD88 依赖信号通路,TLR 还可以与TRIF 相关接头分子结合以招募TRIF 结合蛋白,TRIF 活化后可激活TANK 结合激酶1,进而再激活干扰素调节因子3,诱导分泌炎性因子IFN-β。与其他TLR 不同的是,TLR3 不依赖MyD88 信号通路,可直接激活TRIF 相关信号通路,介导下游的信号转导[18]。本次实验予以TLR3 特异性激动剂PIC 刺激NIT1 细胞后,TLR3 与其下游TRIF 的mRNA 表达逐渐上调,且与刺激的PIC 浓度呈正相关,这表明TLR3-TRIF 信号通路的激活在胰岛β 细胞损伤中可能发挥了重要作用。同时,TLR3-TRIF 下游信号通路中NF-κB 也被PIC 活化,且随PIC 刺激浓度的增加而增加。提示NIT1 细胞增殖受抑制以及凋亡的增加可能与TLR3-TRIFNF-κB 炎症信号通路的激活,进而抑制胰岛β 细胞生长和分化,诱导β 细胞凋亡和功能障碍有关。
