金属复合材料基电化学传感器在双酚A检测中的应用研究
2021-07-14佘小燕聂江波肖江蓉彭天右
佘小燕, 聂江波, 肖江蓉, 张 静, 彭天右*
(1.湖北省纤维检验局,湖北武汉 430070;2.武汉大学化学与分子科学学院,湖北武汉 430072;3.武昌首义学院城市建设学院,湖北武汉 430070)
1 前言
双酚A(Bisphenol A,BPA)作为一种重要的化工原料,广泛用于医疗器械、建筑、包装、汽车及航空航天等领域的塑料制品等化工产品的阻燃剂、抗氧化剂和热稳定剂[1 - 3],但BPA属环境雌激素类化合物,会造成内分泌系统和神经系统紊乱,降低机体免疫功能,甚至引发器官畸形和癌变,严重时威胁人的健康和生命[4,5]。随着BPA在各种工业产品中日益广泛的应用,其安全性问题开始得到重视[6]。世界各国先后出台了在食品包装材料、食品添加剂、器皿及容器中禁止使用BPA的相关法规。因此,BPA的快速、准确和灵敏的分析检测就显得尤为重要[7 - 9]。
目前,BPA分析主要有紫外-可见分光光度法[10,11]、荧光分析法[12,13]、毛细管电泳法[14,15]、高效液相色谱法(HPLC)[16,17]、气相色谱-质谱(GC-MS)法[19,20]、液相色谱-质谱(LC-MS)法[21,22]和电化学法[23 - 26]等。我国相关国家标准(GB31604.10-2016,GBT34455-2017和GB31660.2-2019)多采用GC-MS和LC-MS法,但色-质谱联用技术存在设备昂贵和维护费用高、耗时的样品前处理复杂等问题[22]。电化学传感器方法具有简便快速、灵敏度高、选择性好、仪器便携和易实现现场自动化监测等优点,特别适于BPA的快速、高效检测[23 - 26]。然而BPA电化学检测方法的准确度、选择性和重现性尚不理想[24]。因此,探索灵敏度高、选择性和重现性好的传感器材料用于BPA快速、高效检测引起了人们的广泛关注[25]。目前,电化学传感器检测BPA的电极修饰材料主要有碳纳米结构材料、金属纳米材料、半导体纳米粒子或量子点等[27 - 33]。其中,金属纳米材料通常具有较高的电催化活性和稳定性,但存在分散性较差、在溶剂介质中易团聚等问题。为此,通过金属纳米粒子的负载和稳定化等手段构建灵敏度高、选择性好和响应快的电化学传感器用于BPA的快速分析成为当前的研究热点之一[23 - 26]。本文将就金属复合材料基电化学传感器的研究进展及其在BPA检测领域中的应用进行评述,并重点关注金属复合材料的制备及其电化学传感器的检测范围、灵敏度和重现性等检测BPA性能,为其今后的发展和实际应用提供参考。
2 BPA电分析方法概述
2.1 BPA的常用电分析方法
目前,用于BPA的电分析方法主要有循环伏安法(CV)、线性扫描伏安法(LSV)、差分脉冲伏安法(DPV)、方波伏安法(SWV)和计时电流法(CA)等[34]。CV法是研究电活性物质的氧化还原行为的常用技术,主要用于定性或“诊断”实验,往往需要结合其他手段,如“脉冲”技术等进行定量分析[35,36]。LSV法是将线性电位扫描施加于工作电极和辅助电极之间,根据其电流-电位曲线测得的峰电流与被测物浓度关系的定量电分析分析方法[37,38]。DPV法是在CV法基础上,添加一定的电压脉冲,在电势改变之前读取电流从而减少充电电流影响的电分析方法[39,40]。与CV法相比,DPV法因背景电流的减少而获得高灵敏度。此外,DPV法可大大降低空白值,在BPA检测中可检测10 nmol/L级的浓度,且用样量极少。一般而言,CV法可检测反应过程的氧化还原行为,而在定量分析、拟合曲线时需采用精密度更高的DPV法。SWV法是在一个周期内的正向脉冲和负向脉冲终点各采集一个电流信号,然后相减得到净电流进行定量分析的方法[41,42]。与LSV和CV法相比,SWV法具有较宽的动态范围和较低的检测下限(低至10 nmol/L)。CA法是用于电化学研究、环境检测和食品安全等领域的电化学技术[43],可用于产生与传统恒电流充放电(GCD)匹配的容量率数据,但比GCD快得多,且其容量数据通常从数百个速率值降低到极低的速率[44,45]。
2.2 BPA的电化学氧化机理
根据文献报道[46,47],BPA的电化学氧化机制为不同苯环上的两个羟基在正电位条件下发生两电子和两质子转移的不可逆反应。Baccarin等[47]采用含有银纳米颗粒(Ag NPs)的石墨-聚氨酯(GPUEs)复合电极(Ag NPs-GPUEs)用于BPA电化学检测,并提出了相应的氧化机理。首先,Ag在电极表面氧化为Ag+,然后与缓冲介质反应形成Ag3PO4;达到平衡后Ag+与BPA相互作用导致BPA失去其分子中与氧结合的两个H+,形成荷负电的中间产物。该中间产物与两个Ag+作用形成的化合物导致扩散层中分析物浓度提高,并在电位0.42 V时发生氧化,分子中的两个电子将Ag+还原为Ag,而BPA被氧化为2,2-二(4-苯醌)丙烷。
3 金属复合材料基传感器在BPA检测中的应用
金属复合材料可大致分为贵金属、非贵金属和合金三大类(表1)。其中,贵金属主要以Au、Ag为主[28,29,38,44,47,48,52 - 87];非贵金属具有成本低的优势,但目前并不多见(主要为Cu)[88 - 92];合金主要为贵金属,如AuPd、PtPd等[93 - 97]。总体而言,金属纳米粒子易聚集,且富集能力不理想,往往需要复合其他材料以便提高电化学传感器对BPA的富集能力、导电性和稳定性[30,48 - 50]。
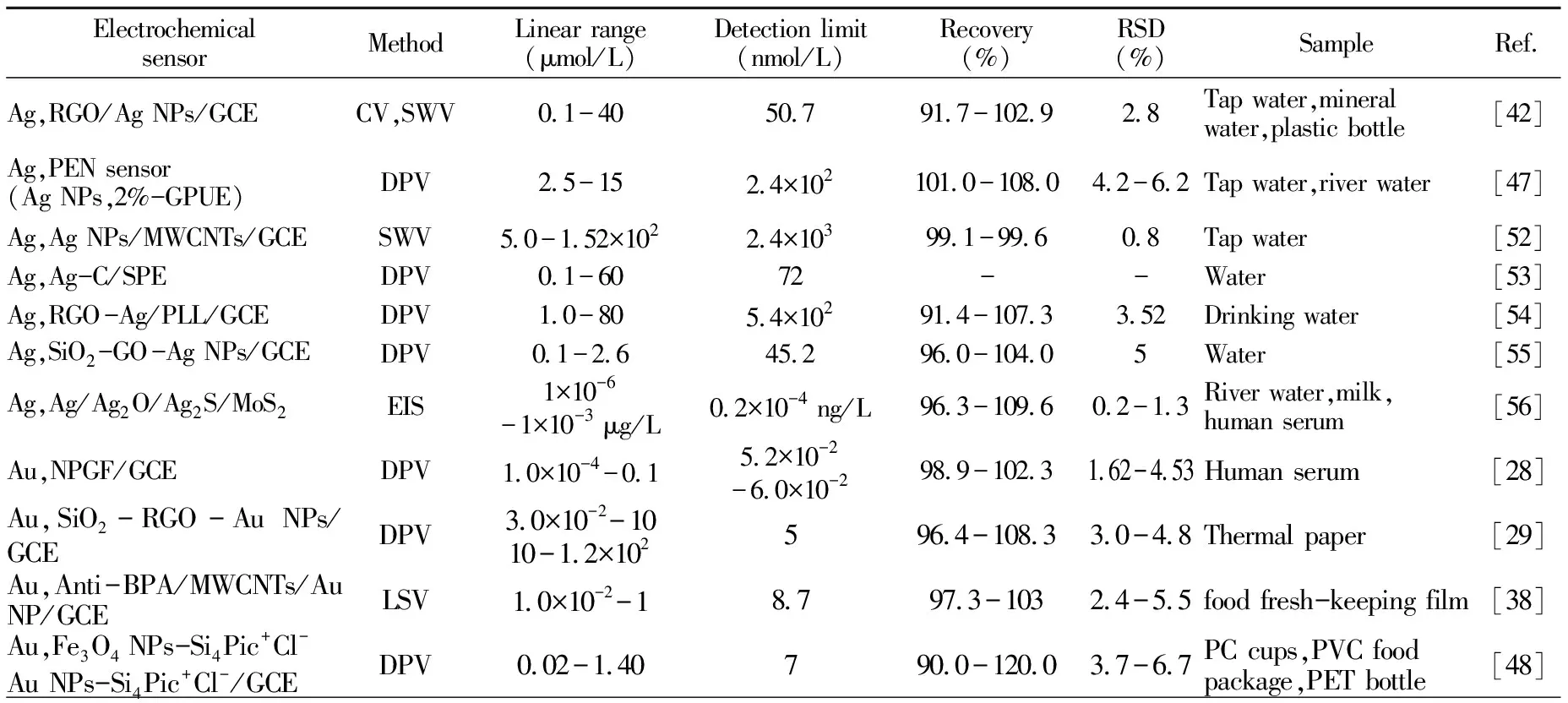
表1 金属复合材料基电化学传感器的种类及其BPA检测性能比较
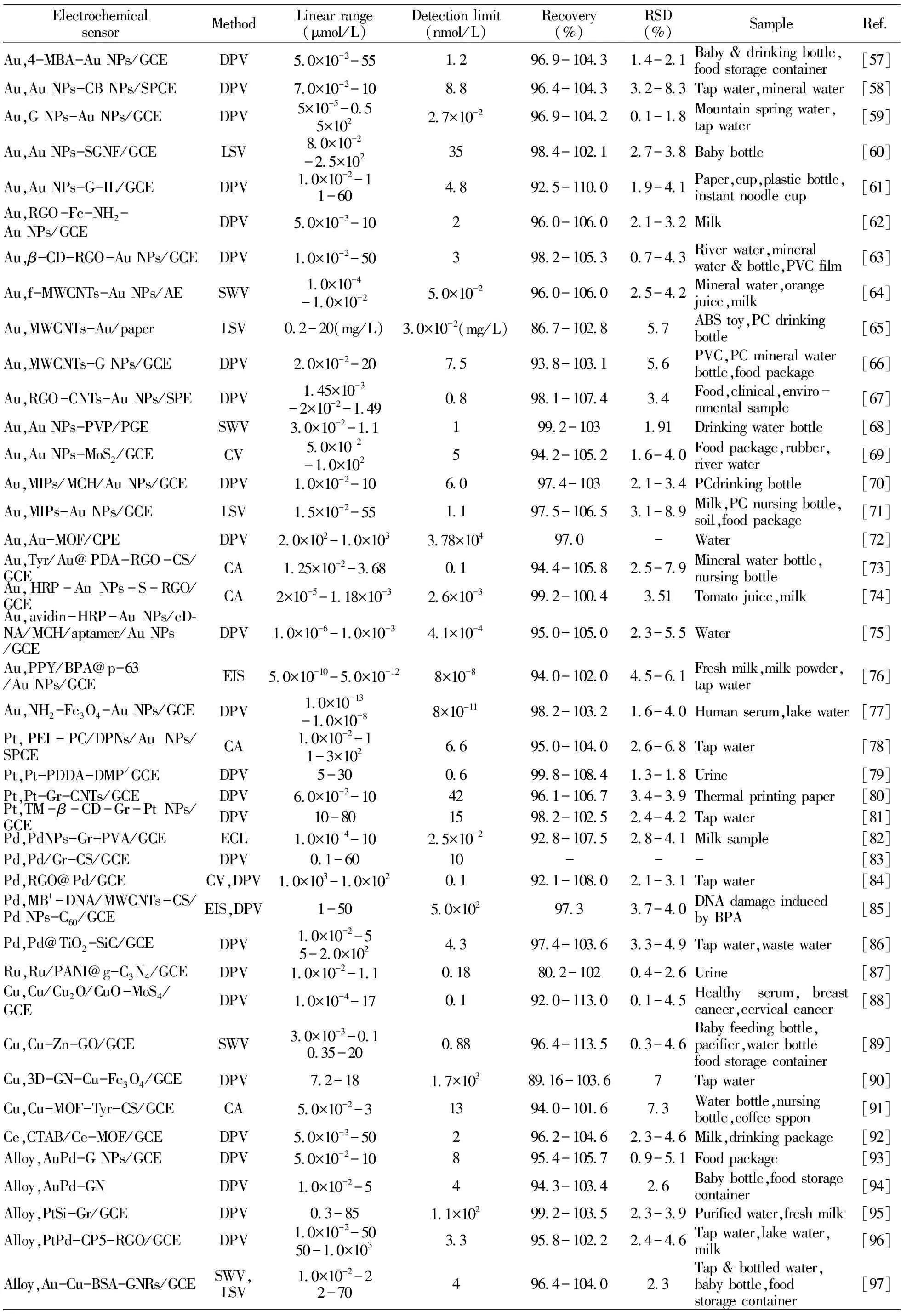
(续表1)
3.1 贵金属复合材料
3.1.1 Ag纳米材料碳纳米结构材料通常具有导电性高、表面积大、孔隙结构发达和理化性能稳定等特点,与Ag纳米材料复合可提高传感器的BPA响应活性、稳定性和灵敏度[42,47,50 - 56]。Goulart等[52]将多壁碳纳米管(MWCNTs)与Ag NPs复合,并修饰在玻碳电极(GCE)上构建了Ag NP/MWCNTs/GCE电化学传感器。与裸GCE相比,该传感器具有较低的界面电荷转移阻抗和较大的响应信号,采用SWV法检测BPA的线性范围为5~152 μmol/L,检出限为2.4×103nmol/L,并具有良好的稳定性和重复性。此外,该传感器还可同时测定自来水中的对苯二酚、邻苯二酚、苯酚和BPA。
Dong等[53]采用水热合成了“核-壳”结构的碳包覆Ag NPs复合材料,并修饰丝网印刷电极(SPE)构建了Ag-C/SPE传感器。调控碳壳层厚度可以在提高BPA吸附能力的同时,不影响Ag NPs与BPA接触发生氧化反应,以DPV法检测BPA的线性范围为0.1~60 μmol/L,检出限为72 nmol/L。此外,基于BPA和聚-L-赖氨酸(PLL)可形成氢键的思路,Li等[54]构建了一种基于还原氧化石墨烯(RGO)的Ag NP/PLL复合材料RGO -Ag-PLL/GCE传感器,在降低复合材料的接触电阻的同时,提高了BPA的富集效率。以DPV法检测BPA的线性范围为1~80 μmol/L,检出限为5.4×102nmol/L。
Song等[56]采用不同温度褪火处理Ag+掺杂的磷钼酸(H3PMo12O40)的方法制备了Ag-PMo12异质结材料。其中,600 ℃褪火产物为含Ag、Ag2O、Ag2S和超薄MoS2纳米片的多组分纳米杂化物(Ag/Ag2O/Ag2S/MoS2(600))。由其构建的适配子生物传感器具有良好的电化学性能、生物相容性及BPA吸附能力。检测BPA的线性范围为1.0×10-6~1.0×10-3μg/L,检出限低至2.0×10-4ng/L。该异质结传感器在河水、牛奶和人血清等样品的BPA检测中获得了超高的灵敏度、高选择性,以及良好的稳定性、重现性和不同情况下的适用性。究其原因在于BPA可通过与Ag/Ag2O/Ag2S/MoS2(600)的堆积作用、范德华力,以及金属氧化物或硫化物与生物样的DNA适配子间的配位作用,使得其具有优异的BPA电化学传感性能。
3.1.2 Au纳米材料与Ag相比,Au纳米材料的稳定性和生物兼容性更好,以之作为电催化材料可以有效提高传感器的灵敏度、稳定性和生物相容性[28,29,38,48,57 - 77]。Au电极修饰材料的性能优化方向之一是通过微结构调控增大比表面积和提高BPA的吸附量。纳米多孔金膜(NPGF)因具有双连续纳米孔、空隙空间和支架互连,以及机械刚性、化学稳定性和生物相容性等优点而广泛用于电催化领域。Zhu等[28]将Au/Ag合金叶片中的Ag脱溶制得NPGF,构建了NPGF/GCE传感器,并与BPA特异性适配子形成Au-S 键进行官能化,采用DPV法检测BPA的线性范围为1.0×10-7~1.0×10-4μmol/L,检出限低至5.6×10-2nmol/L。该传感器成功用于人体血清BPA高灵敏检测,显示其在临床诊断中的应用潜力。
为优化Au NPs的电催化活性,往往将其与碳纳米结构材料复合[58 - 67]。Messaoud等[58]将炭黑纳米颗粒(CB NPs)和Au NPs复合,并在丝网印刷碳电极(SPCE)上构建了Au NPs-CB NPs/SPCE传感器,采用DPV法检测BPA的线性范围为7.0×10-2~10 μmol/L,检出限为8.8 nmol/L。Cheng等[67]将氧化石墨烯-碳纳米管(GO/CNTs)复合材料在SPE上还原为RGO/CNTs,然后构建了RGO -CNT-Au NPs/SPE传感器,以DPV法检测BPA的线性范围分为1.45×10-3~2.0×10-2μmol/L和2.0×10-2~1.49 μmol/L两段,检测限为0.8 nmol/L,且苯酚、对硝基苯酚、邻苯二酚、2,4-二硝基苯酚和对苯二酚等共存不影响传感器响应,有望投入实际使用。
防止纳米颗粒聚集是该类修饰电极另一重要的研究方向[68 - 72]。将Au NPs修饰到吸附能力强或高比表面积的有机聚合物或无机载体表面可有效提高传感器的稳定性。Yaman等[68]将水溶性聚乙烯吡咯烷酮(PVP)用于在铅笔石墨电极(PGE)表面电沉积Au NPs的稳定剂,构建了一种新型的Au NP-PVP/PGE传感器。采用SWV法获得了BPA的超灵敏测定,线性范围为3.0×10-2~1.1 μmol/L,检出限低至1 nmol/L。分子印迹聚合物(MIPs)是对特定分子(印迹分子、模板分子)具有专一识别及结合作用的一类有机高分子。Zhao等[71]在GCE上电沉积Au NPs后,自组装4-氨基苯硫酚(4-ATP),然后以壳聚糖为双功能单体,在BPA共存条件下,采用CV法电聚合形成MIPs,构建了MIPs-Au NPs/GCE电化学传感器,有效地增加了MIPs的比表面积,获得更多的BPA识别位点。采用LSV法检测BPA的线性范围为1.5×10-2~55 μmol/L,检出限为1.1 nmol/L。利用SiO2具有比表面积大、吸附能力强、结构稳定性和催化位点丰富等特点。Liu等[29]采用溶胶-凝胶法合成SiO2微球,然后修饰RGO -Au NPs构建了SiO2-RGO -Au NPs/GCE电化学传感器,采用DPV法检测BPA的线性范围为3.0×10-2~10 μmol/L,检出限为5 nmol/L。此外,在高比表面积的金属有机框架(MOFs)化合物表面负载Au PNs 也获得了相对较宽的检测范围。Silva等[72]用(3-氨基丙基)三乙氧基硅烷硅烷化的Al2O3纳米晶体构筑MOFs,然后负载Au NPs,并修饰在碳糊电极(CPE)上构建了Au-MOF/CPE电化学传感器,采用DPV法检测BPA的线性范围为2.0×102~1.0×103μmol/L,检出限为3.78×104nmol/L。
除水溶性聚合物、分子印迹聚合物、碳纳米结构材料和多孔无机材料之外,生物材料如抗体或适配子等生物分子、酪氨酸酶(Tyr)、辣根过氧化物酶(HRP)、牛血清白蛋白(BSA)也被用作识别单元增强传感器的BPA选择性[73 - 77]。Xu等[73]利用聚多巴胺(PDA)诱导Au NPs在RGO上原位生长合成了Au@PDA-RGO,然后借助壳聚糖(Chit)将酪氨酸酶负载到GCE上构建了一种电化学生物传感器(Tyr/Au-PDA-RGO -Chit/GCE)。该传感器具有高导电性、大的活性面积和适宜的生物微环境,采用CA法检测BPA的线性范围为1.25×10-2~3.68 μmol/L,检出限为0.1 nmol/L。Liu等[75]将链霉亲和素修饰的HRP功能化Au NPs(avidin-HRP-Au NP)修饰GCE,然后通过自组装固定硫醇化的BPA适配子,并与生物素修饰的互补DNA探针(cDNA)杂交成双链DNA,在BPA及其适配子(Aptamer)间发生高度特异性的相互作用后,cDNA从电极表面释放,并将BPA固定在传感器界面。BPA可以为所构建的无标记的适配子生物传感器(avidin-HRP-Au NP/cDNA/MCH/aptamer/Au NPs/GCE)提供额外的信号转换,即使在100倍浓度的干扰物存在下,对BPA仍显示良好的选择性。采用DPV法检测的线性范围为1.0×10-6~1.0×10-3μmol/L,检出限低至4.1×10-4nmol/L。此外,Zhao等[77]将MWCNTs、胺基化磁铁矿和Au NPs复合材料修饰在GCE上,然后与互补DNA杂交将BPA适配子加载到传感器上,构建了NH2-Fe3O4-Au NPs/GCE适配子传感器。该传感器具有增强的选择性和灵敏度,采用DPV法检测BPA的线性范围为1.0×10-13~1.0×10-8μmol/L,检出限为8.0 ×10-11nmol/L,为迄今报道的最低值。
3.1.3 Pt系金属纳米材料Pt系金属作为电催化材料尽管成本较高,但因其具有良好的电化学性能而广泛用于电化学领域。其中,Pt、Pd、Ru基金属材料在电化学传感器检测BPA领域应用较多[78 - 87]。Shim等[78]制备了高比表面积的树枝状Pt NPs(DPNs),并将其涂覆在Au NPs修饰的SPCE表面,然后覆盖一层聚乙烯亚胺(PEI)-磷脂酰胆碱(PC)保护层,所构建PEI-PC/DPNs/Au NPs/SPCE传感器有效避免了乙酰氨基酚、尿酸和多巴胺等的干扰,提高了修饰电极的灵敏度。以CA法检测BPA的线性范围分为1.0×10-2~1 μmol/L和1.0~3.0×102μmol/L两段,检出限为6.6 nmol/L。
与Ag、Au类似,碳纳米结构材料也被广泛用于提高Pt系金属复合材料的电催化活性、稳定性、选择性和灵敏度[79 - 81]。Zheng等[80]开发了夹心结构的石墨烯-碳纳米管(Gr-CNTs)复合材料。其中,CNTs可弥合缺陷促进电子转移,并防止Gr的不可逆聚集。将Pt NPs负载到该Gr-CNTs复合材料上,并修饰GCE构建了Pt-Gr-CNTs/GCE传感器,采用DPV法检测BPA的线性范围分为6.0×10-2~10 μmol/L和10~80 μmol/L两段,检出限为42 nmol/L。Zou等[81]合成了由七-(2,3,6-三-O -甲基)-β-环糊精(TM-b-CD)官能化的Gr/PtNPs构建了TM-b-CD/Gr-Pt NPs/GCE传感器,采用DPV法检测BPA的线性范围为5.0×10-2~80 μmol/L,检出限为15 nmol/L。类似地,Pd纳米材料通常也与碳纳米结构材料复合以提高其电催化活性、稳定性和选择性[82 - 85]。Hu等[82]将合成的Pd NPs-Gr复合材料分散在聚乙烯醇(PVA)中制备了Pd NPs-Gr/PVA复合材料,并修饰在GCE上构建了Pd NPs-Gr-PVA/GCE电化学传感器,采用电化学发光法(ECL)检测BPA的线性范围为1.0×10-4~10 μmol/L,检出限为2.5×10-2nmol/L。朱培杰等[84]以RGO -Pd复合材料(RGO@Pd)修饰电极,BPA为模板分子,吡咯为单体制备出BPA分子印迹电化学传感器。采用CV法和DPV法考察了该传感器的电化学性能,峰电流与BPA浓度在1.0×10-3~10 μmol/L范围内呈良好线性关系,检出限为0.1 nmol/L。
一般而言,碳基材料较高的背景电流不利于传感器灵敏度的改善,因此人们探索将金属纳米颗粒负载到非碳载体上。Yang等[86]采用原位生长策略成功地制备了具有增强的电化学性能的TiO2-SiC纳米复合材料,并利用化学还原法在其表面形成2.3 nm的单分散Pd NPs,然后修饰到GCE上构建了Pd-TiO2-SiC/GCE电化学传感器,可同时测定对苯二酚(HQ)和BPA,以DPV法检测HQ和BPA时的线性范围均分为1.0×10-2~5 μmol/L和5.0~2.0×102μmol/L两段,HQ和BPA的检出限分别为5.5 nmol/L和4.3 nmol/L。类似地,Ponnaiah等[87]超声合成了由Ru NPs、聚苯胺和氮化碳组成的新型纳米复合材料,并修饰到GCE上构建了Ru-PANI-g-C3N4/GCE电化学传感器,采用DPV法检测BPA的线性范围为1.0×10-2~1.1 μmol/L,检出限为0.18 nmol/L。与前述的Pt-PDDA-DMP/GCE相比[79],PANI-g-C3N4/GCE具有更低的检出限,更适于痕量物质分析。
3.2 非贵金属复合材料
与贵金属相比,非贵金属纳米材料具有丰度高、成本低、氧化态多变和过电位低等优点,但用于BPA电化学传感器的研究并不多见。从目前的报道来看,主要为Cu纳米材料[88 - 92]。Ashraf等[88]合成了Cu/Cu2O/CuO -MoS4纳米复合材料,并修饰在GCE上构建了Cu/Cu2O/CuO -MoS4/GCE电化学传感器,采用DPV法检测BPA的线性范围为1.0×10-4~17 μmol/L,检出限低至0.1 nmol/L。
采用GO或多孔材料分散金属纳米颗粒,并可提供额外的电催化位点[89 - 92]。例如,Karabiberoglu等[89]基于Cu-CuO和ZnO负载的GO修饰的GCE,构建了Cu-Zn-GO/GCE电化学传感器,采用SWV法检测BPA的线性范围为0.35~20 μmol/L,检出限为0.88 nmol/L。Lou等[90]将Fe3O4和Cu NPs负载到三维(3D) Gr上构建了3D -Gr-Cu-Fe3O4/GCE电化学传感器,采用DPV法检测BPA的线性范围为7.2~18 μmol/L,检出限为1.7 nmol/L。Wang等[91]合成了Cu-MOF金属有机框架化合物,选择酪氨酸酶(Tyr)作为超灵敏和快速检测BPA的模型酶,构建了Cu-MOF-Tyr-Chit/GCE生物传感器,采用CA法检测BPA的线性范围为5.0×10-2~3 μmol/L,检出限为13 nmol/L。此外,Zhang等[92]采用以十六烷基三甲基溴化铵(CTAB)修饰的Ce -MOF作为传感平台,并修饰到GCE上构建CTAB-Ce-MOF/GCE电化学传感器,该传感器对BPA氧化过程表现出高电化学响应。采用DPV法检测BPA的线性范围为5.0×10-3~50 μmol/L,检出限为2 nmol/L。
3.3 合金复合材料
单一金属纳米材料由于某些氧化物中间体在其表面的吸附而易导致中毒,阻碍了其在电化学传感器中的实际应用。为应对这一挑战,可将贵金属合金化,通过发挥两种金属之间的协同催化作用抑制中毒效应和降低贵金属用量,但合金材料在BPA电化学传感器检测中的研究报道并不多见。目前,合金成分仍然为贵金属,如AuPd、PtPd等[93 - 98]。Su等[93]将AuPd NPs负载到石墨烯纳米片(GNs)上,并构建了AuPd NPs-GNs/GCE传感器。与单金属Pd或Au NPs负载的GNs相比,AuPd合金传感器具有较低的过电势。采用DPV法检测BPA的线性范围为5.0×10-2~10 μmol/L,检出限为8 nmol/L。
Huang等[94]将GO、HAuCl4、K2PdCl4共还原制备合金Au3Pd NPs-GN复合材料,并修饰在GCE上构建了Au3Pd NPs-GN/GCE电化学传感器,与单金属Pd NPs和体相Pd相比,合金Au3Pd传感器具有更高的电催化活性,采用DPV法检测BPA的线性范围为1.0×10-2~5 μmol/L,检出限为4 nmol/L。Zhang等[95]将三维PtSiAl合金脱铝,制备了三维纳米多孔PtSi合金(NP-PtSi),将其与Gr结合构筑了一种新型传感器,采用DPV法检测BPA的线性范围为1.0×10-2~5 μmol/L,检出限为4 nmol/L。
合金材料也可与有机或生物材料结合,提高其稳定性、灵敏度和选择性。Liang等[96]合成了阳离子柱状芳烃(CP5)修饰的RGO,然后负载PtPd NPs,并修饰到GCE上构建了PtPd-CP5-RGO/GCE传感器,采用DPV法检测BPA的线性范围分为1.0×10-2~50 μmol/L和50~1.0×103μmol/L两段,检出限为3.3 nmol/L。Mahmoudi等[97]合成了牛血清白蛋白(BSA)模板化的Au-Cu双金属纳米团簇(Au-Cu@BSA),与石墨烯纳米带(GNRs)混合,并负载到GCE上构建了Au-Cu-BSA-GNRs/GCE电化学传感器,采用SWV法检测BPA的线性范围分为0.01~2.0 μmol/L和2.0~70 μmol/L两段,检出限为4 nmol/L。
4 总结与展望
电化学传感器具有操作简便、灵敏度高、选择性好、仪器便携和便于现场自动化监测等优点,特别适于BPA的快速、高效检测。与贵金属相比,非贵金属具有成本低的优点,但目前用于电化学传感器的非贵金属并不多见。未来有必要通过微结构调控增大贵金属及其合金的比表面积以提高BPA的富集能力,以及探索提高和改善非贵金属的电催化性能和稳定性的新途径。
针对金属纳米材料的分散性较差和易团聚问题,人们采用碳纳米结构材料负载和稳定金属纳米粒子以提高传感器的稳定性和重现性,但其通常具有较高的背景电流而不利于灵敏度的改善。因此,人们探索将金属纳米粒子负载到非碳载体,如无机多孔材料、分子印迹聚合物、金属有机框架化合物等。此外,生物类材料(如抗体或适配子等)已被用作识别单元增强传感器的BPA选择性。其中,适配子作为抗体和肽的替代品,相对而言更易批量生产,免疫反应更少,体积更小,因此作为生物传感器的生物识别元件更具优势。在制备金属复合材料时,应充分利用各组成材料的优点,协同提高复合材料的电催化活性、稳定性和吸附能力,获得宽检测范围、高灵敏度和重现性。
随着电化学传感器、免疫电化学传感器BPA检测技术的逐步发展与完善,其检测精确度有望与GC-MS和LC-MS法媲美。与此同时,电化学传感器在牛奶、橙汁、矿泉水、食品和生物样本等实际检测中的稳定性、抗干扰能力和可重复性也会得到进一步提升,并投入实际使用。将在实现BPA的高精度检测和临床诊断应用,在保护环境、保障食品和生命健康安全等方面发挥愈加重要的作用。
