2型糖尿病合并亚临床甲减状态的危险因素及机制研究
2021-07-14朱凤平叶山东
朱凤平 黄 斌 叶山东
糖尿病和甲状腺疾病均属于临床常见的内分泌疾病,两者具有相互促进、相互影响的关系。研究表明糖尿病患者并发甲状腺功能异常的几率为非糖尿病患者的2倍以上,其中亚临床甲减状态最为常见,流行病学结果提示2型糖尿病(T2DM)患者中亚临床甲减(SCH)发病率在2.2%~17%[1]。有大量研究表明亚临床甲减可进一步导致代谢相关脂肪性肝病(MAFLD)、高尿酸血症在内的多种代谢异常,加快T2DM患者慢性并发症的进展[2]。然而目前的研究主要关于甲状腺激素对肝脏脂肪沉积、胰岛素抵抗、高尿酸血症等代谢相关指标的影响[3],而这些糖、脂代谢异常改变是否会反馈调节甲状腺的功能状态,少有人研究。本文通过分析影响2型糖尿病合并亚临床甲状腺功能减退的危险因素,了解其中潜在的病理机制,为后期积极预防治疗提供理论依据。
1 资料与方法
1.1 一般资料 选取2017年4月-2020年10月我院内分泌科收治的47例T2DM合并亚临床甲减患者,性别年龄匹配49例甲状腺功能正常的T2DM患者。96例研究对象平均年龄(57.54±10.06)岁,男性44例、女性52例,病程中位数4年,HbA1c(9.12±2.28)%,BMI(24.12±3.40)kg/m2。排除标准:饮酒,男>140 g/周或女>70 g/周,或合并其他可导致脂肪性肝病的特定疾病;近期服用过治疗甲状腺疾病药物;既往痛风病史和(或)近半年内应用影响尿酸生成与排泄的药物;合并严重肝、肾功能不全;妊娠期妇女;病历资料不全等。入院后当日采集病史并记录包括年龄、BMI、糖尿病病程以及是否使用二甲双胍、噻唑烷二酮药物,入院后第2日晨起空腹静脉采血实验室送检糖化血红蛋白(HbA1c)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBILI)、直接胆红素(DBILI)、肌酐(Cr)、尿酸(UA)以及甲功三项:总三碘甲腺原氨酸(TT3)、总四碘甲腺原氨酸(TT4)、促甲状腺激素(TSH)。MAFLD诊断依据2020年国际脂肪肝专家小组发表的共识,其诊断基于代谢功能障碍的存在,可以与其他肝病共存,而不是排除其他肝病[4],由经验丰富且受过统一培训的超声医生完成肝脏超声并结合病例资料诊断。根据甲状腺功能分为亚临床甲减组和甲功正常组(对照组)后统计分析两者差异。
1.2 细胞实验 HepG2细胞胰酶消化后,6孔板培养贴壁。次日无血清的培养基饥饿24 h。细胞分组:换上含完全培养基为对照组(Control);含300 uM的 PA的完全培养基模拟糖尿病合并脂肪肝体外模型组(PA组);添加750 uM的UA以及300uM的PA的完全培养基作为干预组(PA+UA),继续培养24 h,收集细胞的总蛋白、western blot检测T-AMPK以及P-AMPK表达情况。
1.3 统计学方法 所有数据均采用SPSS 22.0统计学软件处理,符合正态分布的数据均数±标准差(±s)表示,两组均数间比较采用t检验;非正态分布计量数据采用[M(P25,P75)]表示,两组间比较采用秩和检验;计数资料以比例或百分率表示,组间比较采用卡方检验。将单因素有统计学意义的指标,采用logistic逐步回归(向前,LR)进行判别分析,确定亚临床甲减的相对独立影响因素。两组非正态分布数据采用Spearman检验两者相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 两组研究对象一般资料比较 与甲功正常组相比,亚临床甲减组具有更高的BMI、MAFLD患病率、尿酸、总三碘甲状腺原氨酸T3以及更低的HBA1C,差异均具有统计学意义(P<0.05)。其余包括性别、年龄、病程、二甲双胍使用率、噻唑烷二酮类使用率、谷丙转氨酶、谷草转氨酶、肌酐、总胆红素、直接胆红素和总甲状腺素T4,两组差异均无统计学意义(P>0.05),见表1。

表1 两组研究对象一般资料比较
2.2 影响T2DM患者亚临床甲减状态的多因素分析 将以上单因素分析P值小于等于0.05的因素以及性别、年龄作为自变量进行多因素逐步回归分析。将以下线性资料三分类:BMI(kg/m2)(T1≤24;24<T2≤28;T3>28);HBA1C(T1≤7%;7%<T2≤9%;T3>9%);血尿酸(umol/L)(T1≤264;264<T2≤346;T3>346);总三碘甲腺原氨酸(nmol/L)(T1≤1.51;1.51<T2≤1.79;T3>1.79),采用多元逐步逻辑回归(向前,LR)分析,结果提示:MAFLD较无MAFLD患者亚临床甲减风险增加约18%(OR=1.18,95%CI 1.037~1.342,P=0.012);相较于尿酸≤264 umol/L患者,264 umol/L<尿酸≤346 umol/L、尿酸>346 umol/L亚临床甲减风险分别增加了18.1%以及23.5%,趋势性检验提示随着尿酸水平增加,亚临床甲减风险同步升高(P=0.040),见表2。

表2 影响T2DM患者亚临床甲减状态的多因素分析
2.3 以是否合并MAFLD的亚组分析 交互性检验提示MAFLD与UA存在交互作用(P=0.037),进一步以是否合并MAFLD进行亚组分析发现:合并MAFLD患者对甲状腺功能的影响受到UA水平的显著影响(P=0.040),而在非MAFLD人群中未发现类似现象。见表3。

表3 是否合并MAFLD的亚组分析
2.4 MAFLD患者UA与甲状腺功能的相关性研究 Spearman相关分析结果示:在糖尿病合并MAFLD患者中,UA与TT3(r=0.288;P=0.0033,见图1A)、TSH(r=0.530;P<0.001,见图1C)呈明显正相关,但与TT4无明显相关关系(见图1B)。
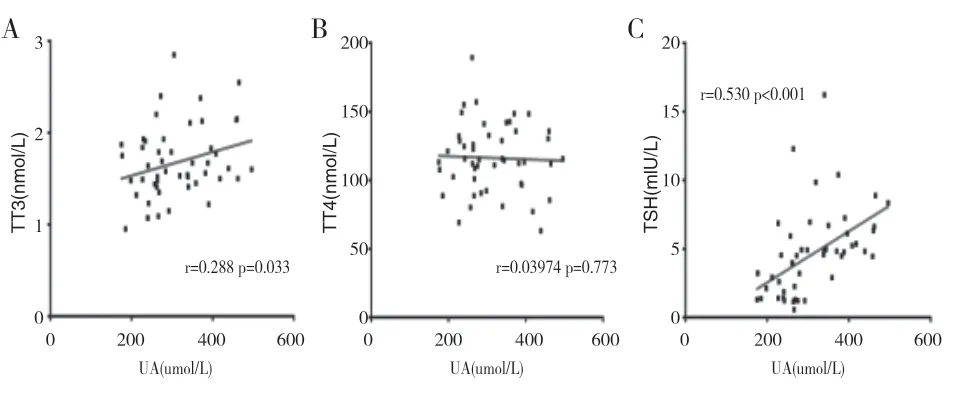
图1 MAFLD患者UA与甲状腺功能的相关性研究
2.5 尿酸对脂肪肝合并糖尿病模型AMPK的影响 合并MAFLD患者对甲状腺功能的影响受到UA水平的显著影响,为进一步明确其中潜在机制,本研究采用PA处理HepG2细胞体外模型,随后UA干预24 h检验代谢关键分子AMPK,结果提示PA处理后UA处理后可进一步抑制P-AMPK活化,影响细胞能量感知传递。见图2。

图2 尿酸对脂肪肝合并糖尿病模型AMPK的影响
3 讨 论
目前关于甲状腺功能和MAFLD的研究均聚焦在甲状腺对肝脏脂肪沉积以及MAFLD不良进展,而作为全身代谢中心的肝脏,其脂肪沉积后引起的糖脂能量代谢的改变是否会反馈调节甲状腺的功能状态,极少有人研究。之前发表数据表明在甲功正常的T2DM合并MAFLD患者中TSH以及FT3水平明显高于非MAFLD患者,提示MAFLD有类似甲状腺抵抗样的激素改变,进一步亚组分析示AMPK激动剂二甲双胍使用后可改善这种甲状腺抵抗样表现[5]。
本研究通过校正相关混杂因素后结果发现:T2DM患者合并MAFLD较无MAFLD亚临床甲减风险增加约18%;相较于尿酸≤264 umol/L患者,264 umol/L<尿酸≤346 umol/L、尿酸>346 umol/L亚临床甲减风险分别增加了18.1%以及23.5%。甲状腺功能减退后引起高尿酸血症目前已有大量研究证实,其机制可能为由于甲状腺功能不全患者处于一种低代谢状态,尿酸的产生虽然减少,但此时肾血流量亦减少,导致肾小球滤过率下降,其排泄大大减少,从而造成血尿酸升高[6]。笔者查阅近年相关文献鲜有UA对甲状腺功能影响的报道。本研究交互性检验结果提示尿酸部分介导了MAFLD对甲状腺功能的影响,相关性分析结果提示在MAFLD人群中UA与TT3以及TSH有明显正相关关系,提示UA可能通过MAFLD引起甲状腺激素抵抗样表现。研究表明UA可通过激活NF-κB引起系统炎症[7];AMPK是细胞内最重要的能量感受器,甲状腺激素可通过激活肝细胞内的AMPK通路加快能量代谢[8]。体外试验发现750uM UA处理HepG2细胞可激活NLRP3诱导细胞内脂质沉积[9]。在脂肪组织中,UA通过抑制AMPK的活化参与脂肪组织代谢异常,经二甲双胍治疗可逆转此病理过程。综合以上研究,MAFLD患者中,UA是否可通过抑制AMPK活化而引起甲状腺功能作用异常,引起类似甲状腺激素抵抗样表现的TSH及TT3的升高,为此本研究采用PA诱导HepG2作为糖尿病合并MAFLD的体外模型,通过UA干预后发现,P-AMPK表达进一步下降,提示细胞能量感受器出现异常,可能与甲状腺激素作用受限有关。
综上所述,UA升高以及合并MAFLD是T2DM患者罹患亚临床甲减的相对独立危险因素,并且MAFLD对甲状腺功能的影响受到UA水平的显著影响,可能系UA加重AMPK通路受损有关。考虑到本试验系回顾性研究,样本量较小且超声评估脂肪肝存在一定的假阴性,并且无法详尽纳入潜在的混杂变量,因此结果可能存在一定的偏倚,后期需大样本的随机双盲临床对照试验以及进一步的分子机制实验进一步明确UA、脂肪肝以及甲状腺功能的互作关系。
