复配酶酶解对燕麦浊汁的稳定性研究
2021-07-13张晓旻刘靓刘敏尧郭梅
张晓旻,刘靓,刘敏尧,郭梅*
(1.天津农学院食品科学与生物工程学院,天津 300384;2.天津诺奥酶生产力促进有限公司,天津 300399)
燕麦(Avena sativa L.)为禾本科植物,《本草纲目》中称之为雀麦、野麦子。燕麦分为带稃型(皮燕麦)和裸粒型(裸燕麦)两种。俄罗斯、加拿大、波兰、美国、中国、澳大利亚是燕麦的主要种植国[1]。国外主要种植皮燕麦,我国栽培的燕麦以裸燕麦为主。燕麦作为重要粮食之一,在全世界谷物产量中仅次于小麦、水稻、玉米、大麦和高粱,排名第六。
燕麦是一种“食疗兼备”作物,被誉为“九粮之尊”,它是一种全价营养谷物,在蛋白质、脂肪、维生素、矿物元素、膳食纤维等五大营养物质的指标中,位居我国9种粮食作物(小麦、水稻、谷子、玉米、大麦、荞麦、高粱、黄米、燕麦)之首[2]。燕麦性味甘、平,能益脾养心、敛汗,有较高的营养价值。燕麦富含β-葡聚糖、蛋白质、亚油酸和膳食纤维等成分,且富含人体所必需的8种氨基酸,营养均衡,对于人体补充营养与保持健康有很大的利用价值。燕麦在辅助降血糖、降血压、减肥保健、预防直肠癌及心血管疾病等方面具有世界公认的保健作用[3-5]。
目前,我国已开发研制的燕麦制品主要包括燕麦片、燕麦粉、燕麦面包、燕麦米、燕麦饼干、燕麦挂面等[6-9],但市场上主要以燕麦片的形式销售。燕麦作为学生党和上班族的营养谷物早餐,也是中老年人减肥保健食品最主要的替代餐,其产品形式单一,适口性较差。近年来,燕麦新产品加工是粮食加工的一个新研究方向[10-11],具有良好的发展前景,符合广大消费者的需求,尤其以燕麦为原料的谷物饮品是重点研究方向之一[12-15]。
在欧洲、美国和日本,燕麦制成的纯谷物饮料是较为常见的,例如燕麦奶、燕麦甜酒、有机燕麦饮料等产品。但是燕麦饮料的制备比较困难,稳定性较差。在燕麦汁的加工中,燕麦中的淀粉很容易与β-葡聚糖形成胶体[16],再加上淀粉在储藏过程中也容易出现老化,形成团块,会造成燕麦饮料质地不均匀、食用风味变劣等一系列问题[17]。国内对燕麦饮品的研究也有报道,其主要工艺是将淀粉酶解成小分子,现有酶解工艺的研究大多局限于单一酶的应用研究[18-20],因此,本试验通过复配酶水解燕麦,探讨酶解程度对燕麦浊汁稳定性的影响,对其酶解工艺进行研究,从而能够制备出质地均匀、稳定性强、口感良好的燕麦浊汁饮品。
1 材料与方法
1.1 材料与仪器
燕麦:市购;α-淀粉酶(20 000 U/g)、葡糖淀粉酶(50 000 U/g)、支链淀粉酶(50 000 U/g):天津诺奥酶生产力促进有限公司。
电子天平(FA2004型):北京塞多利斯仪器有限公司;数显恒温水浴锅(HHS型):江苏金坛市金城国盛试验仪器厂;高速台式离心机(16WS型):湖南湘仪离心机仪器有限公司;胶体磨(MS型):廊坊正瑞机械有限公司。
1.2 试验方法
1.2.1 工艺流程
燕麦→浸泡→磨浆→过滤→蒸煮→液化→复配酶水解→灭酶→调配→均质→罐装→杀菌→冷却→成品
1.2.2 操作要点
1)浸泡:将燕麦原料清洗后,取50 g燕麦原料加250 mL水,在水浴锅中40℃浸泡2 h。
2)磨浆、蒸煮:燕麦和浸泡液通过胶体磨磨浆,控制加水量,料液比为 1∶9(g/mL),过 200目筛得到燕麦浊汁,再进行蒸煮使燕麦汁充分糊化。
3)液化、复配酶水解:燕麦汁温度降至80℃,加入高温α-淀粉酶[21-22],添加量0.1%,液化60 min。然后冷却降温再加入复配酶(葡糖淀粉酶与支链淀粉酶按质量比1∶1进行混合),考察不同复配酶添加量、酶解温度、酶解pH值、酶解时间4个因素对燕麦浊汁离心沉淀率的影响。
4)灭酶、调配、均质:酶解糖化后的燕麦浊汁升温至80℃,灭酶10 min。进行调配后,高压均质两次,压力分别为20 MPa和40 MPa。
5)灌装、杀菌、冷却:灌装到事先清洗过的玻璃瓶中,封口、杀菌后冷却至室温25℃。
1.2.3 离心沉淀率的测定
准确称取一定量样品置于离心管中,5 000 r/min下离心20 min,倾去上清液,将装有沉淀的离心管倒置30 min,准确称取沉淀质量,计算离心沉淀率(centrifugal sedimentation rate,SR)。每个样品进行3次平行测定,取其平均值,离心沉淀率越小则代表饮料的稳定性越好[18]。
SR/%=(M1/M2)×100
式中:M1为离心后沉淀物的质量,g;M2为离心前样品的质量,g。
1.2.4 单因素试验
1.2.4.1 复配酶添加量对燕麦浊汁离心沉淀率的影响
采用酶解温度50℃,酶解pH6.4,酶解时间60min,考察复配酶添加量为0.15%、0.20%、0.25%、0.30%、0.35%条件下燕麦浊汁的离心沉淀率。
1.2.4.2 酶解时间对燕麦浊汁离心沉淀率的影响
采用复配酶添加量0.25%,酶解温度50℃,酶解pH 6.4,考察酶解时间为 40、60、80、100、120 min 条件下燕麦浊汁的离心沉淀率。
1.2.4.3 酶解温度对燕麦浊汁离心沉淀率的影响
采用复配酶添加量0.25%,酶解pH6.4,酶解时间60 min,考察酶解温度为 45、50、55、60、65 ℃条件下燕麦浊汁的离心沉淀率。
1.2.4.4 酶解pH值对燕麦浊汁离心沉淀率的影响
采用复配酶添加量0.25%,酶解温度50℃,酶解时间 60 min,考察酶解酶解 pH 值为 5.6、6.0、6.4、6.8、7.2条件下燕麦浊汁的离心沉淀率。
1.2.5 正交试验
根据单因素试验的结果,进行L9(34)正交试验,确定出利用复配酶制取燕麦浊汁的最佳工艺参数。因素水平见表1。
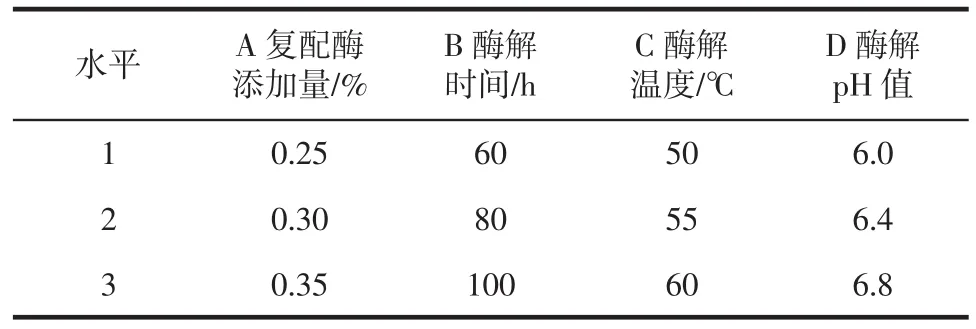
表1 正交试验因素水平设计Table 1 Factors and levels of orthogonal tests
1.3 数据处理
每个数据均为3次试验的平均值,使用EXCEL软件对数据进行统计分析并绘制图表。
2 结果与分析
2.1 复配酶添加量对燕麦浊汁离心沉淀率的影响
复配酶添加量对离心沉淀率的影响见图1。
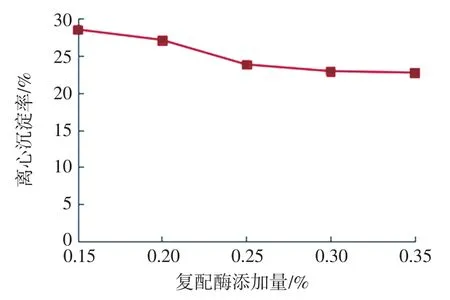
图1 复配酶添加量对离心沉淀率的影响Fig.1 Effects of the amount of compound enzymes on SR
由图1可知,燕麦浊汁离心沉淀率随着复配酶添加量的增加而逐渐降低。由于复配酶中的支链淀粉酶能分解支链淀粉分支处的α-1,6糖苷键,形成直链淀粉和糊精,糖化复配酶可同时水解α-1,4糖苷键和α-1,6糖苷键,淀粉被水解后提高了其溶解性。当酶用量超过0.30%时,离心沉淀率的变化开始趋于平缓,再提高复配酶添加量对燕麦浊汁离心沉淀率影响并不大。因此,可选择复配酶用量3个较优水平0.25%、0.30%、0.35%进行正交试验。
2.2 酶解时间对燕麦浊汁离心沉淀率的影响
酶解时间对离心沉淀率的影响见图2。
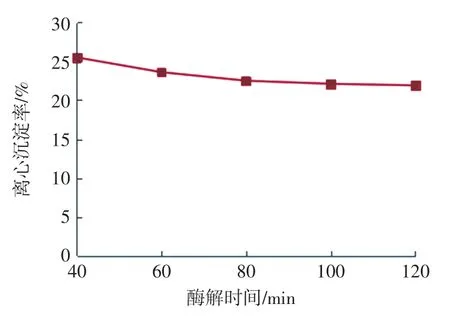
图2 酶解时间对离心沉淀率的影响Fig.2 Effects of enzymolysis time on SR
由图2可知,复配酶酶解时间越长,燕麦浊汁离心沉淀率不断减小,且速度越来越慢,原因是燕麦中的淀粉被连续水解,当酶解时间大于80 min时,离心沉淀率变化不大,酶解时间过长,对增加燕麦淀粉水解程度没有太大的效果,反而会影响生产效率,综合生产时间成本因素,故可选择酶解时间3个较优水平60、80、100 min 进行正交试验。
2.3 酶解温度对燕麦浊汁离心沉淀率的影响
酶解温度对离心沉淀率的影响见图3。
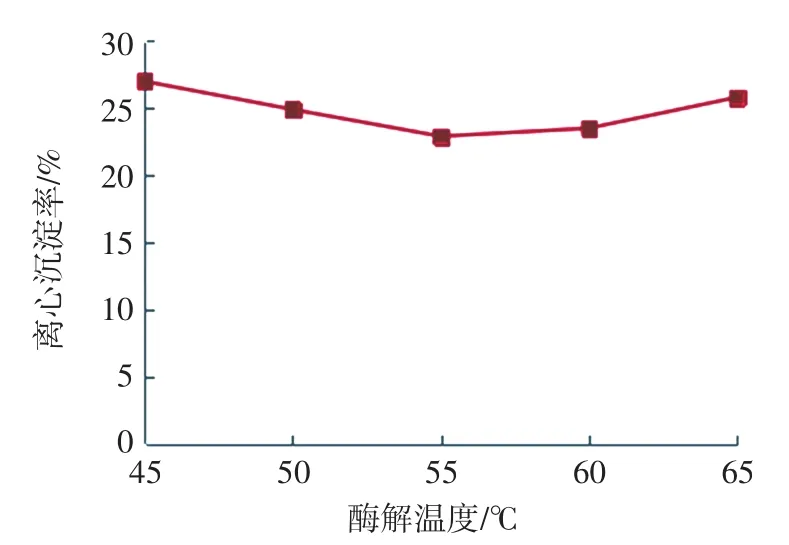
图3 酶解温度对离心沉淀率的影响Fig.3 Effects of enzymolysis temperature on SR
由图3可知,随着温度的升高,离心沉淀率先降低后升高,离心沉淀率在55℃时最小,燕麦浊汁的稳定性最好。可能是因为该复配酶的最佳酶解温度约在55℃,此时酶活性可以达到最大化,淀粉的水解程度较高,当酶解温度超过55℃后,再提高温度反而会影响部分酶的活性,从而降低复配酶的酶解能力。由此可知,酶解温度可选择3个较优水平50、55、60℃进行正交试验。
2.4 酶解pH值对燕麦浊汁离心沉淀率的影响
酶解pH值对离心沉淀率的影响见图4。
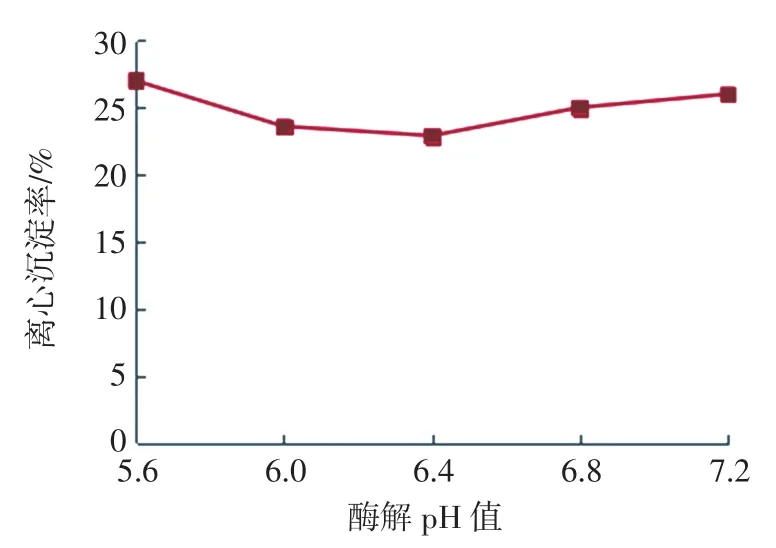
图4 酶解pH值对离心沉淀率的影响Fig.4 Effects of enzymolysis pH on SR
由图4可知,酶解pH 5.6~6.4时,随pH值的增加燕麦浊汁离心沉淀率呈下降趋势,在pH 6.4时达到最小,酶解pH6.4~7.2阶段时,离心沉淀率又趋于上升,分析原因可能是因为该复配酶在pH6.4时活性最高,而偏酸或偏碱都会使复配酶的活性受到不同程度影响。所以,酶解pH值可选择3个较优水平6.0、6.4、6.8进行正交试验。
2.5 正交试验结果
在单因素试验的基础上,根据L9(34)的正交表设计,进行四因素三水平的正交试验,确定出最佳工艺参数。正交试验结果见表2。
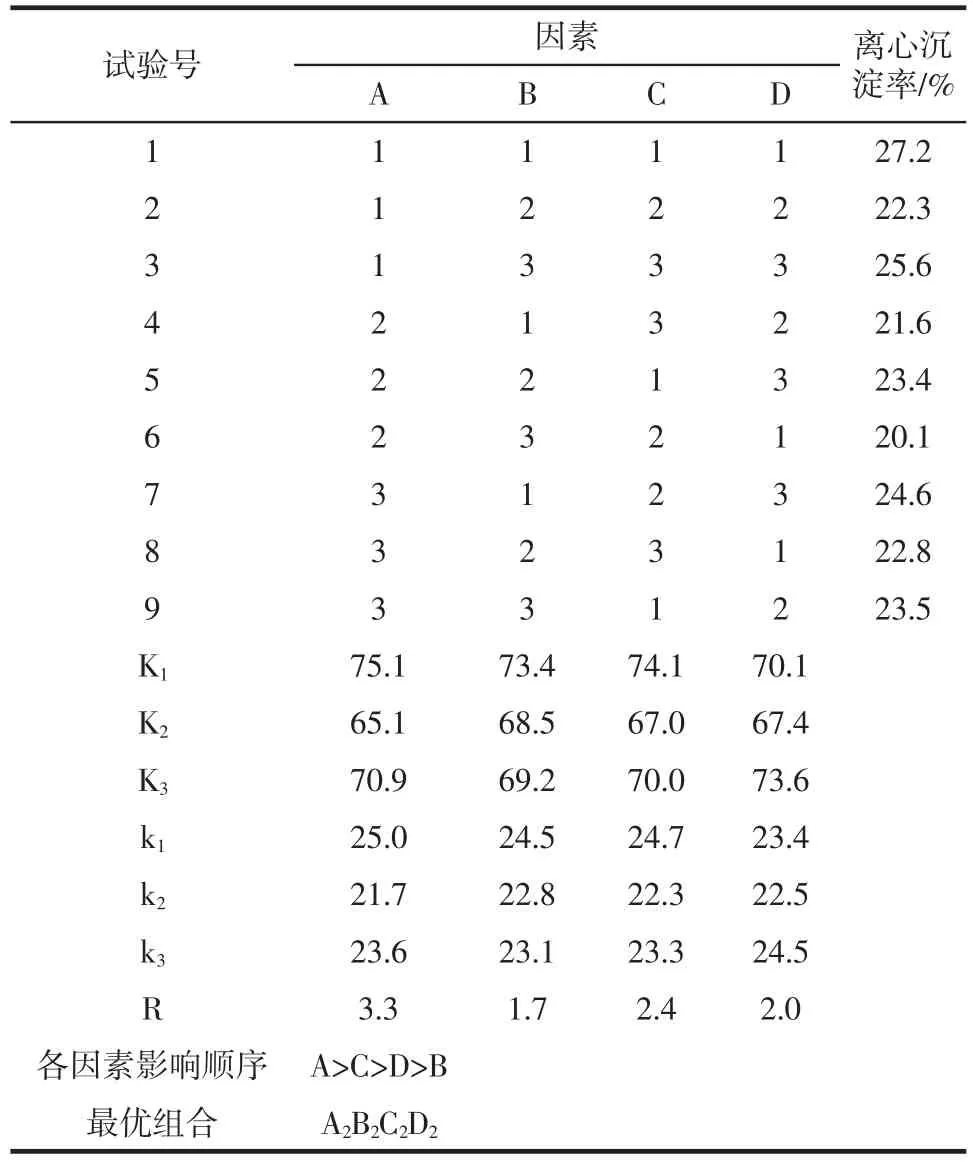
表2 正交试验结果Table 2 Results of orthogonal tests
由表2中的极差分析可知,影响燕麦浊汁离心沉淀率的因素主次顺序为:复配酶添加量>酶解温度>酶解pH值>酶解时间。最佳组合为A2B2C2D2,即复配酶添加量为0.30%,酶解pH值为6.4,酶解温度为55℃,酶解时间为80 min。采用A2B2C2D2工艺组合进行验证试验,重复3次,测得该组合离心沉淀率平均为17.6%。
3 结论
通过单因素试验初步考察了复配酶添加量、酶解pH值、酶解温度、酶解时间对燕麦浊汁稳定性的影响水平,再进行正交试验,确定了影响燕麦浊汁离心沉淀率的主次顺序:复配酶添加量>酶解温度>酶解pH值>酶解时间。最佳酶解工艺参数:复配酶添加量0.3%,酶解pH 6.4,酶解温度55℃,酶解时间80 min,此条件下,燕麦浊汁离心沉淀率为17.6%,稳定性最好。
