聚苯胺超分子水凝胶固定化果胶酶的研究
2021-07-13郝红英马金玲詹海鹃刘万毅毕淑娴
郝红英,马金玲,詹海鹃,刘万毅,毕淑娴
(宁夏大学化学化工学院,省部共建煤炭高效利用与绿色化工国家重点实验室,化学国家级实验教学示范中心,宁夏 银川 750021)
果胶酶是一种可以使果汁、果酒澄清,降低果胶加工过程中营养物质损耗的一种酶。降低果蔬等榨汁的黏度、提高过滤效率的同时减少化学澄清剂的用量,从而改善果汁的质量[1]。游离的果胶酶具有反应后不能回收、不能实现重复利用等缺点。而固定化酶在一定程度上弥补了这些缺点,还能防止外源物质对果品的污染,提高酶的使用效率[2-6]。
水凝胶是通过物理交联或化学交联,而得到的具有三维网络结构体系的亲水高分子聚合物。不溶于水,但能吸收大量的水溶胀。正是由于这样的结构特征,水凝胶才会被大量地应用于细胞分离与培养、药物控制释放、固定化酶等领域[7-10]。
本文以戊二醛(glutaraldehyde,GA)为交联剂制备聚苯胺基超分子-戊二醛(polyaniline based supramolecular hydrogels-glutaraldehyde,PPH-GA)复合材料作为酶的固定化载体,固定果胶酶并研究其催化性能。
1 材料与方法
1.1 材料与试剂
3-氨基苯硼酸盐(98%)、聚乙烯醇(polyvinyl alcohol,PVA):天津市凯通化学试剂有限公司;苯胺(aniline,AN)、过硫酸铵(ammonium persulfate,APS):烟台市双双化工有限公司;戊二醛:天津市大茂化学试剂厂;浓盐酸:天津市北联精细化学品开发有限公司;氢氧化钠、无水亚硫酸钠、果胶酶(>50 000 U/g):上海瑞永生物科技有限公司;柠檬酸:徐州天鸿化工有限公司;柠檬酸钠、果胶、酒石酸钾钠、3,5-二硝基水杨酸:上海广诺化学科技有限公司。以上试剂均为分析纯。
1.2 仪器
RH数显型磁力搅拌器:德国艾卡公司;JD200-4电子分析天平:沈阳龙腾电子有限公司;D2F-6050真空干燥箱:上海慧泰仪器制造有限公司;SHA-C数显恒温振荡器:金坛市杰瑞尔电器有限公司;UV-1800PC紫外可见分光光度计:上海美谱达仪器有限公司;PSHJ-5 pH计:西安精密仪器仪表有限公司。
1.3 固定化酶的制备及其性能研究
1.3.1 固定化酶载体制备
先将2 mmol过硫酸铵(APS)溶于1 mL去离子水作为A溶液。将1.5 mmol的苯胺(AN)加入3 mL 10%去离子水制得的聚乙烯醇溶液,再加入0.105 mmol的3-氨基苯硼酸盐酸盐、800 μL 6 mmol/L 的 HCl和197.5 μL去离子水混合作为B溶液。将上述溶液A和溶液B冷却至0℃,取802.5 μL溶液A与溶液B迅速混合,反应6 h。将4%戊二醛(GA)和PPH按一定比例加入小烧杯中,磁力搅拌交联10 h后用蒸馏水反复离心洗涤多次,制备出PPH-GA复合材料[11]。
1.3.2 材料表征
1.3.2.1 傅立叶红外光谱分析(Fourier transform infrared spectrometer,FT-IR)
采用KBr压片法,在光谱范围为4 000 cm-1~500 cm-1,分辨率为0.5 cm-1的条件下,用红外光谱仪测定PPHGA复合材料的结构特征。
1.3.2.2 扫描电镜(scanning electron microscope,SEM)
采用SEM测试方法,在不同的放大倍数下观察PPH-GA复合材料的形貌特征。
1.3.3 固定化酶的制备
1.3.3.1 3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)试剂的配制
称取3,5-二硝基水杨酸10 g溶于蒸馏水中,加入20 g氢氧化钠、200 g酒石酸钾钠和500 mL水加热溶解。之后加入5 g苯酚、5 g无水亚硫酸钠,待全部溶解后定容至1 000 mL,储存于棕色瓶中,放置7 d后使用。
1.3.3.2 pH 3.5的柠檬酸-柠檬酸钠缓冲溶液的配制
称取柠檬酸21.01 g溶解后定容至1 000 mL。称取29.41 g柠檬酸钠溶解后定容至1 000 mL。取一定量的柠檬酸、柠檬酸钠溶液混合用pH计测定pH值为3.5。
1.3.3.3 1%果胶溶液的配制
用分析天平称取果胶1 g用pH 3.5的缓冲溶液溶解,定容至100 mL。
1.3.3.4 1%果胶酶溶液的配制
用分析天平称取果胶酶1 g用pH 3.5的缓冲溶液溶解,定容至100 mL。
1.3.3.5 固定化酶的制备
称取制备的PPH-GA复合材料0.08 g,加入1%果胶酶溶液2 mL,在37℃恒温振荡器中反应4 h。取出后倒出上清液保存,待测载酶量。沉淀先用蒸馏水清洗,再用缓冲溶液清洗除去多余的自由酶。放置4℃冰箱中保存。
1.3.4 固定化果胶酶酶活力的测定
在固定化果胶酶中加入2 mL HAc-NaAc缓冲液(pH 3.5),40℃水浴平衡5 min,再加入1 mL预先平衡至40℃的1%的果胶溶液,40℃水浴反应30 min,取出固定化酶,将反应液立即在沸水浴中煮5 min使酶失活,冷却。从反应液中取2 mL于试管中,用DNS法测定其还原糖含量。酶活力单位定义同自由果胶酶的活力单位[12]。
1.4 单因素试验
1.4.1 酶浓度对酶活力的影响
配制 0.05%、1%、2%、3%、4%、5%的果胶酶溶液,按照固定化酶的制备方法制备不同浓度的固定化果胶酶。在温度为40℃,pH 3.5的条件下测其酶活力,并比较自由酶的酶活。
1.4.2 温度对固定化酶活力的影响
分别在温度为 25、30、35、40、45、50 ℃,酶浓度为3%,pH 3.5的条件下测定固定化酶和自由酶的酶活。
1.4.3 pH值对酶活力的影响
分别在 pH 值为 2.6、3.0、3.5、4.0、4.5、5.0,温度为40℃,酶浓度为3%的条件下测定自由酶和固定化酶的活力。
1.4.4 反应时间对酶活力的影响
分别在反应时间为 15、30、45、60、90、120、150 min,温度为40℃,酶浓度为3%,pH 3.5的条件下测定自由酶和固定化酶的活力。
1.4.5 果胶浓度对酶活力的影响
配制 0.2%、0.5%、0.8%、1.0%、1.2%、1.5%、2.0%浓度的果胶溶液,在温度为40℃,酶浓度为3%,pH 3.5,反应时间为120 min的条件下测定固定化酶和自由酶的酶活。
2 结果与分析
2.1 固定化酶载体的表征
载体的FT-IR谱图见图1。
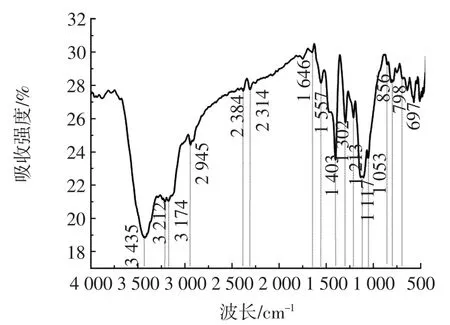
图1 PPH-GA的红外光谱分析图Fig.1 Infrared spectrum analysis of PPH-GA
由图1可知,聚苯胺基超分子水凝胶-戊二醛在3 435、1 302 cm-1处有吸收峰,该峰归因于N-H键和C-N 键的伸缩振动;1 646、1 557、798 cm-1处的吸收峰归因于苯环的伸缩振动;在1 403 cm-1的吸收峰归因于C-H键的伸缩振动。1 213 cm-1处的峰归因于聚乙烯醇(polyvingl alcohol,PVA)分子C-O键的伸缩振动。复合材料的官能团特征峰明显,表明丰富的官能团能较好地键合在材料表面。
载体的SEM谱图见图2。

图2 PPH-GA复合材料SEM图Fig.2 SEM of PPH-GA composite
由图2可知,PPH-GA复合材料具有三维网状结构,且孔径大,有利于酶的固定化。
2.2 固定化果胶酶活力
固定化果胶酶活力见表1。

表1 一定反应条件下自由酶和固定化酶的活性参数Table 1 Activity parameters of free enzyme and fixed enzyme under certain reaction conditions
由表1可知,在最佳反应条件下固定化酶的催化活力是203.4 U/mg。计算出的固定化酶的载酶量为268.1 mg/g。
2.3 不同酶浓度对酶活的影响
不同酶浓度对酶活的影响见图3。

图3 不同酶浓度对酶活的影响Fig.3 Effect of different enzyme concentration on enzyme activity
对于纯酶来说,一般认为在pH值、反应温度和反应底物浓度相同时,酶的催化能力与酶的浓度成正比关系。由图3可知,固定化酶的活力随酶浓度的增大而提高,但当酶浓度增大到一定程度后,固定化酶的活力开始下降,自由酶亦然,这是由于载体的结合位点有限,酶浓度过大时,造成载体的空间位阻过大,底物与产物不能够在第一时间分散,使得固定化酶的催化能力降低。因此,固定化酶最佳酶浓度为3%。
2.4 不同温度对固定化酶活力的影响
不同温度对酶活的影响见图4。

图4 不同温度对酶活的影响Fig.4 Effect of different temperature on enzyme activity
与一般化学反应一样,当温度升高,酶解反应速率会加快,同时酶的活性也会随之降低。由图4可知,固定化酶和自由酶的活力都是先增大再减小的。在一定温度范围内固定化酶和自由酶的相对酶活增幅较大,说明温度对酶活性的影响较明显。固定化酶最佳反应温度为40℃。
2.5 不同pH值对酶活力的影响
不同pH值对酶活力的影响见图5。
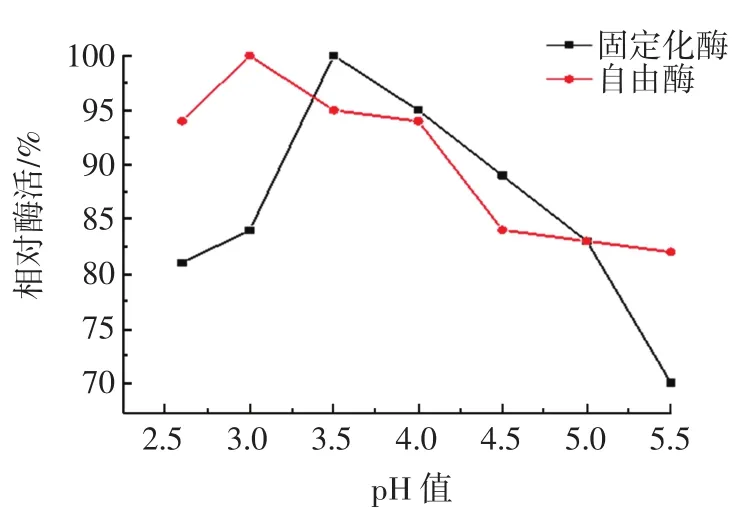
图5 pH值对酶活的影响Fig.5 Effect of pH on enzyme activity
酶是一种蛋白质,反应体系的pH值影响酶分子活性部位中催化基团与结合基团的解离状态,同时也影响着底物的解离状态,对酶分子的空间结构和专一性也有一定的影响。酶的最适pH值并不是一个常数,只是在一定条件下才有意义。由图5可知,固定化酶的最佳pH值为3.5,自由酶的最佳pH值为3.0。与自由酶相比较固定化酶的pH值范围更广。
2.6 不同反应时间对酶活力的影响
不同反应时间对酶活力的影响见图6。
由图6可知,自由酶的最佳反应时间为90 min,固定化酶的最佳反应时间为120 min。反应时间过长,酶活力降低的原因可能是底物被分解为其他物质。

图6 反应时间对酶活的影响Fig.6 Effect of reaction time on enzyme activity
2.7 不同果胶浓度对酶活力的影响
不同果胶浓度对酶活力的影响见图7。

图7 不同果胶浓度对酶活的影响Fig.7 Effect of pectin concentration on enzyme activity
由图7可知,不同果胶浓度对自由酶和固定化酶的影响不同,固定化酶的酶活力随着果胶浓度的增大呈增大趋势,固定化酶最佳果胶浓度为2%。自由酶活力呈先增大后减小的趋势,自由酶最佳果胶浓度为1.0%。
3 结论
本研究制得了性能较好的PPH-GA复合材料,通过FT-IR发现PPH-GA复合材料的官能团特征峰明显,材料表面较好地键合了丰富的官能团。SEM发现PPH-GA材料具有三维网状结构,有较大的孔径,具有良好的固酶特性。经试验测得固定化酶的载酶量为268.1 mg/g。并且通过单因素试验得出固定化果胶酶在pH3.5,反应温度为40℃,酶浓度为3%,反应时间为120 min,果胶浓度为2%时,具有最高活性。固定化果胶酶比自由酶更稳定,并且固定化果胶酶可以回收重复利用,既避免了自由酶易失活,不能长期保存的问题,也在一定程度上降低了成本,为固定化酶的研究提供了理论基础。
