白芥子散对哮喘大鼠免疫稳态重建及RhoA基因表达的影响
2021-07-13陈训春李名兰潘碧云王燕英
陈训春,李名兰,潘碧云,王燕英
(海口市人民医院,海南 海口 570208)
非特异性刺激导致的气道狭窄是呼吸系统阻塞性疾病,支气管哮喘特征之一。虽然其病理生理学机制还不十分清楚,现在已经提出了几种机制来解释气道高反应性(Airway hyperresponsiveness,AHR),包括控制气道平滑肌的神经系统的改变[1],气道黏膜分泌物的增加[2],以及与气道重塑有关的机械因素等[3]。此外,还有研究人员认为导致哮喘患者气道狭窄与气道平滑肌异常有关[4-5]。通过吸入β-受体兴奋剂来快速缓解哮喘症状也提示气道平滑肌收缩可能参与了哮喘患者的气道阻塞。因此,研究在哮喘的发生发展过程中与气道平滑肌收缩有关的分子非常重要。研究发现,平滑肌收缩主要受细胞质内Ca2+浓度的调节。最近,另一种称为Ca2+致敏的机制被认为与激动剂引起的平滑肌收缩有关[6-7]。有研究结果显示,虽然详细机制尚不完全清楚,有增加证据表明单体GTP结合蛋白RhoA及其下游分子Rho激酶参与Ca2+致敏机制[6-7]。当RhoA/Rho激酶系统被激动剂激活后,肌球蛋白轻链(Myosin light chain,MLC)磷酸酶水平降低,MLC磷酸化水平增加,导致平滑肌收缩增加。最近的研究显示,一些疾病患者的平滑肌中RhoA/Rho激酶系统介导的Ca2+致敏机制增加,包括冠心病[8]、感染性休克[9]和高血压[10]。但是,有关RhoA/Rho激酶系统在支气管哮喘中的作用却少有研究。白芥子散以白芥子、延胡索、甘遂、细辛、麻黄按 2∶2∶1∶1∶1 比例混合,具有辛温散寒、化痰通络、温阳益气的功效。临床上用于治疗咳嗽、慢性支气管炎等疾病[11-12]。但是,关于其在支气管哮喘中的作用却少有研究。本研究旨在探讨白芥子散对哮喘大鼠免疫稳态重建及其对于RhoA基因表达的影响。
1 材料与方法
1.1 实验材料 Wistar大鼠(6周龄,SPF级,雄性),体重170~190 g,购于中国医科大学实验动物中心。动物实验前1周开始饲养于动物中心实验动物房,平均温度(25±2)℃,无卵蛋白饮食,每天12 h自然光光照,12 h无光照。
1.2 分组与造模方法 根据随机数字表法将60只Wistar大鼠分为六组,A组(正常对照组)、B组(阴性对照组)、C组(哮喘模型组)、D组(地塞米松组)、E组(白芥子散2 h组)和F组(白芥子散4 h组),每组10只。除A组和B组外,其他所有组均根据改良的Palmans方法建立哮喘模型[13]。在第1天和第8天通过皮下注射1 ml含10 mg OVA和100 mg Al(OH)3的生理盐水悬浮液使每只模型大鼠致敏(B组注射1 ml生理盐水)。 15 d后,将它们放置在透明的玻璃箱中,每隔30 min 1次,每隔1 d使用1% OVA生理盐水溶液刺激哮喘(B组用生理盐水雾化)。直到第56天雾化结束。在上一次气溶胶观察模型后,模型出现打喷嚏、明显的腹部呼吸、无力、鼻痒、抓挠和反应缓慢等症状时,认为造模成功。
1.3 实验方法 在第56天,建立所有模型后,正常喂养大鼠14 d,等待它们进入缓解期。 第15天开始集体治疗。 A组和B组正常进食;C组隔天腹腔注射地塞米松,每次0.5 mg/kg。 将D组大鼠的背部剃光,并在肺俞、脾俞和肾俞的两侧(定位参见“实验性针灸法”[14])应用0.8 cm×0.8 cm的白芥子散膏药,用胶带固定,分别在2 h和4 h后取下,每两天治疗1次,共7次。
1.4 标本采集 实验结束将大鼠用10%水合氯醛(0.3 ml/100 mg)麻醉,仰卧位固定,右腹股沟处取动脉血至采血管中,置管30 min,3000 r/min离心,提取血清分装入冻存管中,-20 ℃冻存备用。沿胸部正中线暴露大鼠胸腔,取右肺中叶置于10%甲醛溶液固定备用。
1.5 指标检测
1.5.1 HE染色:右肺中叶常规石蜡包埋、切片。常规HE染色。炎性细胞是指气管周围及肺组织内的中性粒细胞、单核细胞、淋巴细胞,染为蓝色。
1.5.2 ELISA检测:酶标仪采用HBS-1096C Pro自动酶标仪(上海科怀仪器有限公司),TNF-α和IL-6的酶联免疫吸附测定(ELISA)试剂盒由北京普尔韦耶生物技术有限公司生产。按照试剂盒说明书的严格操作,通过ELISA检测支气管肺泡灌洗液中TNF-α和IL-6的水平。
1.5.3 Western blot检测:收集细胞。 用PBS缓冲液冲洗,添加RIPA裂解缓冲液,并在冰浴条件下搅拌30 min以提取总细胞蛋白。 离心15min(15000 r/min)后,通过BAC方法测量细胞总蛋白,通过琼脂糖凝胶电泳分离蛋白,转移并标记蛋白,洗脱TBS显色,通过UVP凝胶收集图像,并读取Western条带。
1.6 统计学方法 采用SPSS 17.0统计学软件进行统计学分析。计量资料以均数±标准差表示,采用组间t检验分析。计数资料以[例(%)]表示,采用卡方检验,P<0.05为差异有统计学意义。
2 结 果
2.1 肺泡组织HE染色 如图1所示,A组和B组肺泡结构完整,没有炎症和水肿的表现(图1A和1B)。 C组肺泡结构破坏显著,表现出肺水肿,肺泡塌陷和大量炎性细胞浸润(图1C)。采用地塞米松和白芥子散治疗2 h和4 h后肺泡结构的破坏,炎性细胞的浸润明显减轻(图1D-F)。
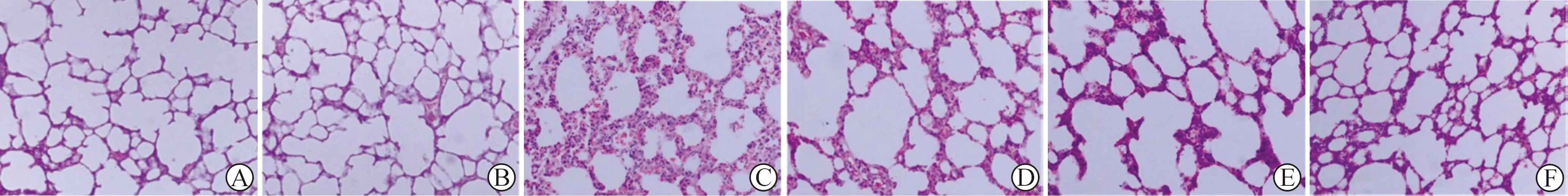
A:正常对照组;B:阴性对照组;C:哮喘模型组;D:地塞米松组;E:白芥子散2 h组;F:白芥子散4 h组
2.2 各组支气管肺泡灌洗液细胞计数比较 见表1。与正常对照组相比较,哮喘模型组支气管肺泡灌洗液中的总细胞、中性粒细胞和巨噬细胞的数量均显著增加(均P<0.05)。 地塞米松和白芥子散2 h和4 h治疗显著减少了支气管肺泡灌洗液中的总细胞、中性粒细胞和巨噬细胞的数量。
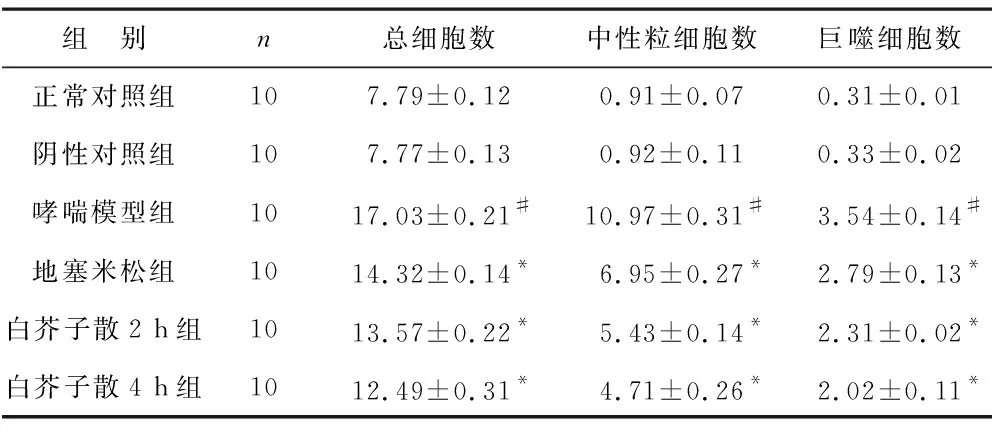
表1 各组支气管肺泡灌洗液细胞计数(×108/L)
2.3 各组支气管肺泡灌洗液内TNF-α和IL-6水平比较 见表2。与正常对照组相比较,哮喘模型组支气管肺泡灌洗液中的TNF-α和IL-6水平均显著增加(均P<0.05)。 地塞米松和白芥子散2 h和4 h治疗显著减少了支气管肺泡灌洗液中的TNF-α和IL-6水平。

表2 各组支气管肺泡灌洗液内TNF-α和IL-6水平比较
2.4 各组肺组织中RhoA表达水平比较 与正常对照组相比,哮喘模型组肺组织中RhoA表达显著增加。地塞米松和白芥子散2 h和4 h治疗显著减少了肺组织中的RhoA表达水平(图2)。

图2 肺组织中RhoA表达水平
3 讨 论
以往研究发现,哮喘患者的AHR与气道平滑肌异常相关[4-5]。平滑肌是气道的主要组织结构,并且在气道收缩中发挥了重要的作用。气道平滑肌的过度收缩可能是引起哮喘症状,例如AHR的直接关键因素之一[15]。研究发现,在过敏性支气管哮喘大鼠模型中,激动剂诱导的RhoA介导的Ca2+致敏性气道平滑肌收缩伴有RhoA蛋白表达水平的增加[16]。此外,体内实验结果显示,吸入激动剂如Ach和神经激肽A也会导致AHR的发生。类似的实验结果,包括体内AHR、支气管平滑肌高反应性,以及RhoA介导的Ca2+致敏性气道平滑肌收缩在卵清蛋白抗原诱导的支气管哮喘大鼠模型中得到了证实。RhoA及其下游分子Rho激酶在人支气管平滑肌收缩中的重要性也得到了验证。因此,现在已经有科学家提出RhoA/Rho激酶途径可以作为治疗哮喘的新靶点[17]。
白芥子散中的白芥子辛温、利气、豁痰、宽胸;细辛祛风散寒、温肺化饮;甘遂逐水利肠、宣通肺气;延胡索行气活血;鲜姜汁辛温、归肺经、温肺散寒、利气豁痰、止咳平喘;麻黄宣肺、散寒、平喘。贴敷的穴位以背俞穴为主,而在背为阳,背俞穴又是五脏六腑之气输注和汇聚的部位,故药物敷贴产生的药力和热力可通过穴位的刺激作用,促进脏腑功能活动的良性运转。如《难经·六十七难》所言:“阴病行阳,阳病行阴。故令募在阴,俞在阳”。现代医学研究认为:穴位给药的生物利用度明显高于一般给药,因腧穴对药物具有敏感性和放大效应。本研究结果显示,与正常对照组相比,哮喘模型组肺组织中RhoA蛋白质表达显著增加。这是与以往的研究结果相一致的[16]。而地塞米松和白芥子散2 h和4 h治疗显著减少了肺组织中RhoA蛋白质的表达水平,提示白芥子散可能是通过抑制RhoA基因蛋白质的表达而抑制支气管平滑肌收缩,从而改善哮喘症状。
此外,本研究还发现,白芥子散治疗方法可以减少炎症细胞的浸润,肺组织和支气管肺泡灌洗液中的炎症细胞数量均明显减少。其机制可能是炎症细胞,例如中性粒细胞和巨噬细胞的迁移需要肌动蛋白细胞骨架的重塑,而单体GTP结合蛋白RhoA、Rac1和Cdc42是肌动蛋白重组的关键调节因子[18]。因此,白芥子散可能是通过抑制RhoA的表达而抑制了炎症细胞的迁移和浸润。
研究发现,促炎细胞因子表达水平增加出现在支气管哮喘的早期阶段。在各种促炎细胞因子中,已报道TNF-α和IL-6在支气管哮喘的发生发展中起着重要的作用[19]。动物实验结果显示,卵清蛋白抗原注射后,TLR4介导的NF-κB活化增强,导致TNF-α和IL-6的产生,并且这两种细胞因子反过来也会激活NF-κB[20]。这种正反馈可以放大原先的炎症反应,并在卵清蛋白抗原诱导的支气管哮喘发病机制中发挥重要的作用。在本研究中,白芥子散治疗方法可以减少支气管肺泡灌洗液中的TNF-α和IL-6水平,其机制可能与白芥子散下调活化的NF-κB,从而阻止了促炎细胞因子的级联反应并限制炎症反应相关。
综上所述,白芥子散可改善抗原诱导的大鼠哮喘,帮助其免疫稳态的重建,其作用机制可能是通过减少RhoA基因的蛋白质表达水平而实现的。
