血清t-P1NP、PTH表达与男性阻塞性睡眠呼吸暂停低通气综合征患者骨密度相关性分析
2021-07-13张玮张秀伟蔡伟晋发朱文燕
张玮,张秀伟,蔡伟,晋发,朱文燕
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是一种常见慢性呼吸系统疾病,主要特征是夜间间歇性低氧血症和睡眠节律紊乱,可能损害多种器官功能,是糖尿病、冠心病、高血压等疾病的独立危险因素,日益受到重视[1-2]。研究表明,慢性缺氧能够抑制成骨细胞分化,促进破骨细胞活性使骨吸收进程加速,最终导致OSAHS患者发生骨密度下降,骨质疏松患病风险增大,但其具体发生机制尚未阐明[3]。临床常用骨密度作为骨质疏松评估标准,但也存在一定的应用限制,如短期监测滞后等,血液指标短期内对骨代谢状况有较好反映价值,能够很好地弥补骨密度测定应用限制,且灵敏、操作便捷[4-5]。骨代谢指标总Ⅰ型胶原氨基端延长肽(t-P1NP)能够反映成骨细胞活性及骨形成速度,是公认骨形成标志物,中华医学会在“原发性骨质疏松症诊治指南(2011)”中首次推荐使用[6]。甲状旁腺激素(PTH)是由甲状旁腺分泌的含84个氨基酸的多肽链,能够在促进成骨细胞形成新骨的同时,增加其分泌白介素-1、白介素-6等因子,活化破骨细胞,参与骨吸收与骨形成2个过程,是骨形成的促进剂[7]。现检测男性OSAHS患者血清t-P1NP、PTH表达水平及其在OSAHS并发骨质疏松过程中的作用,以期为男性OSAHS患者防治骨质疏松提供参考依据,报道如下。
1 资料与方法
1.1 临床资料 选取2018年2月—2020年6月南京医科大学附属江宁医院呼吸科收治男性OSAHS患者118例为观察组(为排除女性雌激素对骨密度的影响,故未纳入女性患者),年龄23~72(52.17±9.21)岁;病程1~11(5.24±1.35)年。另外选择男性健康体检者118例作为健康对照组,年龄26~73(51.26±8.22)岁。2组年龄、体质量指数(BMI)、吸烟史、饮酒史、夜间血压比较,差异均无统计学意义(P>0.05),见表1。本研究经医院伦理委员会批准,所有研究对象及家属均知情同意并签署知情同意书。

表1 2组临床资料比较
1.2 病例选择标准 (1)诊断标准:参照2011年中华医学会呼吸病学分会睡眠呼吸障碍学组制定的OSAHS诊治指南中的相关标准[8]。(2)纳入标准:①男性OSAHS患者;②近6个月未服用钙剂、维生素D、糖皮质激素等可能影响骨代谢的药物。(3)排除标准:①慢性阻塞性肺疾病、结核、哮喘者;②糖尿病、高血压者;③自身免疫性疾病者;④心、肺、肝、肾等器官严重功能障碍者;⑤骨折、骨质增生等疾病者。
1.3 观测指标与方法
1.3.1 LSaO2、AHI监测:检查前告知受检者48 h内不得服用镇静、催眠药物及饮茶、饮酒或咖啡,检测当天不睡午觉。休息30 min后进行身高、体质量测定,以日常习惯入睡,采用飞利浦Alice LE多导睡眠监测仪(PSG)行整夜监测,睡眠时间>7 h,记录受检者最低血氧饱和度(LSaO2)、睡眠呼吸暂停低通气指数[AHI=(呼吸暂停次数+低通气次数)/睡眠时间]。呼吸暂停以睡眠中口鼻气流中止时间>10 s为标准;低通气以睡眠中气流强度降至正常气流强度的50%以下,同时伴SaO2降低4%以上或出现觉醒为标准[9-10]。
1.3.2 骨密度测定:以Lunar Idxa型双能X线骨密度检测仪(美国GE公司)采用双能X线吸收法(DXA)测定研究对象腰椎(L1-4)、髋部骨密度,参照WHO公布的骨质疏松诊断标准[11],T值≤-2.5为骨质疏松。
1.3.3 骨代谢血清学指标检测:2组均于清晨空腹采集肘静脉血5 ml,离心留取上清液保存于-80℃冰箱中待测。采用BS-800型全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司)检测血清钙、磷,罗氏CObase 601型全自动电化学发光免疫分析仪(瑞士罗氏公司)检测血清t-P1NP、PTH水平。
2 结 果
2.1 2组PSG监测结果比较 与健康对照组比较,观察组LSaO2降低,AHI升高(P<0.01),见表2。

表2 2组受试者PSG监测结果比较
2.2 2组骨代谢指标比较 2组血清钙、磷水平比较,差异无统计学意义(P>0.05);与健康对照组比较,观察组血清t-P1NP、PTH水平均升高(P<0.01),见表3。

表3 2组受试者骨代谢指标比较
2.3 2组骨密度比较 与健康对照组比较,观察组腰椎、髋部骨密度均降低(P<0.05),见表4。
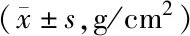
表4 2组受试者骨密度比较
2.4 血清t-P1NP、PTH与骨密度及PSG监测结果的相关性分析 观察组血清t-P1NP、PTH与LSaO2、腰椎骨密度、髋部骨密度均呈负相关(P<0.01),与AHI均呈正相关(P<0.01),见表5。

表5 观察组血清t-P1NP、PTH与骨密度及PSG监测结果的相关性分析
2.5 OSAHS患者发生骨质疏松的影响因素分析 以OSAHS患者是否发生骨质疏松为因变量,以LSaO2、AHI及血清t-P1NP、PTH为自变量进行多因素Logistic回归分析,结果表明,AHI及血清t-P1NP、PTH均为OSAHS患者发生骨质疏松的危险因素(P<0.01),LSaO2为其保护因素(P<0.01),见表6。

表6 OSAHS患者发生骨质疏松的多因素Logistic分析
3 讨 论
OSAHS是由多种原因引起的睡眠时上呼吸道阻塞,口鼻呼吸气流出现反复停止的疾病,患者表现为夜间睡眠有呼吸暂停、低通气等症状,患者呼吸暂停时,血氧饱和度降低,恢复呼吸后,血氧饱和度随之恢复正常或尚未恢复正常即出现再次缺氧,与缺氧/再灌注损伤相似[12-13]。OSAHS早期症状不明显,随着缺氧程度加重,可能出现夜间打鼾,睡眠结构紊乱,白天嗜睡、疲倦致使记忆力减退,严重影响患者正常生活质量。PSG监测是诊断OSAHS的“金标准”,LSaO2、AHI均是评估OSAHS病情严重程度的有效指标[14-15]。张玮等[9]研究发现,与健康对照者比较,OSAHS患者LSaO2、骨密度降低,AHI升高,患者机体存在骨代谢紊乱。骨骼是动态活性组织,骨吸收和骨形成的动态平衡是骨骼维持形态及功能完整的基础,骨吸收作用大于骨形成时即导致骨丢失,进而造成骨密度降低,增加骨折风险。骨质疏松对患者自理生活能力造成严重影响,加重家庭及社会负担,骨密度测定在骨量丢失到一定程度时有较好适用性,对短期内骨丢失不能灵敏反映,骨代谢指标具有反应及时、灵敏、特异性强的优点,可用于评估早期骨丢失情况[16-17]。
Ⅰ型胶原是骨基质的重要组成成分,在Ⅰ型前胶原转化为Ⅰ型胶原的骨成熟过程中,C端肽特异性降解Ⅰ型胶原,即形成分解片段t-P1NP,其可反映Ⅰ型胶原合成量,是骨形成敏感、特异性指标[6,18],在骨质疏松、癌症骨转移方面均有重要研究价值。临床常用药物降钙素、雌激素等通过抑制骨吸收缓解骨质疏松进程,对骨形成无帮助。PTH由甲状旁腺主细胞合成、分泌,是迄今为止唯一经美国食品药品监督管理局批准应用于临床的骨形成促进剂[19-20],除此之外,PTH可以通过促进肾脏对钙的重吸收及对磷的排泄在维持机体钙、磷代谢平衡中起关键作用,还能够促进肠道对钙的重吸收。血钙减少时,PTH表达增加,促进肾小管对钙的重吸收及骨钙入血,使血钙水平升高,相应地,血钙水平过高时,PTH表达减少,此时肾脏发挥保磷作用,骨钙溶解速度减慢,使血钙水平降低[21-22]。袁小青等[23]研究发现,2型糖尿病女性患者随着年龄增长,骨密度降低,骨代谢标志物t-P1NP、PTH升高,可将影像学技术与骨转换标志物联合应用以评估患者骨强度。本研究发现,与健康对照组比较,观察组LSaO2及腰椎、髋部骨密度降低,AHI及血清t-P1NP、PTH均升高,2组血清钙、磷水平无差异,且观察组血清t-P1NP、PTH与LSaO2、腰椎骨密度、髋部骨密度均呈负相关,与AHI均呈正相关。提示OSAHS患者骨密度降低,且随着病情加重骨丢失程度越严重,可能增大骨质疏松患病风险,分析原因是破骨细胞与脂肪细胞来源于统一前体细胞,机体低氧状态可刺激脂肪产生,进而使成骨细胞分化过程受到阻碍,相似研究表明,OSAHS患者夜间反复间歇性缺氧可能引起氧化应激、交感神经兴奋、代谢异常、炎性反应,影响骨代谢稳态[24-26]。血清t-P1NP、PTH能够反映OSAHS患者骨代谢情况,可能成为动态评估指标,t-P1NP是临床公认骨形成标志物,本研究证实其可用于评估OSAHS患者骨密度变化,PTH促进骨形成的机制可能与环磷酸腺苷/蛋白激酶A、磷脂酶C/蛋白激酶C等信号转导通路有关[27]。Logistic回归分析结果显示,AHI及血清t-P1NP、PTH均为男性OSAHS患者发生骨质疏松的危险因素,LSaO2为其保护因素。
综上所述,男性OSAHS患者骨密度降低,血清t-P1NP、PTH为高表达,骨质疏松发生风险大,应定期监测骨代谢指标t-P1NP、PTH,以便进行及时有效的防治措施。本研究也存在一定的局限性,样本量较小,且未进行动态监测,尚需进一步深入研究。
利益冲突:所有作者声明无利益冲突
作者贡献声明
张玮:设计研究方案,实施研究过程,论文撰写;张秀伟:提出研究思路,分析试验数据,论文审核;蔡伟:实施研究过程,资料搜集整理,论文修改;晋发:进行统计学分析;朱文燕:课题设计,论文撰写
