柚皮苷和胃蛋白酶相互作用的光谱研究
2021-07-12杨鑫徐晶马坤王娜杨广德南冠军
杨鑫,徐晶,马坤,王娜,杨广德,南冠军
(1.西安交通大学第二附属医院,陕西 西安 710004;2.陕西省人民医院,陕西 西安 710068;3.西安交通大学药学院,陕西 西安 710061)
柚皮苷(Naringin,NRG)是一种双氢黄酮类化合物,主要存在于芸香科柚、葡萄柚和酸橙等植物中。柚皮苷具有多种生物学活性,如抗病毒、抗炎、抗过敏、镇痛等,还能通过调节血液中胆固醇水平,减少血栓从而改善局部微循环,达到防治血管性疾病的目的[1-2]。
胃蛋白酶(Pepsin,Pep),又称胃液素,是人类及多数哺乳动物胃肠道内的一种重要消化酶,对人类而言,Pep分子量约为35 kDa, 在37~42 ℃的酸性环境中具有最强活性[3],主要是通过水解聚氨基酸间的肽键链接使食物中的蛋白类物质被消化[4]。胃液中的前体物质——胃蛋白酶原,在酸性条件下被激活后形成胃蛋白酶从而发挥作用[5]。胃蛋白酶目前被广泛应用于各类工业和食品生产中,包括方便食品、奶制品、消化药及口香糖加工制造,以及啤酒、果酒的澄清应用方面[6]。
天然活性化合物和蛋白质或酶等生物大分子的相互作用研究越来受到关注。小分子化合物与酶等生物大分子相互作用,一方面可能会引起酶的构象改变,影响其活性;另一方面会影响小分子化合物的吸收、转运等[7]。鉴于NRG广泛存在于一些水果中,Pep又是重要消化酶;因此有必要研究NRG和Pep的相互作用,从分子水平方面阐明NRG与Pep的作用特点[8-11]。因此本研究将通过研究NRG与Pep的荧光猝灭类型、结合常数K、结合位点数n、作用力类型、Pep构象的变化,结合NRG与Pep的氨基酸残基的距离r等关键参数的研究,并通过测定结合常数随温度的变化情况,进一步确定NRG与Pep的作用机制及可能性,为分子水平上研究NRG与Pep的作用特点提供信息[12-15]。
1 仪器与试剂
荧光分光光度计(RF-5310pc,日本岛津公司);紫外分光光度计(UV-2450,日本岛津公司);分析天平(AY120,日本岛津公司);循环恒温水浴锅(HWY-501, 上海昌吉地质仪器有限公司);数显pH计(PHS-29A,上海仪电科学仪器股份有限公司);超纯水机(1810B,上海摩勒生物科技有限公司)。
Pep(北京索莱宝科技有限公司,分析纯);NRG(西安冠宇生物技术公司,分析纯);柠檬酸、磷酸氢二钠、乙醇和氯化钠(西安化学试剂厂,分析纯)。
2 方法与结果
2.1 储备液的配制
2.1.1 柠檬酸-磷酸盐缓冲液
先准确称取柠檬酸21.01 g,然后用蒸馏水溶解并定容至1 000 mL;准确称取十二水合磷酸氢二钠(Na2HPO4·12H2O)3.58 g,用蒸馏水溶解定容至50 mL。准确称取5.85 g NaCl置1 000 mL容量瓶中,加入上述柠檬酸溶液530 mL和十二水合磷酸氢二钠溶液20 mL,溶解完全后蒸馏水定容。
2.1.2 Pep标准储备液的配制
准确称取87.5 mg的Pep置100 mL容量瓶中,使用上述柠檬酸-磷酸盐缓冲液溶解并定容,得到2.5×10-5mol/L的Pep标准储备液,4 ℃保存备用。
2.1.3 NRG储备液的配制
精确称取10 mg NRG置10 mL容量瓶中,加入乙醇溶解定容,得到1.72×10-3mol/L 的NRG储备液,4 ℃保存备用。
2.2 试验方法
2.2.1 NRG与Pep相互作用的紫外吸收光谱
精密量取5 mL Pep标准储备液,用上述柠檬酸-磷酸盐缓冲溶液稀释至浓度为1.25×10-5mol/L,取与Pep相同摩尔浓度的NRG溶液,另取与相同浓度的Pep-NRG混合溶液于37 ℃反应5min后,分别在200~400 nm范围内扫描紫外光谱。
2.2.2 NRG与Pep相互作用的荧光猝灭光谱
精密量取10 mL 1.25×10-5mol/L Pep稀释液于比色管中,加入25 μL乙醇,恒温水浴5 min,取2 mL于比色皿中,将激发波长设为280 nm,并将激发光谱和发射光谱的狭缝宽度设为5 nm,获得溶液在290 ~ 440 nm范围内的荧光发射光谱。逐次加入NRG储备液置比色管中,每次2 μL,扫描后再将比色皿中的溶液倒回,摇匀,置于25 ℃恒温水浴锅中,恒温5 min,重新取该溶液2 mL在原图上扫描猝灭光谱,并记录每次扫描的峰值的荧光强度。
将恒温水浴温度分别改为30 ℃和37 ℃,重复以上操作。
2.2.3 同步荧光光谱
室温下,操作方法同“荧光猝灭光谱”。精密量取一定量浓度和体积的Pep稀释液于比色管中,取2 mL于比色皿中,以Δλ = 15 nm和Δλ = 60 nm测定其同步荧光光谱(Δλ为发射波长与激发波长的差,即Δλ=λem- λex;激发光栅与发射光栅狭缝宽均为5 nm),逐次加入NRG储备液于比色管中,每次2 μL,扫描后再将比色皿中的溶液倒回,摇匀,静置5 min,重复以上操作测定其同步荧光光谱。
2.2.4 三维荧光
室温下,精密量取一定量浓度和体积的Pep稀释液于比色管中,取2 mL于比色皿中,将激发波长设置为从220 nm开始,间隔为5 nm,直到400 nm为止,在220 ~ 500 nm范围内扫描荧光光谱,得出NRG-Pep的三维荧光光谱。
2.3 结果
2.3.1 NRG对Pep的猝灭作用
见图1,图1中a、b、c分别为在25、30、37 ℃下NRG对Pep的荧光猝灭光谱。NRG与Pep的相互作用机制可由荧光光谱的变化推断得出。从图中可以看出,随着NRG浓度的增加,峰位和峰形基本不变,而Pep的荧光强度随NRG浓度的增加而降低,由此可以推测NRG与Pep产生了相互作用。
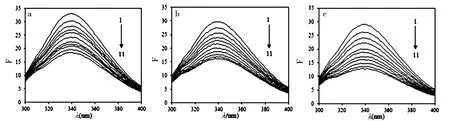
注:图中C (Pep) = 1.25×10-5 mol/L,图中1~11荧光猝灭光谱对应的的C (NRG) = 0、0.34、0.69、1.03、1.38、1.72、2.06、2.41、2.75、3.10、3.44×10-6 mol/L。图1 在25 ℃ (a),30 ℃ (b),37 ℃ (c)不同温度下NRG对Pep的荧光猝灭光谱
2.3.2 柚皮苷与胃蛋白相互作用的猝灭机理
根据Stern-Volmer方程[16],即公式(1),以F0/F为纵坐标,Pep溶液中加入的NRG浓度[Q](×10-6mol/L)为横坐标作图,可得到不同温度情况下NRG对Pep的荧光猝灭曲线,并对曲线做线性回归,见图2。
(1)
其中,F0:荧光强度(不加猝灭剂);F:荧光强度(加入猝灭剂);Kq:双分子表观猝灭常数;τ0:无猝灭剂条件下,荧光分子的平均寿命(约为10~8 s);[Q]:猝灭剂浓度;Ksv:猝灭速率常数。
以F0/F为纵坐标,猝灭剂浓度[Q]为横坐标,绘制Stern-Volmer曲线,回归方程的斜率即为Ksv,同时求得Kq。
Ksv随测试温度升高而升高,见表1,初步推断NRG对Pep的猝灭机制为动态猝灭。此外,由于双分子表观猝灭常数Kq值均远大于最大扩散碰撞猝灭常数2.0×1010L/(mol·s),说明引起荧光体荧光猝灭的主要原因可能是形成了新的配合物,猝灭机理为静态猝灭,所以可以推出Pep的荧光猝灭可能不是分子扩散和碰撞引起的动态猝灭,而是形成新的复合物引起的复合式静态猝灭。
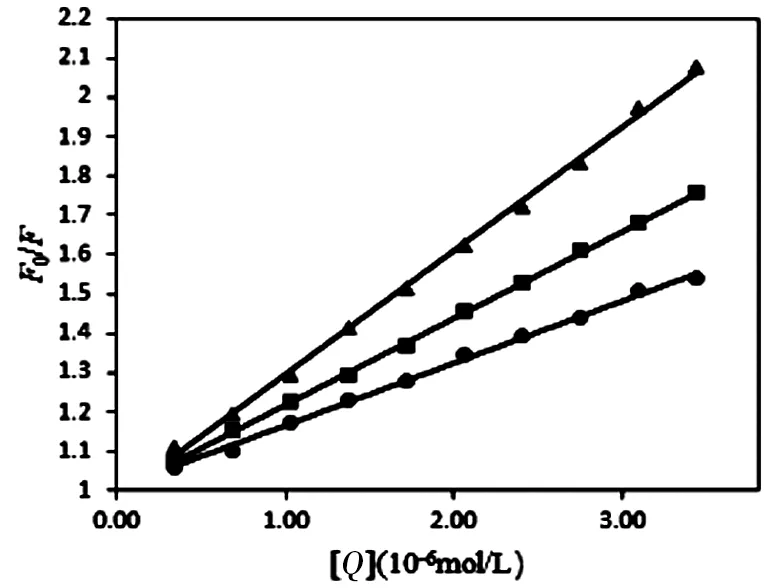
注:●表示25 ℃;█表示30 ℃;▲表示37 ℃。图2 在不同温度下NRG对Pep的荧光猝灭曲线

表1 NRG对Pep的Stern-Volmer回归方程及猝灭常数
2.3.3 柚皮苷与胃蛋白酶的结合常数和结合位点数
根据公式(2)计算NRG与Pep的结合位点数。用lg[(F0-F)/F] 对lg[Q] 作双对数图,对数据作线性拟合,直线斜率即为不同温度下NRG与Pep的结合位点数。结果如图3所示,并将其相关系数列于表2中。
(2)
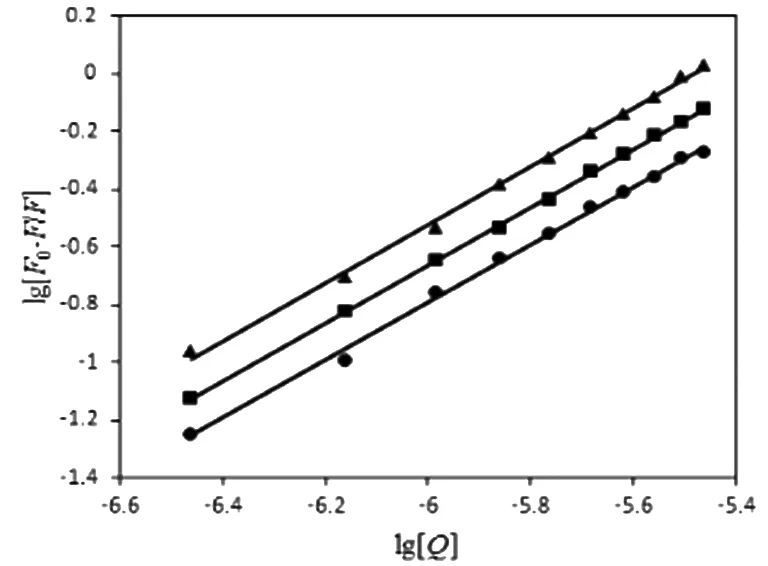
注:●表示25 ℃;█表示30 ℃;▲表示37 ℃。图3 不同温度下NRG对Pep荧光猝灭的双对数曲线

表2 NRG与Pep的结合常数和结合位点数
由斜率知,NRG与Pep的结合位点数n≈1下,二者结合时,存在约1个单独的结合位点,即大约1个NRG分子与1个Pep分子结合形成配合物。
2.3.4 柚皮苷与胃蛋白酶相互作用的作用力类型
用对应温度下的结合常数的自然对数lnK对1/T作图,线性拟合得到图4,再根据公式(3)和(4),可计算得到结合反应的ΔG,ΔH,ΔS等热力学函数的变化值,所得结果见表3。
(3)
ΔG=ΔH-TΔS=-RTlnK
(4)
式中K表示温度为T时的结合常数;T表示绝对温度;R表示普适气体常量;ΔG表示反应的标准摩尔吉布斯自由能变;ΔH表示反应焓变;ΔS表示反应熵变。
药物分子与蛋白质作用力类型可以根据ΔH和ΔS的值来判断:若ΔH>0,ΔS>0,则是典型的疏水作用力;若ΔH<0,ΔS>0,则是静电作用力;若ΔH<0,ΔS<0,则表明是氢键和范德华力;若ΔG<0,则表明反应过程是自发进行的。
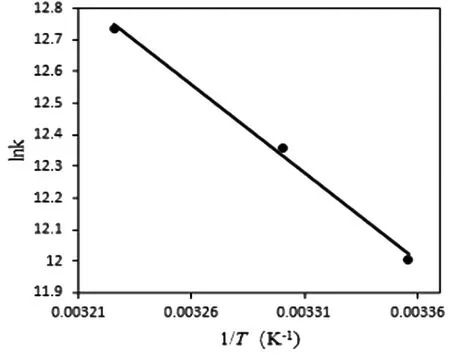
图4 NRG对1/T的线性关系
由表3可知,NRG-Pep结合体系的ΔH>0,ΔS>0,NRG与Pep分子间存在的相互作用力为疏水作用力。ΔG<0表明NRG与Pep的结合是自由能降低的分子作用过程,说明NRG可以自发地与Pep相结合。

表3 NRG与Pep结合的热力学常数
2.3.5 NRG对Pep构象的影响
NRG对Pep构象见图5。
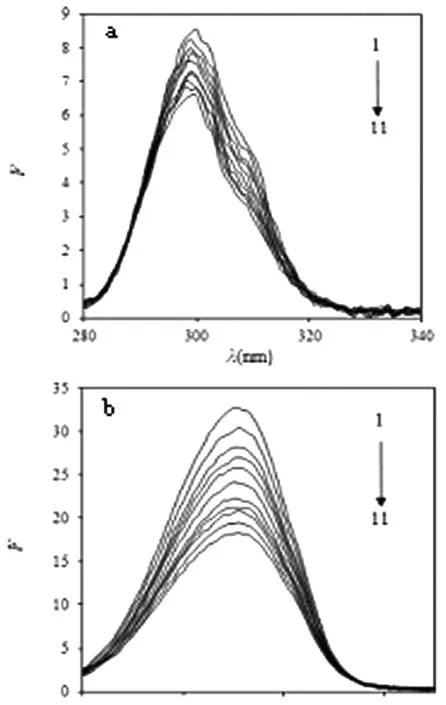
注:图中Δλ=15 nm (a),Δλ= 60 nm (b),C (Pep) = 1.25×10-5 mol/L;图中1~11对应的的C (NRG) = 0、0.34、0.69、1.03、1.38、1.72、2.06、2.41、2.75、3.10、3.44×10-6 mol/L。图5 室温下NRG对Pep的同步荧光光谱
图5中的a和b分别为在室温条件下,Pep在Δλ=15 nm (酪氨酸残基)和Δλ=60 nm (色氨酸残基)的同步荧光光谱。随着NRG浓度增大,Pep同步荧光强度逐渐降低。其中,色氨酸残基的荧光强度降低的幅度较大,表明Pep的荧光强度可能主要来自色氨酸残基,其最大发射波长发生了蓝移,表明色胺酸残基环境的疏水性增大,Pep趋向折叠态,因此Pep的构型发生了变化。
2.3.6 柚皮苷对胃蛋白酶紫外吸收光谱的影响
NRG与Pep反应后在波长280 nm处有最大吸收峰,加入NRG后,Pep紫外吸收光谱发生了明显红移,表明NRG与Pep形成了新的复合物。见图6。
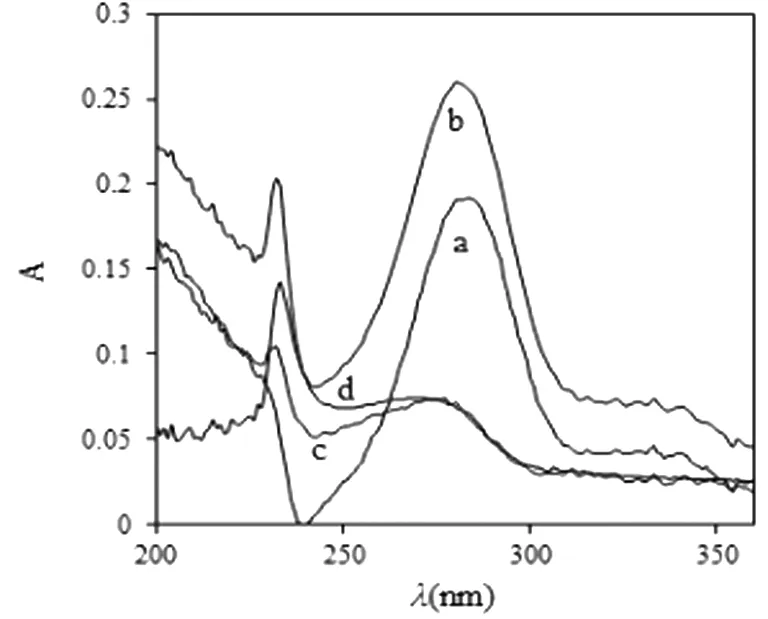
注:图中C (Pep) = 1.25×10-5 mol/L,C (Pep) =C (NRG) = 1.25×10-5 mol/L; a. NRG; b. NRG-Try; c. Try; d. b-a。图6 NRG与Pep相互作用的紫外吸收光谱
2.3.7 柚皮苷与胃蛋白酶之间的能量转移
小分子物质与荧光发射基团间的能量转移效率E和结合距离r可由公式(5)计算得出:
(5)
其中E为能量转移效率,F0和F分别表示不加猝灭剂和加入猝灭剂后蛋白的荧光强度,R0表示转移效率为50%时的临界距离,r为小分子药物与蛋白的荧光发射基团的距离。R0可由公式(6)计算得出:
(6)
式中K2表示偶极空间取向因子,N表示介质的折射指数,Φ表示供能体的荧光量子产率,J表示供能体的荧光发射光谱和受能体的紫外吸收光谱的重叠积分,可由公式(7)计算得出:
(7)
F(λ)表示供能体在波长λ处的荧光强度,ε(λ)表示受能体在波长λ处的摩尔吸光系数,K2=2/3,N=1.336,Φ=0.15;可由公式5~7式计算得出J,R0,和r值。当供能体与受能体间的距离小于7 nm时,表明蛋白与小分子药物之间发生了能量转移。
供能体Pep的荧光光谱图与受能体NRG的紫外吸收光谱图有重叠,根据Förster非辐射能量转移原理,可计算出NRG在Pep上的结合位置距色氨酸残基的距离r=2.44 nm (<7 nm),表明Pep与NRG之间可能存在能量转移。见图7,表4。
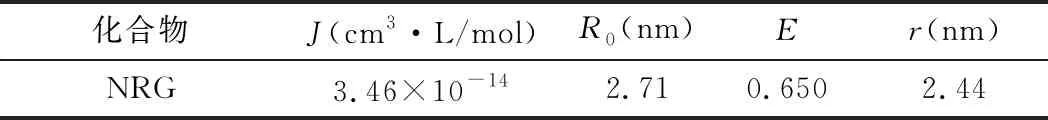
表4 NRG与Pep间的能量转移参数
2.3.8 柚皮苷与胃蛋白酶之间的三维荧光
三维图a为Pep三维荧光,三维图b为NRG-Pep三维荧光,可以看出NRG-Pep峰强度降低,表示了NRG和Pep之间有相互作用。见图8。
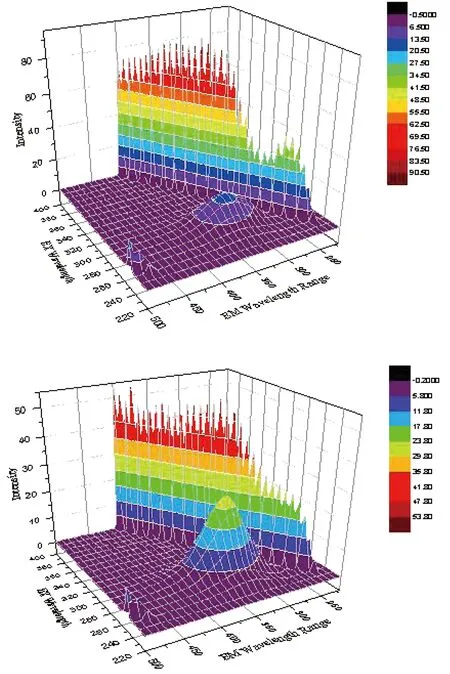
图8 胃蛋白酶和柚皮苷的三维荧光图
3 讨论
NRG能显著猝灭Pep的荧光,荧光猝灭实验结果表明,NRG与Pep的作用机制为(复合式)静态猝灭[17]。NRG与Pep结合时约存在1个单独的结合位点,即大约1个NRG分子与1个Pep分子结合形成配合物,随着温度的升高,结合常数也增大,37 ℃时,NRG与Pep的结合常数最大为3.40×105。通过Vant Hoff方程计算得出,NRG与Pep间的作用力类型为疏水作用力,NRG与Pep的结合是自由能降低的分子作用过程,NRG可以自发地与Pep相结合。
根据同步荧光光谱表明,NRG在与Pep作用时,Pep构象发生了一定程度的变化[13]。紫外吸收光谱的变化表明NRG与Pep之形成了不发光的复合物,进而导致荧光吸收光谱变化,同时,Förster非辐射能量转移原理表明,NRG与Pep之间存在着能量转移现象,进一步证实了NRG和Pep之间存在以静态猝灭发生相互作用的可能[18]。
通过建立植物活性成分与酶结合的体外模型,得到了两者结合的紧密程度、结合部位、结合作用力、结合位点数等信息,不仅有助于在分子水平上认识蛋白质和药物的相互作用,获得药物结合生物大分子的基本信息,还可以提供药物药效学和药动学的相关信息。
NRG与Pep的相互作用机制可由荧光光谱的变化推断得出,NRG与Pep产生了相互作用或自发结合,Pep的荧光猝灭可能是形成新的复合物引起的复合式静态猝灭,大约1个NRG分子与1个Pep分子结合形成配合物并伴随能量转移。
