HPLC法同步测定莓茶中二氢杨梅素、杨梅苷、杨梅素含量
2021-07-12张学英
张学英
(湘西自治州食品药品检验所,湖南 吉首 416000)
莓茶学名显齿蛇葡萄,为葡萄科蛇葡萄属显齿蛇葡萄(Ampelopsis grossedentata),同义名称有藤茶、茅岩莓、神仙草等。莓茶是一种野生藤本植物,广泛分布于我国湖南、湖北、广西、贵州等省份,其中湖南省野生及人工种植莓茶集中在湘西土家族苗族自治州(以下简称湘西州)和张家界市。湘西州莓茶种植历史悠久,有“溪洲莓茶”“永顺莓茶”等标志产品[1-2]。显齿蛇葡萄叶为药食两用物质,其药用成分为蛇葡萄素、杨梅素、杨梅苷、没食子酸、豆甾醇等[3];具有清热解毒、利湿消肿功效,可用于治疗感冒发热、咽喉肿痛、湿热黄疸、目赤肿痛、痈肿疮疖[4];2013年12月24日,原国家卫生和计划生育委员会将显齿蛇葡萄叶纳入可用于食品生产加工的新食品原料管理[5],2019年国家卫生健康委员会将显齿蛇葡萄叶列入最新版食药同源目录[6],由此显齿蛇葡萄叶(即莓茶叶)的食药两用功效被广为人知。近年来莓茶代用茶产业因投入少、周期短、见效快、利润价值空间大等特点,己成为湘西州永顺县和凤凰县落实脱贫攻坚和乡村振兴战略而大力扶持的项目,莓茶被列为湘西州茶叶产业地方政策重大项目之一,广大科研工作者对莓茶的开发应用进行了深入研究。例如,莓茶代用茶的研制、莓茶中药用成分的具体功效研究等[7-17]。另外,还有很多学者对莓茶中主要活性成分如总黄酮、二氢杨梅素等检测分析方法进行了研究[18-22],以及地方政府颁布了相关内容的地方标准[23-24]。
目前,关于莓茶中特征物质二氢杨梅素、杨梅苷及杨梅素的单独检测方法已有较多报道,但同时检测3种黄酮单体的方法尚未见报道。因此,笔者通过标准品定性、高效液相色谱仪外标法定量、线性关系考察及方法学评价等过程,建立一套准确度高、样品处理简便、上机检测灵敏度高和重现性好的莓茶代用茶中特征物质(二氢杨梅素、杨梅苷及杨梅素)的同步检测方法,以期为莓茶代用茶的开发应用提供技术支撑。
1 材料与方法
1.1 试验材料
试验样品来源于湖南省市场监督管理局,为2020年湖南省永顺县、凤凰县、古丈县、张家界市、湖北省恩施州等地不同季节制成的莓茶成品以及湖南省永顺县部分乡镇野生莓茶。试验前样品需进行简单前处理,即60℃恒温复干1 h→粉碎→备用。3种黄酮单体标准品分别是二氢杨梅素(CAS号27200-12-0,分子式C15H12O8,纯度99.5%)、杨梅苷(CAS号17912-87-7,分子式C21H20O12,纯度98.5%)和杨梅素(CAS号529-44-2,分子式C15H10O8,纯度99.8%),由上海源叶生物科技有限公司生产。
主要试剂有甲醇(TEDIA牌,含量≥99.9%)、乙腈(TEDIA牌,含量≥99.9%)、磷酸(科密欧牌,含量≥85.0%)等,均为色谱纯。
主要仪器有高效液相色谱仪(岛津20AT,带自动进样装置、PAD全波长检测器和可选择波长分析系统)、BSA-224S感量0.000 1 g分析天平、JY502感量0.01 g电子天平、KQ5200V型超声波清洗器等。
1.2 试验方法
1.2.1 标准溶液配制 称取干燥恒重二氢杨梅素0.015 5 g于小烧杯中,用甲醇溶解定容至25 mL棕色容量瓶中(必要时可常温超声助溶),称重冷冻贮存(常温称重,并用甲醇补至衡重),得标准溶液Ⅰ,二氢杨梅素标准溶液浓度为620 μg/mL,使用时用初始流动相,将其稀释成标曲系列Ⅰ,二氢杨梅素浓度,依次为62、155、310、465、620 μg/mL。称取干燥恒重杨梅苷0.007 5 g和杨梅素0.006 9 g于小烧杯中,用甲醇溶解定容至100 mL棕色容量瓶中(必要时可常温超声助溶),称重冷冻贮存(常温称重,并用色谱纯甲醇补至衡重),得标准溶液Ⅱ,杨梅苷和杨梅素混合标准溶液浓度分别为75和69 μg/mL,使用时用初始流动相,将其稀释成标曲系列Ⅱ,杨梅苷浓度依次为7.5、18.75、37.5、56.25、75 μg/mL,杨梅素浓度依次为6.9、17.25、34.5、51.75、69 μg/mL。
1.2.2 标准曲线绘制 标曲系列Ⅰ、Ⅱ分别进样20 μL上机检测,二氢杨梅素、杨梅苷和杨梅素的检测波长分别为290 、350和370 nm,以标准溶液浓度为横坐标,以峰面积为纵坐标绘制标准曲线,获取标准曲线方程及相关系数。
1.2.3 色谱条件 色谱柱C18(4.6×250 mm,5 μm)或等效柱;标曲系列Ⅰ、Ⅱ进样量20 μL;样品进样量10 μL;检测柱温35℃;检测时间约41 min;流动相A为0.1%磷酸水溶液,流动相B为乙腈,按表1进行梯度洗脱。

表1 检测时间和流动相A、B比例
1.2.4 样品峰定性试验 以标准品作为待测物定性溯源的依据,在样品处理液中依次加入微量标准品再上机检测(加入顺序为杨梅素、杨梅苷和二氢杨梅素),看相应出峰时间及峰面积的增大情况。
1.2.5 检测分析方法验证 (1)精密度试验。选取标曲系列Ⅰ、Ⅱ中间点浓度溶液连续进样检测5次,考察各单体的峰面积,分析该方法的精密度。(2)重现性试验。准确称取10号莓茶试验样品0.5 g 共5份,按试验方法进行样品检测,分析该方法的重现性。(3)标准溶液稳定性试验。①短期稳定性。分别于标准溶液Ⅰ、Ⅱ配置后1、173、345、517和689 min(约11 h)取样检测,考察各单体峰面积的变化情况。②长期稳定性。分别于标准溶液配制后当天、1、2、3、4个月取标曲系列Ⅰ、Ⅱ中间点浓度溶液进行分析检测,考察各单体峰面积的变化情况。(4)加标回收试验。精确称取10号试验样品0.553 7 g,用30 mL70%甲醇超声提取,提取液用初始流动相按1:25稀释;以试剂做空白样,空白样直接提取定容至25 mL;在试验样品和空白样中分别加入标准溶液Ⅰ、Ⅱ各10 mL,按试验方法检测3种黄酮单体的加标回收率。(5)检测限试验。采用不同浓度标准溶液进行检测,通过色谱峰形确定方法的上下检测限。
1.2.6 样品检测 准确称取莓茶粉碎样品0.5 g(准确至0.000 1 g)至50 mL比色管中,先准确加入15 mL70%甲醇水溶液润湿混匀,再准确加入15 mL70%甲醇水溶液沿壁洗净,称重记数,混匀置于50℃超声仪中超声提取30 min,取出冷却至室温再次称重,并用纯甲醇补至超声提取前的重量(即衡重衡定体积),混匀过0.45 μm滤膜,上机检测杨梅苷和杨梅素;另将超声提取液用初始流动相(乙腈∶0.1%磷酸水溶液=15∶85)进行1∶10稀释,混均过0.45 μm滤膜,上机检测二氢杨梅素;结果取平均值。
1.2.7 结果计算 根据标准曲线方程,计算出所测样品处理液中二氢杨梅素、杨梅苷和杨梅素浓度含量。再按公式(1)计算样品中黄酮单体含量。
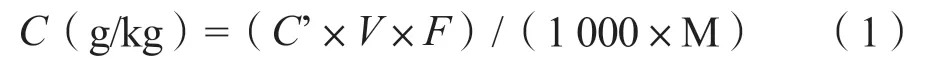
其中,C为二氢杨梅素、杨梅苷和杨梅素的含量;C’为样品处理液中二氢杨梅素、杨梅苷和杨梅素浓度(μg/mL),由峰面积值代入标准曲线方程而得出;V为70%甲醇提取液体积数(mL);1 000为单位换算系数;F为稀释倍数;M为样品称样量(g)。
2 结果与分析
2.1 3种黄酮单体的标准曲线方程
由图1可知,在62~620 μg/mL范围内二氢杨梅素的标准曲线方程为C’=0.018 1×S-2.761 7,相关系数R2=0.999 8;在7.5~75.00 μg/mL范围内杨梅苷的标准曲线方程为C’=0.025 9×S-0.249 8,相关系数R2=0.999 9;在6.9~69.00 μg/mL范围中杨梅素的标准曲线方程为C’=0.013 6×S-0.287 5,相关系数R2=0.999 9。3种黄酮单体的线性回归方程相关系数均接近1,且均在95%可置信区间内,说明该方法适用于二氢杨梅素、杨梅苷和杨梅素3种黄酮单体的检测。

图1 3种黄酮单体的标准曲线方程及相关系数
2.2 系统适用性考察
由表2可知,二氢杨梅素、杨梅苷、杨梅素3种黄酮单体的出峰时间分别为18.34、27.83和34.54 min,3种物质出峰时间差距较大,不会相互影响;色谱柱理论塔板数n(即色谱柱的分离效能)分别为6 243、92 587和182 942,均远远大于4 000,说明色谱柱分离效能高达液相色谱方法检测要求;相邻峰分离度R分别为2.785、2.267和2.707,均大于1.5,证明前后峰出峰不影响;拖尾因子T (即色谱峰的对称性)分别为0.961、1.007和1.030,其值均在0.95~1.05之间,说明色谱峰无拖尾峰形对称。综合分析得出该检测方法系统适用性考察符合标准要求[25]。
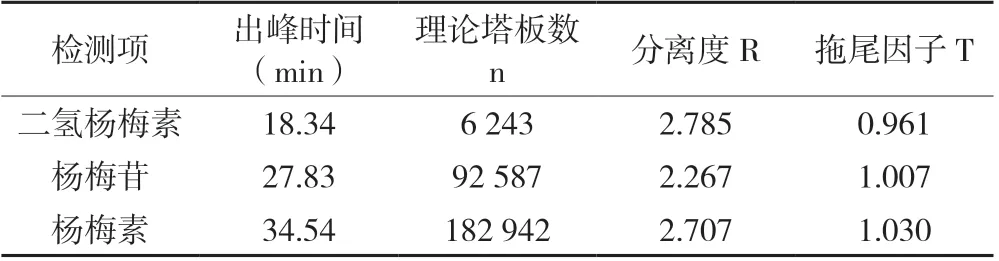
表2 系统适用性试验检测结果及数据分析
2.3 样品峰定性
由表3可知,序号1~3未加二氢杨梅素,其峰面积RSD值(n=3)为1.361 8%;序号2~4己加了杨梅素,其峰面积RSD值(n=3)为1.119 2%;序号1~2未加杨梅苷,其峰面积相对平均偏差为0.961 5%;序号3~4己加杨梅苷,其峰面积相对平均偏差为2.522 9%。RSD值或相对平均偏差均小于5%,说明检测结果数据稳定;同时添加标准品前后各单体的峰形和相应出峰时间均无变化,仅相应峰面积增大,表明标准品定性溯源准确。

表3 样品峰定性试验结果
2.4 方法学评价
2.4.1 精密度 由表4可知,3种黄酮单体连续进样时响应值峰面积(即精密度)RSD值均小于5.0%,可见该检测方法精密度很高,检测仪器稳定。

表4 精密度试验检测数据及结果分析(n=5)
2.4.2 重现性 由表5可知,莓茶样品中二氢杨梅素、杨梅苷和杨梅素重复检测RSD值均小于5.0 %,说明该试验方法检测结果稳定,重现性好。
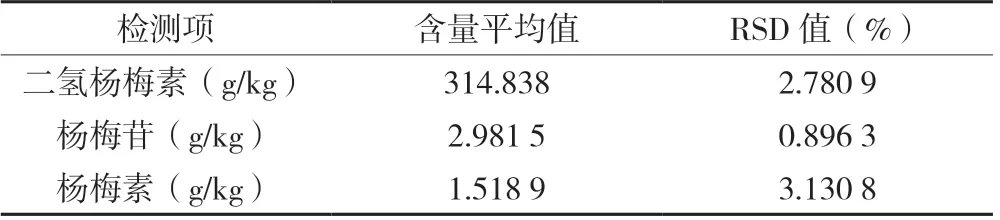
表5 重现性试验检测数据及结果分析(n=5)
2.4.3 标准溶液稳定性 由表6可知,3种黄酮单体峰面积RSD值均小于 5.0 %,说明标准溶液浓度在11 h内稳定不变,溶液稳定性良好。由表7可知,3种黄酮单体的峰面积RSD值均小于5.0%,说明标准溶液浓度在较长时间内能保持稳定。

表6 标准溶液11 h稳定性试验结果(n=5)

表7 标准溶液4个月稳定性试验结果(n=5)
2.4.4 加标回收率 试验结果显示,空白样中二氢杨梅素、杨梅苷和杨梅素的加标回收率分别为101.415 6%、97.817 7%和90.052 2%;试验样品中二氢杨梅素、杨梅苷和杨梅素的加标回收率分别为97.542 7%、94.911 7%和90.182 1%;空白样和试验样品加标回收率均在90%~105%之间,表明该检测方法目标物损失少、人为影响因素小、加标回收率高、检测结果准确。
2.4.5 上下检测限 试验结果显示,当二氢杨梅素、杨梅苷和杨梅素检测浓度分别约为775、130和120 μg/mL时,峰面积约为33 950 000、5 044 000和8 900 000 mAU*s,其色谱峰形开始出现拖尾现象,峰对称性变较差,峰顶现小馒头峰,此浓度下浮20%确定为检测上限浓度,分别为620、104和96 μg/mL;当二氢杨梅素、杨梅苷和杨梅素检测浓度分别约为3.1、3.75和3.45 μg/mL时,峰面积约为166 000、149 000和246 000 mAU*s,其色谱峰形较小,响应值低,光谱图不明显,此浓度上浮20%确定为检测下限浓度,分别为3.72、4.5和4.14 μg/mL。
2.5 样品检测
由表8可知,莓茶样品中3种黄酮单体成分含量较高,其中二氢杨梅素含量在249.864~337.551 g/kg,杨梅苷和杨梅素含量分别为2.981 5~9.919 1和0.459 5~3.367 7 g/kg。
3 结论与讨论
通过标准品定性、高效液相色谱仪外标法定量、线性关系考察及方法学评价等过程建立了基于HPLC的二氢杨梅素、杨梅苷、杨梅素3种黄酮单体的同步测定方法。结果表明:二氢杨梅素在62~620 μg/mL范围呈良好的线性关系,相关系数0.999 8,精密度、重现性和稳定性RSD均小于5%,加标回收率在90%~105%;杨梅苷在7.5~75 μg/mL范围呈良好的线性关系,相关系数0.999 9,精密度、重现性和稳定性RSD均小于5%,加标回收率在90%~105%;杨梅素在6.9~69 μg/mL范围呈良好的线性关系,相关系数0.999 9,精密度、重现性和稳定性RSD均小于5%,加标回收率在90%~105%;用此法检测12批次莓茶代用茶样品,发现样品中二氢杨梅素含量为249.864~337.551 g/kg;杨梅苷和杨梅素含量分别为2.981 5~9.919 9和0.459 5~3.367 7 g/kg。
用该方法可以同时完成莓茶代用茶中二氢杨梅素、杨梅苷和杨梅素这3种黄酮单体的有效分离、正确定性和准确定量,标准曲线线性良好,可以在莓茶代用茶质量控制、药物应用研究、生产工艺研究及产品开发利用中加以应用。
