甲壳动物过氧化物还原酶基因的研究进展
2021-07-10李辉冯伟于俊杰张明胤周春妙唐永凯
李辉,冯伟,于俊杰,张明胤,周春妙,唐永凯,3*
(1.水产科学国家级实验教学示范中心(上海海洋大学),上海 201306;2.中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业与种质资源利用重点实验室,江苏 无锡 214081;3.南京农业大学无锡渔业学院,江苏 无锡 214128)
生物代谢在有氧条件下会产生一种副产物——活性氧(reactive oxygen species,ROS),其主要包括过氧化氢(H2O2)、超氧阴离子自由基(·O-2)、羟基自由基(·OH)、臭氧(O3)和一氧化氮(NO)等[1-2]。低浓度的活性氧可促进细胞有丝分裂、增殖和分化,参与细胞内信号转导过程,并进一步调节多种生物学活动,如宿主防御、抑制细菌和病毒产生等。高浓度活性氧会破坏生物膜、核酸和蛋白质等,从而引起细胞凋亡和损伤[3-7]。当ROS 的产生超出其清除能力时,就会出现所谓的“氧化应激状态”[8]。生物在进化过程中,逐渐形成各种高效和准确的抗氧化系统,以此来抵御高浓度ROS 造成的损伤,主要包括过氧化氢酶(catalase, CAT)、硫氧还原蛋白(thioredoxin, TRX)、超氧化物歧化酶(superoxide dismutase, SOD)和过氧化物还原酶(peroxiredoxin,Prx)等[9]。在正常生理状态下,ROS 和抗氧化酶呈现出一种动态平衡状态。在无脊椎动物中,氧化还原平衡是疾病与生理学变化相互作用的结果,是先天性免疫不可缺少的部分[10]。外界生物和非生物胁迫诱导体内产生并积累大量的ROS,氧化还原平衡就会被打破,这些抗氧化酶的表达量会增加以抵御ROS带来的危害[11]。
过氧化物还原酶(Prx)属于进化保守的抗氧化分子家族,在清除过氧化物、传导信号等方面发挥着重要作用,一直受到研究者的关注。近年来,Prx基因在细菌、真菌、哺乳动物、植物中相继被发现,同时,在甲壳动物中也逐渐被发现。为丰富甲壳动物Prx基因的研究数据,深入了解Prx基因在甲壳动物中的免疫防御机制,本文就近年来Prx基因在甲壳动物中的研究进行了综述,旨在为以后更好地研究甲壳动物Prx基因的生物学功能提供参考。
1 Prx 概述
Prx属于抗氧化蛋白超家族,通过硫氧还蛋白作为氢供体来消除氢过氧化物,有效调节体内ROS水平,起到抗氧化作用[12-13]。在酿酒酵母中首次发现了Prx蛋白,分子质量约为25 kDa。后续研究发现,该蛋白广泛存在于动植物中,如小麦(Triticum aestivumL.)[14]、发状念珠藻(Nostoc flagelliforme)[15]、七鳃鳗(Lampetra japonicum)[16]、小鼠(Mus musculus)[17]、褶纹冠蚌(Cristaria plicata)[18]等。Prx主要定位在细胞质和线粒体中,同时,细胞质和线粒体也是细胞中ROS的主要产生部位,因此,Prx被认为在防止ROS 引起的氧化损伤中起重要作用[19-20]。
在哺乳动物中,相关研究已经鉴定了6 种不同的Prx 亚型,包括Prx1、Prx2、Prx3、Prx4、Prx5 和Prx6[13]。根据在清除ROS反应中起催化作用的半胱氨酸(cysteine,Cys)残基的数目和位置,Prx 可分为3 个亚家族:典型2-Cys Prx、非典型2-Cys Prx 和1-Cys Prx[21]。Prx1~Prx4 属于典型2-Cys Prx 亚家族,且这4个亚型的N端和C端各含有1个保守的半胱氨酸(Cys)残基。Prx5 的N 端和C 端也各含有1个保守的Cys 残基,但是C 端的Cys 残基保守性较低,属于非典型2-Cys Prx 亚家族;Prx6 属于1-Cys Prx亚家族,其仅在N端含有1个保守的Cys残基[22]。通过比对这6 个成员的同源性发现,Prx1~Prx4 之间具有较高的同源性,Prx6 与Prx1~Prx4 之间的同源性为40%,而Prx5 和Prx1~Prx4 的同源性仅为10%[23]。
植物中的Prx 可分为4 类:1-Cys Prx、2-Cys Prx、PrxⅡ和PrxQ。PrxⅡ类成员较多,包含PrxⅡA、PrxⅡB、PrxⅡC、PrxⅡD、PrxⅡE 和PrxⅡF[24]。其中,植物中只有1-Cys Prx 包含1 个保守的Cys 残基,其他类别均包含2个保守的Cys残基。这些Prx大多可以在哺乳动物中被发现,但PrxQ只存在于低等真核生物和细菌中。同时,根据序列同源性和结构相似性,Prx又可分为6个亚家族(表1)。
大多数Prx 都是膜内蛋白酶,只有Prx4 可以依靠其典型的N 端分泌性信号肽分泌至细胞膜外来发挥功能。哺乳动物的Prxl、Prx2 和Prx6 主要定位于细胞质中[24-25],Prx3定位于线粒体上,Prx4定位于内质网和细胞外间隙中[26],Prx5 定位于过氧化物酶体中[27-28]。Prx 家族位置的分布同时也决定了其特定的功能。
1.1 典型2-Cys Prx
典型2-Cys Prx为Prx家族中最大的一类,在肽链N端和C端Cys残基周围的序列都具有高度的保守性[29],其N端的保守序列是“FYPLDFTFVCPTE”,C端的保守序列是“GEVCPA”。在发挥抗氧化作用的过程中,首先,典型2-Cys Prx 的N 端Cys 残基被氧化成次磺酸基团(Cys-SOH)[30],然后,该基团与另一个C 端Cys 残基发生反应,通过二硫键形成首尾连接的同源二聚体[31],最后,形成的二硫键被硫氧还蛋白还原,典型2-Cys Prx重新恢复活性。

表1 基于序列同源性和结构相似性的Prx分类Table 1 Prx classification based on sequence homology and structural similarity
1.2 非典型2-Cys Prx
作为Prx 家族最后被发现和研究的一个亚型,Prx5肽链N端和C端的Cys残基周围也具有保守序列,其中N端的保守序列是“VPGAFTPGCSKTHLP G”,C 端的保守序列是“DGTGLTCSL”。非典型2-Cys Prx 的反应机制与典型2-Cys Prx 具有相似之处,其N 端保守的Cys 残基也被氧化成次磺酸基团(Cys-SOH),不同的是,生成的次磺酸基团(Cys-SOH)将会与自身C 端的Cys 残基形成分子内二硫键[32]。
1.3 1-Cys Prx
Prx6 的N 端保守序列为“PVCTTE”,其初始部分的反应机制与典型2-Cys Prx和非典型2-Cys Prx相同,都是N 端保守的Cys 残基被氧化成次磺酸基团(Cys-SOH),不同之处在于,由于附近没有可以参与反应的Cys残基,故无法形成二硫键。因此,需要依赖其他(非硫氧还蛋白)作为氢供体将次磺酸还原为初始状态。有报道还发现,在π型谷胱甘肽S-转移酶(πglutathioneS-transferase,πGST)的介导下,Prx6 与谷胱甘肽(glutathione, GSH)形成二硫键,并重新恢复活性[33]。
2 甲壳动物的Prx 基因
在甲壳动物中,TU等[34]首次系统化地对拟穴青蟹(Scylla paramamosain)Prx基因进行了分析。与哺乳动物略有不同的是,甲壳动物Prx 亚型分为Prx1/2、Prx3、Prx4、Prx5和Prx6。拟穴青蟹Prx1/2比对结果符合典型2-Cys Prx 的结构特征,但在系统进化树中,却是和其他具有密切遗传关系的甲壳动物Prx 先聚为一个新支后,再与Prx1~Prx4 聚集。因此,伴随着这种情况的Prx基因被命名为Prx1/2,无脊椎动物中的Prx1/2基因被推测是Prx1和Prx2的祖先基因,即未分化的Prx基因。卜瑞倩[35]在对斑节对虾(Penaeus monodon)的研究中发现了1 个PmPrxn基因,多重序列比对分析显示,PmPrxn的保守性很低,与印度明对虾(Fenneropenaeus indicus)和三疣梭子蟹(Portunus trituberculatus)PmPrxn 的同源性分别为45%和44%;且系统进化树显示,PmPrxn 单独为一支,不与Prxl~Prx4 聚集,属于典型2-Cys Prx。这表明PmPrxn 是从Prx 超家族中新发现的2-Cys Prx的成员。
2.1 甲壳动物Prx 家族基因序列特征
目前,国内外的一些研究得到了多种甲壳动物Prx基因的全长序列,但许多研究只发现了Prx基因中的一种或几种亚型。表2 显示了NCBI 数据库(https://www.ncbi.nlm.nih.gov/)中甲壳动物Prx基因的开放阅读框及其编码的氨基酸长度。从中可知,大部分的甲壳动物都只是研究了Prx基因,即未分化的基因,而对于其他亚型的研究较少。同时还发现,不同甲壳动物各自Prx、Prx4和Prx6基因的开放阅读框及其编码的氨基酸长度相同,而各自Prx3和Prx5基因的开放阅读框及其编码的氨基酸长度略有不同。其中:拟穴青蟹Prx3基因的开放阅读框最长,为690 bp,中华绒螯蟹和日本对虾Prx3基因的开放阅读框长度相同,为681 bp;脊尾白虾Prx5基因的开放阅读框最长,为585 bp,而斑节对虾与中华绒螯蟹的分别为570和552 bp。
2.2 甲壳动物Prx 的生物学分析
通过在线软件ExPASy(http://www.expasy.org/proteomics)对表2 中甲壳动物Prx 家族的氨基酸序列进行生物学分析,结果发现,甲壳动物Prx家族蛋白质在进化过程中较为或者高度保守。在亲疏水性方面,Prx、Prx4 和Prx6 都是亲水性蛋白;日本对虾的Prx3和中华绒螯蟹的Prx5是亲水性蛋白,其余甲壳动物的Prx3 和Prx5 都是疏水性蛋白。信号肽预测结果显示,只有Prx4 含有信号肽,其他均无信号肽,该结果与在哺乳动物中发现的一致。跨膜结构分析表明,只有Prx4 具跨膜结构域,其余均无。此外,亚细胞定位分析结果(表3)表明,Prx 和Prx6定位在细胞质中的概率较大,Prx3 定位于线粒体上,Prx4 有较大概率定位于线粒体中,Prx5 定位于过氧化物酶体上。以上所述的这些结果与章波等[13]的研究结果一致。
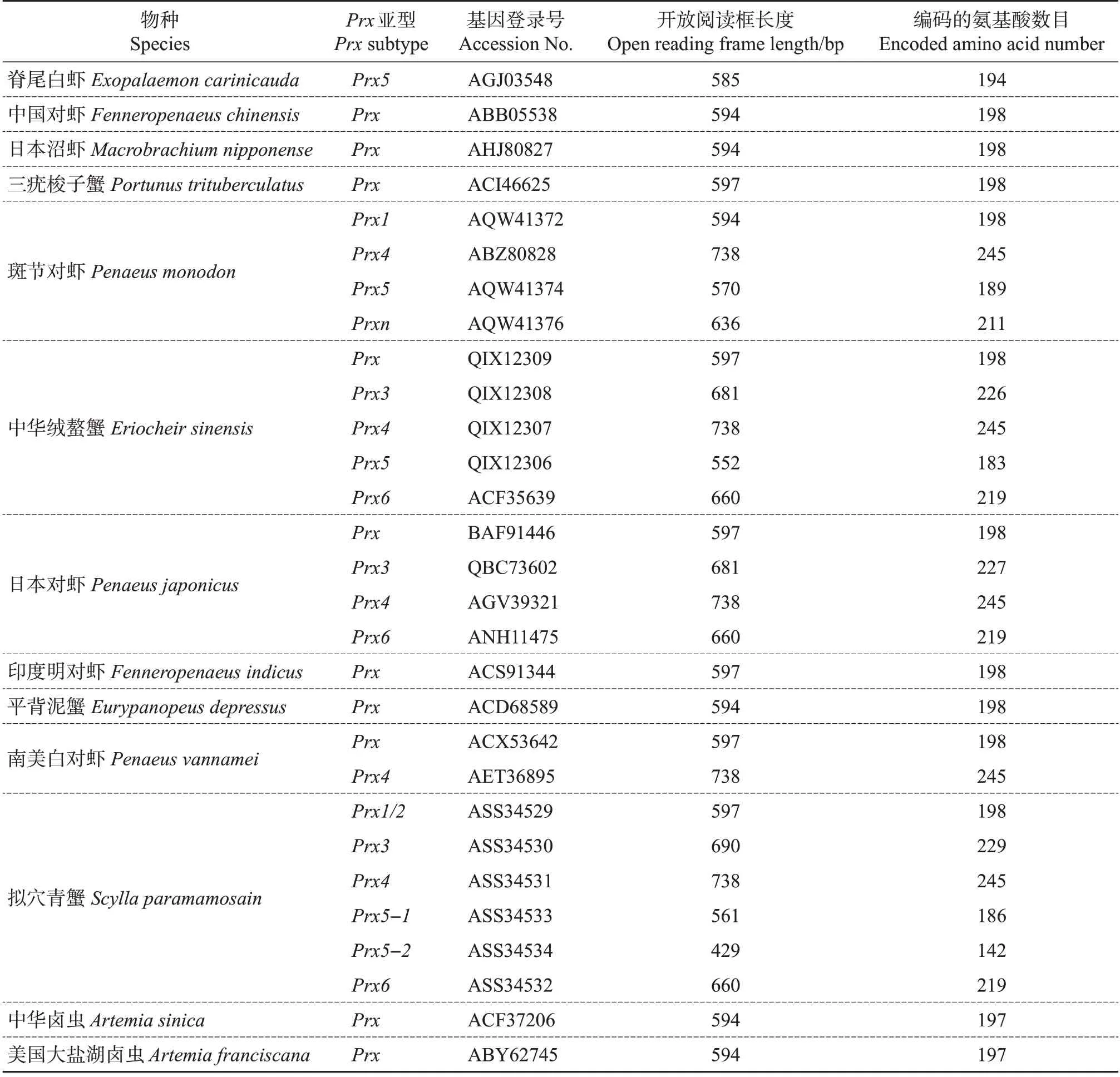
表2 甲壳动物Prx基因及其编码的氨基酸序列Table 2 Prx genes and their coding amino acid sequences of crustacean
2.3 甲壳动物Prx 系统进化分析
从NCBI 中筛选出几种哺乳动物Prx亚型基因的氨基酸序列,分别为人(Homo sapiens)的Prx1(NP_001189360.1)、Prx2(NP_005800.3)、Prx3(AAI13724.1) 、 Prx4 (NP_006397.1) 、 Prx5(AAI13724.1)和Prx6(NP_004896.1);家鼠(Mus musculus) 的 Prx2 (NP_001304314.1) 、 Prx3(EDL01849.1)和Prx4(AAH19578.1);褐家鼠(Rattus norvegicus)的Prx1(AAH88118.1)、Prx2(AAH58481.1) 、 Prx3 (EDL94585.1) 、 Prx4(AAH59122.1)和Prx6(NP_446028.1);牛(Bos taurus)的Prx1(NP_776856.1)和Prx5(AAG53661.1);原鸡(Gallus gallus)的Prx6(NP_001034418.1)。利用邻接法,对上述哺乳动物的Prx蛋白序列与表2中已知
的部分甲壳动物Prx 蛋白序列构建系统进化树(图1),分析发现:中华绒螯蟹Prx3与拟穴青蟹Prx3首先聚在一起,然后再与人Prx3、家鼠Prx3和褐家鼠Prx3聚为一支,甲壳动物Prx4、Prx5和Prx6亦是如此;中华绒螯蟹Prx4与拟穴青蟹Prx4先聚在一起,再与人Prx4、家鼠Prx4和褐家鼠Prx4聚为一支;中华绒螯蟹Prx5、拟穴青蟹Prx5和脊尾白虾Prx5先聚在一起,再与人Prx5和牛Prx5聚为一支;中华绒螯蟹Prx6和拟穴青蟹Prx6先聚在一起,再与原鸡Prx6、人Prx6和褐家鼠Prx6聚为一支;甲壳动物的Prx则不与哺乳动物的Prx1和Prx2聚在一起,而是形成了一个新的典型2-Cys Prx分支。这与TU等[34]的研究结果相同。
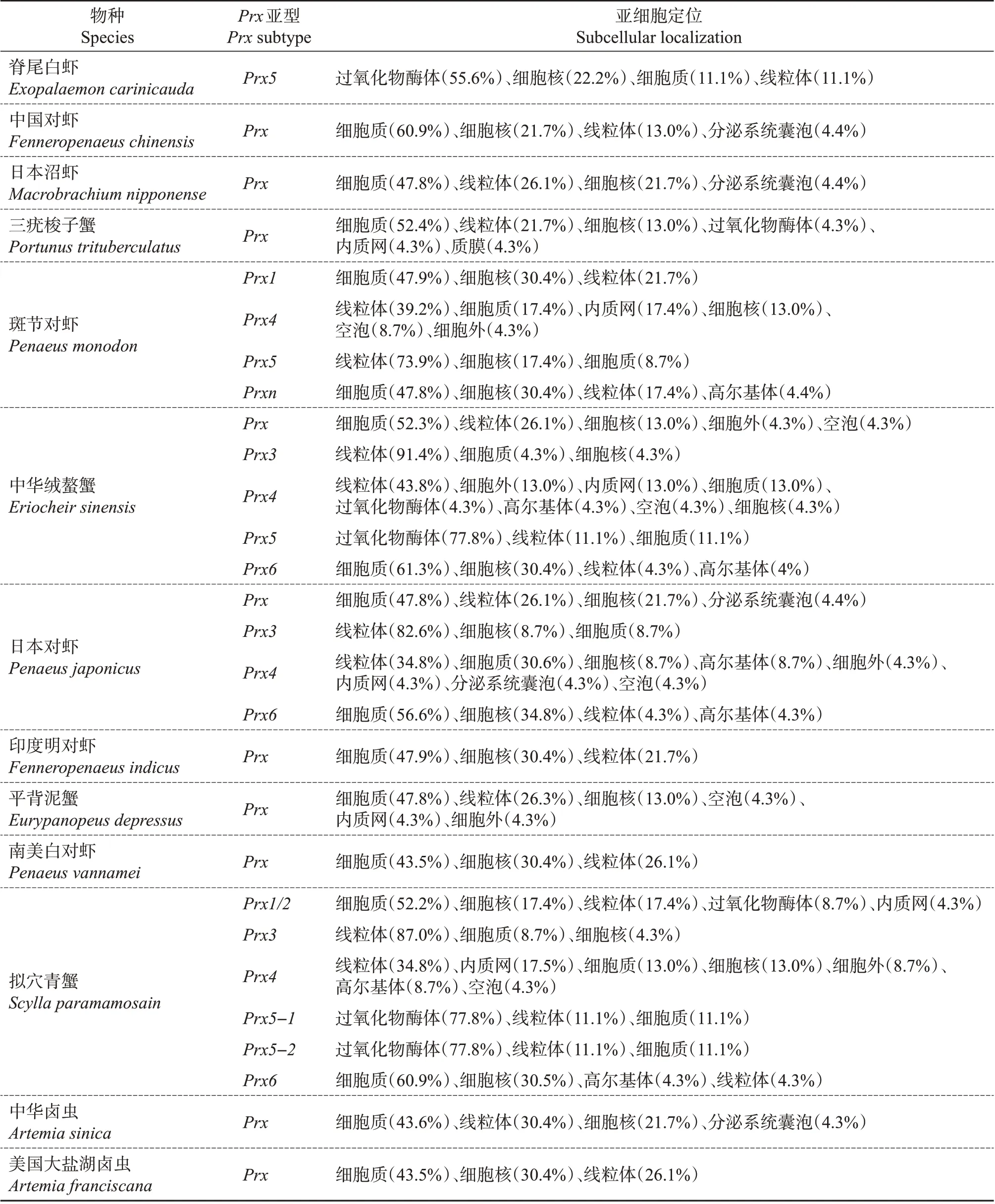
表3 亚细胞定位分析Table 3 Subcellular localization analysis

图1 基于9种动物Prx基因蛋白序列构建的系统进化树Fig.1 Phylogenetic tree based on the protein sequences of Prx genes in nine animals
2.4 甲壳动物Prx 在不同组织中的表达分析
Prx于不同组织中广泛表达,推测Prx可能介入细胞代谢的多种生理功能;然而,其在不同组织中的表达水平不同,这证明它们具有组织偏好性,通常在免疫、发育组织中的表达量相对较高。在体液免疫和基础代谢中,甲壳动物的肝胰腺发挥着重要的作用,在功能上与哺乳动物的肝脏和胰脏类似[36]。多数与免疫相关的基因在肝胰腺中都有较高的表达量[37]。卜瑞倩[35]发现,PmPrx1在斑节对虾鳃、肌肉、肠和脑中具有较高的表达水平,这意味着PmPrx1的表达具有组织偏好性。PmPrx5在肌肉中的表达量最高,其次是在胃、心脏和鳃中,这意味着PmPrx5在调节氧化还原平衡的过程中,可预防ROS 过度积累对组织产生的氧化损伤。ZHANG等[38-39]研究发现,中国对虾Prx在卵巢、肠和肝胰腺中高表达,Prx4在性腺和肝胰腺中的表达量较高。中华绒螯蟹中EsPrx、EsPrx3、EsPrx4和EsPrx5在血细胞、心脏和肠道中的表达量都相对较低,而在肝胰腺中表达量均最高[40]。中华绒螯蟹血细胞在细胞免疫中发挥着重要作用,然而上述4种EsPrx基因在血细胞中低表达,推测健康的中华绒螯蟹在没有受到刺激的情况下,体内免疫和ROS都处于相对平衡的状态。TU等[34]研究发现,拟穴青蟹6种SpPrxs基因的表达模式有明显差异:SpPrx3在肝胰腺、肌肉和心脏等能量消耗较高的器官中的表达量较高,说明SpPrx3可能与线粒体活性氧稳态紧密相关。SpPrx1/2在肝胰腺、鳃、肌肉和肠道中均有较高的表达量。SpPrx4在肝胰腺中高表达。SpPrx6在血细胞中高度表达,与中华绒螯蟹Prx6的表达水平相似[41],表明SpPrx6可能主要在血细胞中起作用。此外,SpPrx5-1在心脏、鳃、肝胰腺、肌肉和肠道中都有一定量的高表达,而SpPrx5-2在这些组织中的表达量极低。
综上所述,甲壳动物Prx1/2、Prx2、Prx3、Prx4、Prx5、Prx6在组织中广泛表达,且在肝胰腺中均具有较高的表达量,从侧面也印证了肝胰腺在甲壳动物中的重要免疫作用。
3 Prx 的生物学功能
Prx家族蛋白在清除自由基与抗氧化活性方面发挥着至关重要的作用。在氧化应激状态下,Prx家族基因表达量显著上调,以清除细胞胁迫下产生的过多活性氧,保护机体免受活性氧损伤。同时,Prx 也参与细胞信号转导。研究表明,过氧化氢(H2O2)作为细胞内的信号分子,使信号通路中的蛋白质活化或失活,可作为细胞内的二级信使。过氧化物还原酶可以调整体内H2O2浓度,因此,过氧化物还原酶可以间接地调节细胞内的信号传递[42-44]。过氧化物还原酶具有提高自然杀伤细胞活性的能力,并在机体免疫应答过程中发挥重要作用[45]。过氧化物还原酶Ⅰ型和Ⅱ型在哺乳动物中又被称为自然杀伤细胞增强因子A 和B。Prx 通过细胞表面受体介导细胞信号转导途径,减轻氧化应激引起的危害,可用于疾病的治疗。基于该家族过氧化物酶活性,Prx 在肿瘤的治疗中可能具有遏制肿瘤细胞生长的功能[46-47]。
3.1 细菌及病毒感染下甲壳动物Prx的生物学功能
谢亚凯[48]在日本囊对虾中发现,鳗弧菌感染引起的H2O2可以诱导MjPrx6的表达上调,MjPrx6通过发挥谷胱甘肽过氧化物酶活性调节对虾体内H2O2水平,维持对虾体内的氧化还原稳态,防止H2O2过度积累。在嗜水气单胞菌感染情况下,中华绒螯蟹中的EsPrx、EsPrx3、EsPrx4和EsPrx5基因的表达量均显著上升,表明嗜水气单胞菌在中华绒螯蟹体内诱导产生大量ROS,这就需要大量的抗氧化酶来抵御ROS过度积累带来的危害。感染24 h后,EsPrx3和EsPrx5的表达量分别提高了16 倍和15倍,而EsPrx和EsPrx4则分别提高了5 倍和9 倍[40]。现研究发现,细胞内约90%的ROS在生物氧化磷酸化过程中会返回到线粒体中[47]。
ZHANG 等[38]发现,中国对虾感染白斑综合征病毒(white spot syndrome virus,WSSV)后,FcPrx4在血细胞和肝胰腺中的表达量显著上调。体外制备融合蛋白并经活性分析,FcPrx4可在二硫苏糖醇存在下还原H2O2。DUAN等[23]对脊尾白虾进行人工感染鳗弧菌和WSSV,发现其血细胞和肝胰腺中的EcPrx5表达在早期上调,而后逐渐下降。这表明EcPrx5可能参与了对鳗弧菌和WSSV 的暂时免疫应答,同时,在受到鳗弧菌和WSSV攻击后,EcPrx5在血细胞和肝胰脏中的表达谱有所不同,这可能是因为血细胞和肝胰脏的功能不同。母昌考[41]对中华绒螯蟹进行鳗弧菌刺激,发现在血细胞中EsPrx6的表达量在3~12 h 内持续下降,刺激后12 h 降至最低水平,显著低于对照组,24 h 后又开始上升,表明EsPrx6参与了中华绒鳌蟹感染鳗弧菌的免疫应答过程。CHEN 等[49]对三疣梭子蟹进行藻溶弧菌(Vibrio alginolyticus)感染,Prx的表达量在初期阶段稍有增加,而后Prx转录水平逐渐下降,并在12 h时下降到最低,仅为对照组的18%。表明Prx可能参与了三疣梭子蟹的细菌感染反应。
Prx4 在过氧化物还原酶家族中是唯一具有分泌性信号肽功能的蛋白,首次发现Prx4作为损伤相关分子模式(damage-associated molecular patterns,DAMPs)发挥抗病毒作用。在日本囊对虾中发现,在受到WSSV 感染后,Prx4 的表达量明显上调,胞外Prx4 的分泌增加。作为DAMPs 的胞外MjPrx4通过激活转录因子Dorsal使相关抗病毒抗菌肽表达上调,从而抑制WSSV 的增殖。这为甲壳动物由WSSV 引起的疾病的预防和治疗提供了新的研究思路[50]。
3.2 理化因子刺激下甲壳动物Prx的生物学功能
作为小型甲壳动物,中华卤虫在水产养殖中具有颇高的营养价值。周茜[51]研究了被硫酸铜刺激的中华卤虫幼体中Prx基因的表达变化,结果显示:在刺激6 h 后,Prx的表达水平略有增加(P>0.05),而后逐渐减少,12 h 时降至最低;刺激后12~24 h 时,Prx的表达水平急剧增加,24 h时达到峰值。说明硫酸铜刺激后并且随着时间的增加,大量的活性氧在体内产生,诱导Prx基因的表达上调,以清除过多活性氧,防止对正常细胞造成损伤。卜瑞倩[35]研究了斑节对虾在pH、盐度和重金属胁迫下过氧化物还原酶的表达模式,结果显示:PmPrx1在重金属铜刺激下,表达量呈逐渐下降的趋势,于48 h时降至最低,与对照组差异显著(P<0.05);在pH 7 的海水处理下,PmPrx1的表达量逐渐升高,12 h时升至最高,与对照组差异显著(P<0.05),后逐渐下降并恢复至正常水平;在pH 9 的海水处理下,仅在96 h 时表达量极显著升高(P<0.01)。在高盐应激时,PmPrx1的表达量在8 h最高(P<0.01),而后逐渐降低;低盐应激时,在16 h表达量最高(P<0.01)。这些结果表明PmPrx1可能参与了非生物毒性应激。
综上所述,Prx在甲壳动物中的主要作用为清除自由基和抗氧化(表4),在氧化应激的情况下,Prx家族基因表达量明显增加,以清除氧化应激产生的过多活性氧。Prx基因的表达可作为确定环境对生物影响的重要指标,检测其表达变化已成为毒理学研究的重要方法[52]。

表4 甲壳动物Prx的生物学功能研究汇总Table 4 Summary of biological function research of crustacean Prx
4 展望
Prx 广泛存在于多种生物体中,在生物体对活性氧分子的防御中起着至关重要的作用。随着研究的深入,这个家族的生理生化功能已逐渐显现在人们面前。许多研究表明,Prx 参与了多种生物学过程,包括氧化还原调节,细胞增殖、分化和凋亡等。目前,虽然在许多物种中发现了Prx,但在甲壳动物中,尤其是虾蟹Prx的研究仍处于初期阶段,还有许多物种的过氧化物还原酶基因尚未被发现,研究得还不够深入,未来还需要从以下2 方面进行探索:一是克隆出更多的甲壳动物Prx基因亚型,同时,需要对甲壳动物中未分化的基因进行更深入的研究。二是探究Prx在甲壳动物生物和非生物胁迫中抗氧化能力的生物学功能,对其在氧化条件下的作用机制和其他功能进行深入研究。总之,通过研究甲壳动物过氧化物还原酶,可以加深人们对无脊椎动物免疫防御机制的了解,为进一步研究甲壳动物固有免疫作出贡献。
