昆虫N6-甲基腺嘌呤的研究进展
2021-07-10赵书荻吴小锋
赵书荻,吴小锋,2*
(1.浙江大学动物科学学院蚕蜂研究所,杭州 310058;2.浙江省蚕蜂资源利用与创新研究重点实验室,杭州 310058)
RNA修饰是真核生物中典型的表观修饰方式,通过行使转录后调控功能来响应环境的改变。目前,已有150 余种RNA 修饰被发现于不同类型的RNA 中[1],其中N6-甲基腺嘌呤(N6-methyladenosine,m6A)是最常见的一种RNA修饰[2],它广泛存在于低等到高等的各种真核生物中,包括真菌(酵母)[3]、植物[4]、昆虫[5]和哺乳动物[6]。m6A 能够影响RNA 加工和代谢中的可变剪接[7]、出核转运[8]、翻译[9]和稳定性[10],从而在生物发育、疾病、干细胞分化、免疫和行为控制等生命活动中发挥重要作用[11]。
早在20 世纪70 年代,m6A 就已被发现[12],但有关其机制和功能的深入研究直到2010 年左右才逐渐开始[3]。此后,随着RNA 甲基化研究技术的迅速发展,尤其是甲基化RNA 免疫共沉淀测序(methylated RNA immunoprecipitation sequencing,MeRIP-seq)[13-14]技术的应用与改进[15],对m6A 研究的进展并助推其逐渐成为表观遗传学前沿的研究热点作出了突出贡献。在昆虫领域以果蝇为主要模式生物的相关研究也取得了很大突破。本文主要介绍和总结近年来在昆虫方面m6A的研究进展,阐述其在昆虫中的动态调控和生物学功能。
1 m6A 的动态调控
在昆虫体内,m6A修饰是一个可逆的过程,其丰度可根据生理需求或环境变化而发生动态改变,从而调控自身的生理状态[16]。
1.1 m6A 的调控酶与识别蛋白
m6A 的动态调控是由甲基转移酶复合体(methyltransferase complex, MTC)和去甲基化酶的双向调控实现的,m6A修饰能够被带有YTH结构域的蛋白识别从而调控下游通路(图1)。m6A的调控酶和识别蛋白最早是从人类细胞中被分离并命名的[17],其同源物广泛存在于包括果蝇和家蚕在内的多种模式生物中[18-19](图2)。
1.1.1 甲基转移酶复合体
m6A 的甲基转移酶主要由METTL3、METTL14[20]、WTAP[21]、KIAA1429 和 RBM15/RBM15B[22]构成,在果蝇中,它们的同源物分别为Ime4、KAR4、Fl(2)d、Vir和Nito[18]。
METTL3是MTC上一个保守的亚基,具有将甲基从S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)转移到m6A 位点的催化活性[23],在甲基化过程中起核心作用。METTL14 能够稳定Ime4 与RNA 的结合,它同样具有催化甲基转移酶的结构域,但由于相邻基团的空间约束使其无法与SAM 结合[24]。WTAP也是在MTC中起辅助作用的酶,它本身不能介导甲基转移,也无法影响METTL3-14 复合体的催化活性,但它可以使MTC 定位在mRNA 前体(pre-mRNA)修饰因子富集的核散斑体(nuclear speckles)上,这些因子可以提高MTC 的催化活性[25]。METTL3、METTL14 和WTAP 构成MTC 的核心,其他2 个成分KIAA1429 和RBM15 则与引导MTC识别并结合特定的mRNA有关[22,26]。
1.1.2 去甲基化酶
目前已发现的m6A 去甲基化酶有2 种,分别是FTO[27]和ALKBH5[28]。FTO 最初被发现是由于它能够催化单链DNA 的去甲基化反应[29],在这个基础上,JIA 等[27]发现FTO 在体外能够消除RNA 的m6A修饰,干扰FTO 的表达会导致细胞m6A 的积累,而其过表达则会使m6A修饰水平降低。
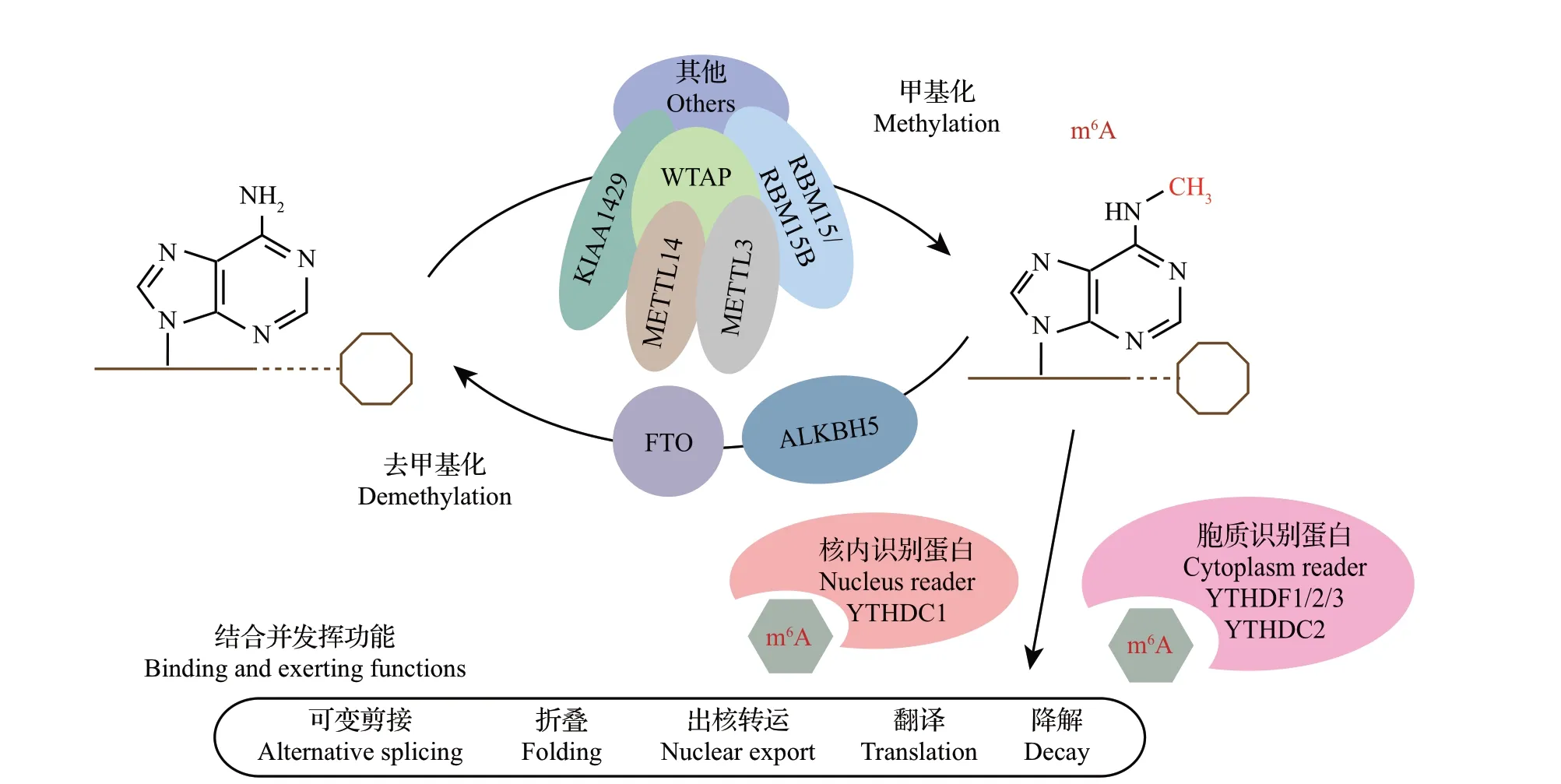
图1 m6A的动态调控与识别蛋白Fig.1 Dynamic regulation and reader proteins of m6A
ALKBH5 同样能催化m6A 去甲基化反应,但其序列特异性较强,无法识别单链RNA上其他类型的甲基化修饰;ALKBH5 定位在细胞核内,其缺失会导致新合成的mRNA无法形成多聚A(polyA)尾[27]。这说明ALKBH5 在mRNA 出核转运调控中具有重要意义,同时也暗示了m6A修饰在mRNA成熟过程中的重要作用。
1.1.3 m6A 识别蛋白
m6A的修饰作用需要识别蛋白的选择性结合才能发挥,m6A 的功能性结合蛋白主要有YTHDC 家族的YTHDC1、YTHDC2 和YTHDF 家族的YTHDF1、YTHDF2、YTHDF3。
YTHDC1 是定位在细胞核内的m6A 识别蛋白[30],能够识别外显子上的m6A修饰来调控RNA剪接[31],还能通过与RNA出核转运因子互作来促进成熟RNA 的出核转运[8]。YTHDC2 和YTHDF 家族成员都是定位在细胞质内的m6A 识别蛋白,其中:YTHDF1 参与mRNA 翻译的起始并能够增强其翻译效率,YTHDF2 则能够加快带有m6A 修饰的mRNA 的降解[32],而YTHDF3 和YTHDC2 能够同时影响mRNA的翻译与降解[33-34]。
1.2 m6A 的分布
m6A的修饰位点具有一定的规律性。对果蝇和家蚕进行MeRIP-seq 分析发现,绝大多数m6A 修饰位点出现在RRACH 序列[35-36](其中R 指嘌呤,H 指非G碱基)上,说明m6A修饰具有序列特异性,但相邻碱基在m6A修饰中的功能尚不明确。
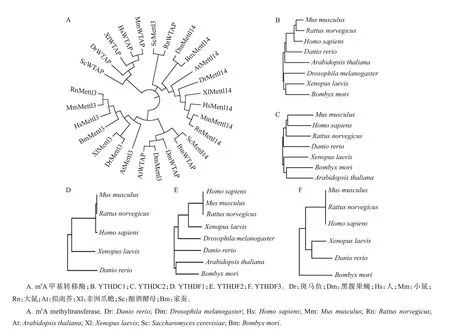
图2 不同物种m6A相关蛋白同源物系统进化分析Fig.2 Phylogenetic analysis of homologous proteins related to m6A of various species
在果蝇和家蚕中,m6A 主要分布于成熟mRNA的非翻译区(untranslated region, UTR)和外显子上[35-36](图3A~B),并在起始和终止密码子附近集中分布[15],这暗示了m6A 在调控RNA 的出核转运、翻译和稳定性中的重要作用。当细胞处于不同的环境状态时,其m6A的分布会有很大的差异。在体外培养的家蚕细胞中,其内含子中m6A修饰水平显著高于体内细胞的内含子中m6A修饰水平[37](图3B~C),这可能与m6A对体外培养细胞mRNA剪接的调控增强有关。虽然目前并没有相关的实验依据,但可以确定的是,体内细胞受到内环境中各种因子的作用,m6A 分布的差异必然与这些因子的调控作用有关。当被家蚕核型多角体病毒(BnPNV)感染后,家蚕中肠mRNA的m6A分布也会发生改变,3′UTR的m6A 水平升高,而外显子的m6A 水平显著下降[37](图3B 和D),这可能与病毒感染细胞后降低宿主mRNA的稳定性和抑制其出细胞核翻译有关。
2 m6A 的生物学功能
m6A 修饰能够影响mRNA 的代谢,从而调控个体的生命活动。这一过程主要通过相关蛋白调节特定组织或特定RNA中的m6A水平来实现。目前,在昆虫中已知的m6A 参与调控的生命活动主要有性别分化、神经系统发育和细胞分裂;除此之外,m6A调控酶和结合蛋白还具有其他一系列生物学功能(表1),但这些功能是否都与m6A 有关并未得到完全验证。
2.1 m6A 控制果蝇的性别分化
果蝇的性染色体为X 和Y,X 染色体的数目决定果蝇的性别,在这一过程中起关键作用的是Sxl基因。在XX 型果蝇中,Sxl正常表达,其下游有2条通路:一方面,Sxl激活下游tra的表达,TRA 能够与雌雄个体中均存在的TRA2 一起调控DSX 的剪接,这样产生的DSXF能够使雄性发育所需的基因无法表达;另一方面,Sxl抑制msl-2的表达,使其介导的剂量补偿效应无法产生,从而使个体发育为雌性(图4A)。而在XY 个体中,Sxl不能正常表达,DSX 被以另一种方式剪接,这样产生的DSXM会抑制雌性发育所需基因的表达,同时,msl-2的表达被激活,产生剂量补偿效应,使个体正常发育为雄性(图4B)[45]。
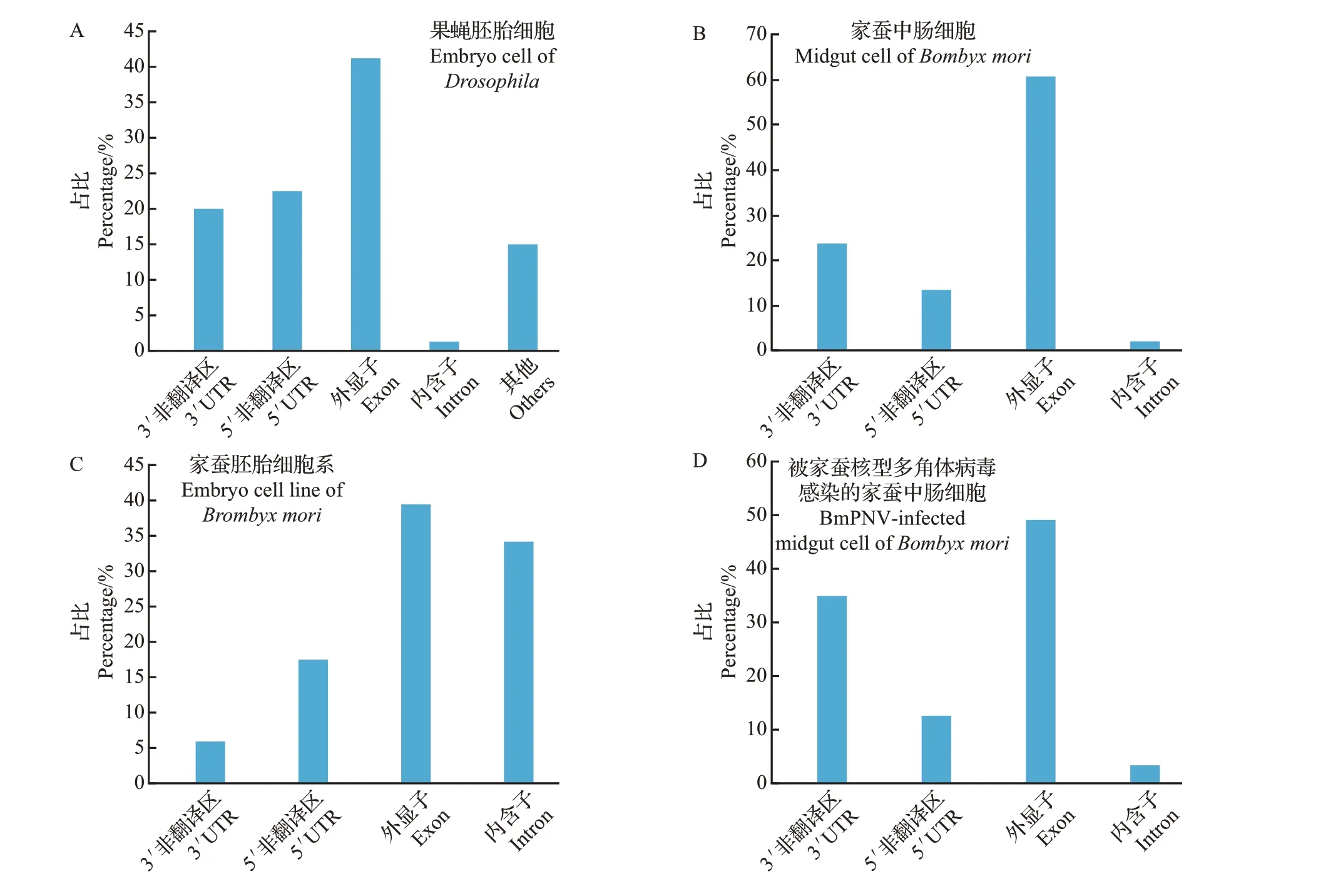
图3 m6A修饰在mRNA中的位置分布Fig.3 Location of m6A modification in mRNA
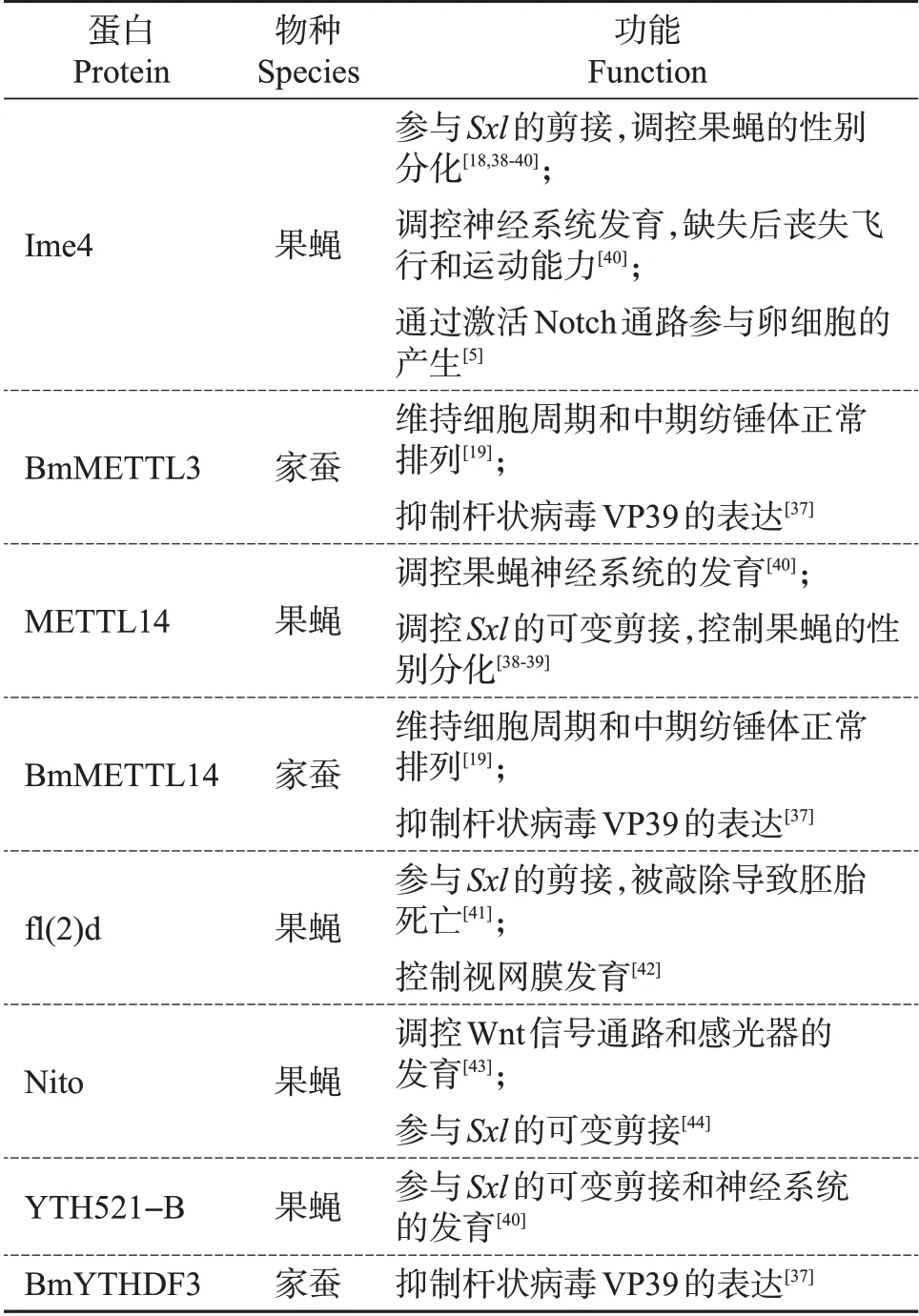
表1 m6A相关蛋白的生物学功能Table 1 Biological functions of m6A related proteins
m6A 修饰能够通过影响Sxl的可变剪接来影响其表达,从而控制果蝇的性别分化。Sxl在雌雄个体中有2种不同的剪接形式(图5)。在雌性个体中,包含终止密码子的外显子3 被剪切,SXL 编码蛋白可以正常合成[38]。缺失Ime4基因的雌性果蝇存活率明显降低,这一现象可通过补回Ime4或移除msl-2以抑制剂量补偿效应来拯救,但部分存活的雌性果蝇会产生雄性特有的性状[18]。进一步研究其机制发现,缺失Ime4导致m6A 水平下降和Sxl的正常剪接减少[40],同时会抑制Sxl在生殖细胞和胚胎中的表达[39],说明m6A能够通过影响Sxl的可变剪接来调控其下游通路,从而介导果蝇的性别分化。
2.2 m6A 调节果蝇神经系统的功能
在果蝇的生命周期中,m6A 修饰水平会随发育阶段的不同而发生变化,m6A 的水平直接影响果蝇的发育,尤其是对神经系统功能的完善具有至关重要的作用。
果蝇胚胎的RNA原位杂交结果显示,m6A甲基转移酶和识别蛋白在中枢神经系统中富集表达。当果蝇的Ime4基因被敲除后,果蝇寿命缩短且出现明显的行为缺陷,包括丧失飞行和运动能力、翅膀伸出等。在全身或神经系统中表达Ime4 可以拯救这些行为缺陷,而在中胚层中表达则没有效果。观察发现,缺失Ime4基因的果蝇的神经肌肉接头生长旺盛,突触增多且出现膨胀现象。取脑组织进行转录组测序发现,存在差异表达或剪接的基因多与运动有关;将这些基因与细胞m6A 测序结果进行对照,发现其中存在大量m6A 修饰位点[40]。这些结果说明,果蝇神经系统的发育和功能依赖大量m6A修饰的调控,当m6A 修饰被干扰后,就会影响下游相关基因的表达和剪接,从而使个体的发育和行为产生缺陷。
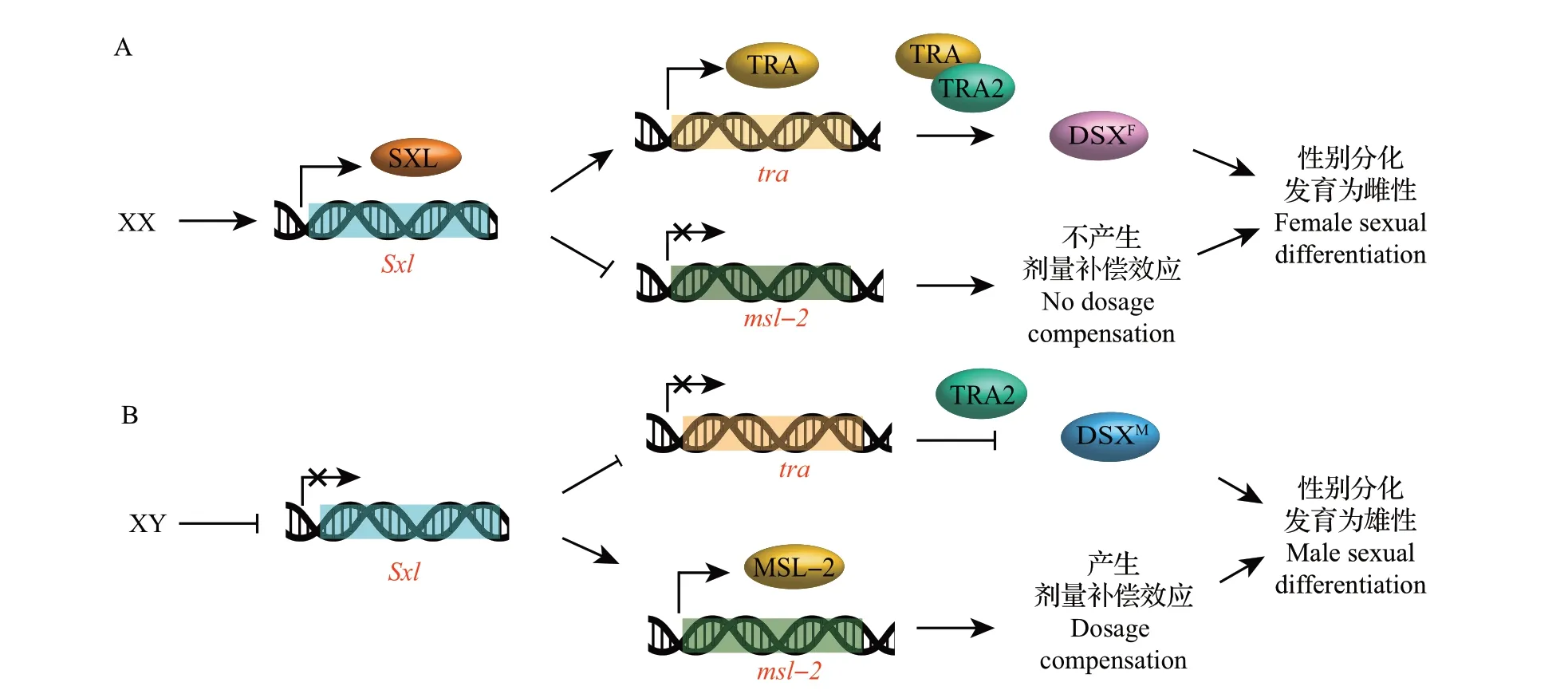
图4 Sxl介导性别分化的下游通路Fig.4 Downstream pathways of sexual differentiation mediated by Sxl
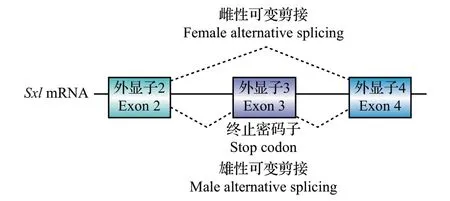
图5 Sxl mRNA的可变剪接Fig.5 Alternative splicing of Sxl mRNA
2.3 m6A 影响细胞周期
对脊椎动物的研究表明,m6A 能够控制干细胞的分化和凋亡,而在昆虫中,m6A对细胞分裂具有重要的调控作用[46]。敲除果蝇的Ime4基因会导致果蝇卵巢出现缺陷:卵泡与多余的滋养细胞混合,其中的卵细胞无法定位在卵泡上,也无法完成后续的有丝分裂,并在卵黄形成前被降解。这直接导致果蝇无法正常产生卵细胞。进一步的研究发现,缺失Ime4基因的果蝇中Notch通路的激活被下调。在这些果蝇的卵巢中过表达活化的Notch 蛋白后,则不再出现卵巢缺陷[5]。这些结果说明,m6A 能够介导Notch 通路的激活来调控果蝇卵细胞的分裂和成熟。在家蚕中,干扰m6A甲基转移酶的表达会显著降低细胞m6A 水平,同时,使细胞停滞在G1期而无法顺利完成分裂[36]。
3 小结与展望
m6A 修饰广泛存在于各种真核生物中。目前,研究较多的物种主要有酵母[3]、拟南芥[47]、斑马鱼[48]和小鼠[13]。在昆虫中,m6A 的相关研究主要局限于双翅目的果蝇,这可能与多年来果蝇研究中积累了较为完备的实验技术、数据库和调控通路模型有关。而m6A在其他昆虫中的研究仍有很多空白,在不同种属的昆虫中开展相关研究将可能揭示m6A更多未知的调控功能或作用机制。
m6A 修饰是一个动态调控的过程,并由特异性识别蛋白结合发挥下游调控功能,但其实际的调控过程很可能比已知的模型要复杂得多。一方面,m6A修饰在mRNA上的分布存在明显的偏好性,这其中必然存在一定的机制来调整m6A 的分布以发挥特定的调控功能。例如在Sxl的可变剪接调控中,m6A 位点在被剪切的外显子附近集中分布[18],说明m6A的位置与其调控功能相关,但决定m6A分布的机制及其分布改变对功能的影响尚有待明确。另一方面,对m6A调控酶的互作网络的构建仍有待完善,虽然Xio[39]、Zc3h13[49]、METTL16[50]等新的m6A调控酶相继被发现,但依然存在很多未知的与m6A动态调控有关的酶。例如在果蝇中,m6A 能够被双向调控,但并未发现果蝇的m6A去甲基化酶。这些酶如何参与m6A的调控过程,相互之间存在何种互作关系,对它们的功能产生什么样的影响等问题尚有待明确。
m6A 能够对个体的多种生命活动产生影响,但针对昆虫的相关研究仅对m6A 影响果蝇性别分化和神经发育的机制进行了较为系统的阐述,m6A 在其他物种中的典型功能,如调控小鼠干细胞分化[46]和斑马鱼胚胎细胞凋亡[25]等,很可能在昆虫中同样存在。昆虫具有与其他物种不同的变态发育方式,m6A 是否参与了这些发育过程的调控、不同物种之间的调控通路是否存在差异等都尚待研究。此外,m6A 还具有调控病害与宿主互作的功能[51],如在家蚕中能够影响杆状病毒蛋白的表达[37],但m6A 在其中发挥的具体作用和调控机制有待进一步阐明。从m6A的功能入手展开更系统和深入的研究,将有助于通过改造m6A 修饰水平或时空分布来培育具有更好的经济性状或环境适应和病害抵抗能力的经济昆虫品种,也有助于开发能够造成害虫m6A调控紊乱的特异性药物,从而为经济昆虫繁育和害虫生物防治提供新的思路,为相关产业的生产创造更大的经济效益。
总之,随着研究技术的发展,对m6A 功能和调控机制的研究已具有了丰富的知识积累,但在昆虫方面的研究仍有很多空白,完善昆虫m6A相关蛋白的互作网络,开发新的研究技术以及拓展对m6A生物学功能和作用机制的了解依然任重道远。
