内质网应激肝癌细胞通过外泌体-Toll样受体4信号途径促进巨噬细胞M2极化
2021-07-09朱嫚嫚范璐璐孙国平刘加涛
化 维,朱嫚嫚,范璐璐,孙国平,刘加涛
(安徽医科大学第一附属医院 1.药剂科、2.肿瘤科,安徽 合肥 230022)
肝细胞癌(hepatocellular carcinoma,HCC)是全球第六常见的恶性肿瘤,占癌症相关死因的第四位。更为棘手的是,在过去的几十年中,肝癌的治疗一直没有突破。肝脏被认为是人体独特的免疫器官。肝脏微环境的慢性炎症以及由病毒感染和代谢紊乱引起的免疫细胞功能异常对肝癌的发展具有重要影响[1]。从理论上讲,免疫疗法可能为肝癌的治疗带来新的突破。但是,目前的免疫疗法在肝癌的治疗中尚未取得令人满意的突破。因此,迫切需要一种有效的肝癌治疗方法。
恶性肿瘤细胞内外的应激压力如异常增殖、缺血、缺氧等均可能导致大量错误折叠或未折叠的蛋白质积聚在内质网腔中,引起内质网应激(endoplasmic reticulum stress,ERS)[2]。研究表明,ERS相关基因或蛋白在多种实体瘤中异常激活,而ERS的持续激活与诸如肝癌等多种肿瘤的发生、转移、耐药和免疫逃逸密切相关[3]。最近,我们发现内质网激活的肝癌组织可以募集大量高表达免疫抑制分子的巨噬细胞[4]。巨噬细胞可分为具有抗肿瘤活性的经典活化M1型和具有促肿瘤作用的替代活化M2型。有报道称,内质网应激增加了肝细胞癌中GP73的分泌,GP73参与TAM表型有关的细胞因子和趋化因子的释放[5]。这些结果表明,ERS可能与HCC微环境中巨噬细胞的募集以及M2转化有关,但其潜在机制仍不清楚。
外泌体是直径为30-150 nm的细胞外囊泡,几乎所有细胞都可分泌。研究表明,肿瘤细胞可通过外泌体促使微环境中其他细胞“感知”肿瘤信号,促进免疫和炎性细胞的表型和功能的变化,从而有利于肿瘤免疫逃逸[6]。热休克蛋白(heat shock protein,HSP)是细胞在热应激、饥饿和缺氧等压力下合成的一组高度保守的蛋白。HSP70是热休克蛋白家族的重要成员,也是外泌体的表面标志之一。最近的研究表明,外源性HSP70可以与抗原呈递细胞上的Toll样受体4结合,并起免疫调节作用[7]。TLR4是能够与4种Toll样-白介素受体结构域结合的先天免疫受体,可启动下游信号级联,调控细胞因子和趋化因子的释放,是先天免疫和适应性免疫的重要介质。研究表明,TLR4参与肿瘤的发生发展、转移侵袭和化疗耐药等过程,如TLR4可刺激结肠癌中IL-6和一氧化氮的产生,促进肿瘤的发展[8]。文献报道[9],激活树突状细胞(DC)TLR4/NF-KB途径,可以促进DC细胞的成熟和迁移。Karina等[10]发现宫颈癌细胞的培养上清液可促进M1型巨噬细胞向M2型转化,并且上调巨噬细胞中Toll 样受体的表达,但宫颈癌细胞上清液促进巨噬细胞极化和TLR4上调的具体机制尚不清楚。因此,我们推测内质网应激肝癌细胞分泌的外泌体可能通过上调巨噬细胞表面TLR4受体,进而促进巨噬细胞的表型转化。
1 材料
1.1 细胞培养肝癌细胞HepG2、Hep3B和小鼠巨噬细胞RAW264.7均购于中国科学院上海细胞库,以含10%胎牛血清(以色列BI公司)和1%的青霉素-链霉素(上海碧云天有限公司)的DMEM培养基(以色列BI公司)在5% CO2、37 ℃恒温培养箱中培养。肝癌细胞隔天更换培养基,直至细胞融合到80%-90%左右用胰酶(上海碧云天有限公司)消化传代,RAW264.7细胞每天更换培养基,吹打传代。
1.2 主要试剂及仪器衣霉素购于美国Sigma公司(货号:T7765);外泌体提取试剂盒(ExoQuick-TCTM)和无外泌体血清购自于美国SBI公司(货号:EXOTC50A-1、EXO-FBS-250A-1);兔抗GRP78抗体购自南京Bioworld有限公司(货号:AA53131);兔抗CD63、兔抗TSG101、兔抗Arg-1和兔抗TGF-β1购自于英国Abcam公司(货号:ab217345、ab125011、ab60176、ab92486);兔抗Calnexin、兔抗HSP70、鼠抗β-actin、鼠抗GAPDH购自于美国Cell Signaling Technology公司(货号:#2679、#4873、#3700、#5174,);DAPI染核液购自于美国Sigma公司;小鼠炎症因子CBA试剂盒购自于美国BD Biosciences公司(货号:5008944);抗鼠FITC-F4/80、抗鼠PE-CD206和抗鼠TLR4购自于美国BioLegend公司(货号:#123115、Clone C068C2、#145403);PKH67 荧光细胞膜标记试剂盒购自于美国Sigma公司(货号:SLBM4309V);Image Quant LAS 4000发光成像系统购自美国GE公司;FC500流式细胞仪购自美国Beckman coulter公司;M450酶标仪购自美国BioRad公司;荧光显微镜购自日本Olympus公司;激光共聚焦显微镜购自德国徕卡公司。
2 方法
2.1 蛋白印迹实验取对数生长期的人肝癌细胞系或RAW264.7细胞,接种到六孔板中,培养贴壁12h以后,根据各试验目的分别处理。收集各处理组的细胞,PBS清洗3遍,加入适量含1% PMSF(蛋白酶抑制剂)的蛋白裂解液冰上裂解30 min,以12 000 r·min-1离心10 min,取蛋白上清,加入5× Loading buffer混匀,沸水中煮10-15 min,再用BCA试剂盒进行蛋白定量。向聚丙烯酸凝胶中加入20-30 μg每孔的样品,经过电泳、转膜等步骤将蛋白转至PVDF膜上,5%牛奶室温封闭2 h,洗膜后分别与相应的一抗(如β-actin抗体、GRP78抗体、HSP70抗体、CD63抗体、Arg-1抗体、TGF-β1抗体、TSG101抗体和Calnexin抗体,稀释比例均为1 ∶1 000)孵育过夜。TBST洗膜3遍,二抗室温敷育1 h后TBST洗膜3次,Image Quant LAS 4000发光成像系统显影。
2.2 外泌体的提取分别收集TM诱导内质网应激前后HepG2细胞和Hep3B细胞的培养上清,3 000 r·min-1离心15 min去除细胞碎片。使用外泌体提取试剂盒(ExoQuick-TCTM)分离正常培养肝癌细胞上清中的外泌体(Exo-con)和内质网应激肝癌细胞培养上清中的外泌体(Exo-TM),并通过透射电镜和蛋白印迹试验対收集的外泌体进行鉴定。
2.3 电镜将纯化的外泌体从冰箱中取出并在冰上自然融化,取10 μL纯化的Exo-con和Exo-TM添加到铜网中,室温静置3 min,然后以2%磷钨酸复染3 min。最后,用PBS清洗铜网,并在室温下自然晾干,使用透射电子显微镜观察外泌体的形态。
2.4 免疫组化实验所有肝癌和正常肝组织均经福尔马林固定,石蜡包埋和去石蜡。经阻断内源性过氧化物酶活性和抗原修复等操作之后,将切片与GRP78一抗孵育过夜。湿盒中取出切片,洗涤,与二抗共孵育。最后,用二氨基联苯胺染色,并使用苏木精复染,显微镜下观察。通过将染色强度乘以染色细胞的百分比对GRP78的表达水平进行评分[4]。
2.5 免疫荧光检测用PKH67标记肝癌细胞分泌的外泌体,加入RAW264.7培养皿中共培养12 h后,用0.5% Triton-100破膜10 min,用预冷的PBS清洗3遍,4%多聚甲醛固定30 min,再次清洗3遍后,DAPI染核5 min,PBS清洗两遍,激光共聚焦显微镜观察。
2.6 流式细胞术将RAW264.7细胞与Exo-con和Exo-TM(10 mg·L-1)共同孵育24 h,然后收集细胞并用预冷的PBS洗涤,离心并重悬,并加入适量Biolegend公司的抗鼠FITC-F4/80、抗鼠PE-CD206或抗鼠PE-TLR4(货号:123107、117605、141705)。孵育45 min后,以含有1% BSA的预冷PBS洗涤2次,重悬后流式细胞仪检测,使用FlowJo10.5.4软件(Tree Star,Inc.)进行分析。
2.7 细胞因子检测使用“2.6”步所得的细胞上清液与CBA试剂盒室温共同孵育4 h,经流式细胞仪检测Exo-con和Exo-TM对RAW264.7细胞IL-6和IL-10表达水平的影响。
2.8 Affymetrix基因芯片筛选差异表达的mRNA和生物信息学分析通过Affymetrix基因芯片对Exo-con和Exo-TM处理后巨噬细胞免疫调节相关基因的表达谱进行分析。过程简述如下:使用TRIzol提取Exo-con和Exo-TM处理后巨噬细胞的总RNA,使用T7 Oligo(dT)引物与第一链酶混合,合成cDNA第一链。然后,利用第二链酶混合物合成cDNA第二链和双链cDNA,并使用有机溶剂提纯双链cDNA,再使用T7酶混合液并加入生物素体外合成cDNA。最后,对合成的RNA进行纯化、定量和片段化,并将片段化的cRNA与Affymetrix芯片杂交。利用KEGG Orthology Based Annotation系统对不同mRNAs的Gene Ontology(GO)生物学过程特征和Kyoto Encyclopedia of Genes and Genomes(KEGG)信号通路进行分析。
2.9 统计学处理采用SPSS 22.0 统计软件处理,数据采用均数±标准差表示,两组间的比较采用配对t检验,两组以上数据比较采用单因素方差分析。
3 结果
3.1 衣霉素诱导肝癌细胞内质网应激首先使用内质网应激诱导剂衣霉素(tunicamycin,TM)构建肝癌细胞内质网应激模型。Western blot分析表明,TM可剂量(0、1.25、2.5和5.0 μmol·L-1)依赖性增加ERS标志蛋白GRP78的表达(Fig 1A,1B)。然而,相比于2.5 μmol·L-1组,5.0 μmol·L-1浓度的TM并没有显著提高GRP78蛋白的表达水平(Fig 1A,1B)。随后,我们使用2.5 μmol·L-1的TM刺激HepG2细胞不同时间(0、12、24和48 h),发现GRP78的表达与TM刺激时间呈正相关,差异有统计学意义(P<0.01),但24与48 h组无差异(Fig 1C,1D)。上述结果表明,2.5 μmol·L-1衣霉素作用24 h可以在HCC细胞中建立合适的ERS模型。此外,Western blot检测4对肝癌组织和相应的非癌性肝组织标本GRP78的蛋白水平,发现肿瘤组织表达的GRP78蛋白水平更高(Fig 1E),免疫组织化学染色进一步证实上述结果(Fig 1F)。
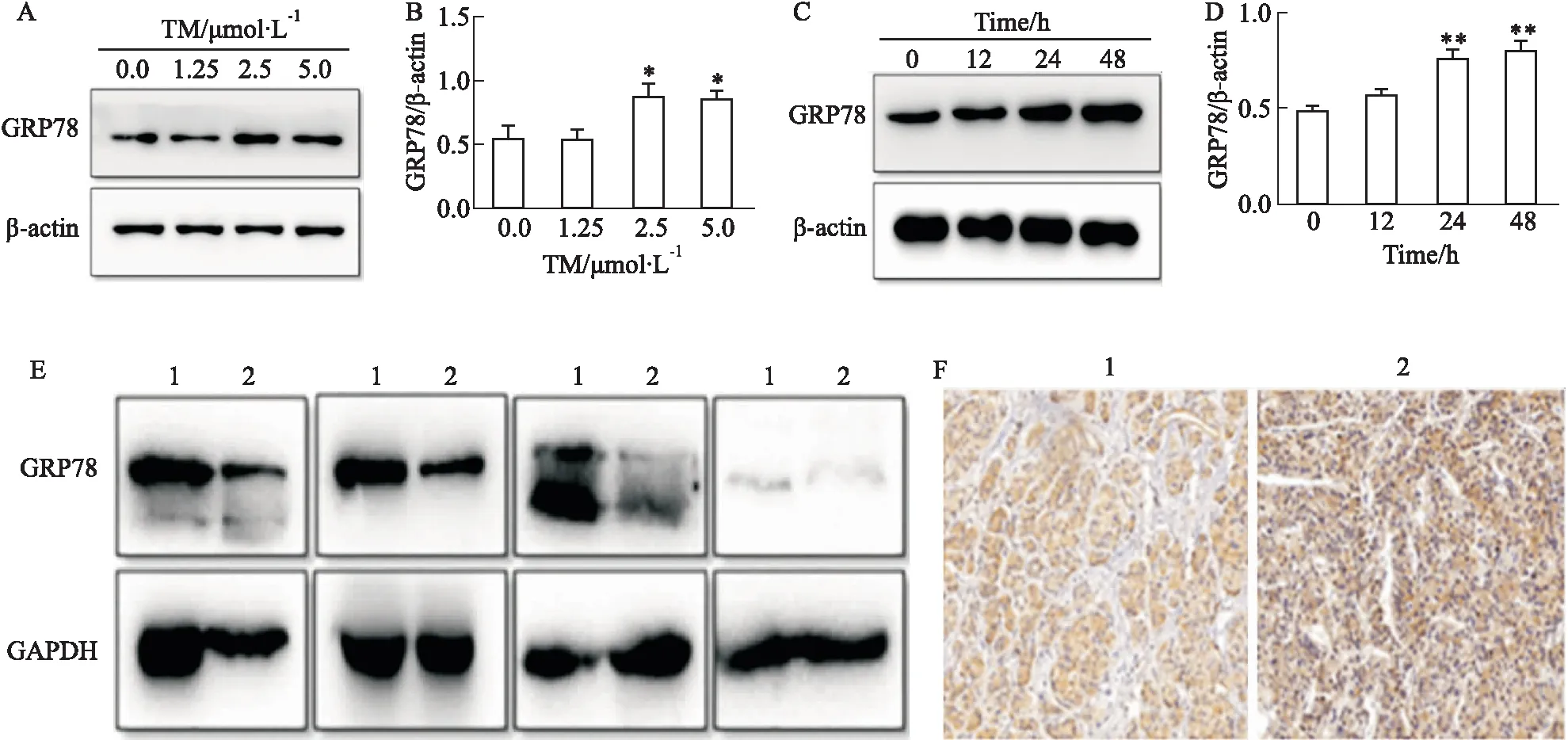
Fig 1 ER stress in liver cancer cells activated by tunicamycin

Fig 2 Exosomes efficiently incorporated by macrophages
3.2 巨噬细胞可有效地摄取肝癌细胞释放的外泌体透射电子显微镜(TEM)显示分离到的沉淀物呈圆形或类圆形的双层囊泡结构,符合典型的外泌体形态学特征,并且Exo-TM组(Fig 2A)中囊泡的直径较Exo-con组(Fig 2B)更大。Western blot实验进一步证实,这些圆形囊泡表达跨膜蛋白CD63、TSG101和热休克蛋白70(HSP70)外泌体标志蛋白,且不表达内质网蛋白Calnexin,表明提取的囊泡是外泌体(Fig 2C)。值得注意的是,与Exo-con相比,内质网应激肝癌细胞分泌的外泌体携带更多的HSP70(Fig 2C)。此外,我们使用PKH67标记外泌体,并将这些PKH67标记的外泌体与RAW264.7细胞共培养12 h,激光共聚焦显微镜观察RAW264.7可以有效地摄取PKH67标记的外泌体(Fig 2D,2E)。
3.3 Exo-TM促进巨噬细胞转化为M2表型为了探索ERS的HCC细胞能否通过传递外泌体影响巨噬细胞极化。FCM发现,与Exo-con相比,HepG2分泌的Exo-TM与RAW264.7细胞共培养24 h可以显著地增加CD206的表达(Fig 3A),差异有统计学意义(P<0.05)。Hep3B细胞来源的Exo-TM作用RAW264.7细胞也得到相似的结果(Fig 3B)。通过Western blot分析还发现,与Exo-con处理的RAW264.7细胞相比,Exo-TM处理的巨噬细胞Arg-1(P<0.05)和TGF-β1(P<0.01)蛋白水平明显上调(Fig 3C)。此外,内质网应激HepG2和Hep3B释放的外泌体不仅可显著升高RAW264.7细胞的IL-6的表达水平,而且还可以提高IL-10表达(Fig 3D,3E)。上述证据表明,内质网应激的肝癌细胞可通过分泌外泌体促进巨噬细胞向M2表型转化,进而促进肿瘤进展。
3.4 Exo-TM上调巨噬细胞中TLR4的表达为进一步探讨Exo-TM促进巨噬细胞M2极化的具体机制,我们分别使用Exo-con和Exo-TM与巨噬细胞共培养24 h。通过Affymetrix基因芯片检测,我们发现与Exo-con组相比,Exo-TM作用后巨噬细胞中分别有129个基因表达上调和123个基因下调(Fig 4A)。生物信息学分析发现,这些差异基因与TLR级联反应关系最为密切,如TLR6-TLR2级联反应、TLR1-TLR2级联反应、MYD88和TLR4信号通路等(Fig 4B)。虽然多数研究认为,TLR4通路活化可促进巨噬细胞M1转化,但近年来已在多个肿瘤中发现TLR4活化也可促进巨噬细胞向M2b表型转化[11]。因此,我们通过流式细胞术检测Exo-TM介导的RAW264.7细胞M2极化是否也伴随着TLR4信号途径的激活。我们将HepG2细胞或Hep3B细胞中富含HSP70的外泌体与RAW264.7细胞共培养24 h,发现Exo-con和Exo-TM都可以明显上调巨噬细胞上TLR4的表达,并且在HepG2细胞内Exo-TM使TLR4表达增加的程度比Exo-con组更为显著,差异有统计学意义(P<0.01),见Fig 4C和4D。上述证据表明,内质网应激的肝癌细胞可能通过释放外泌体促进巨噬细胞向M2型极化,但具体机制仍需进一步研究。
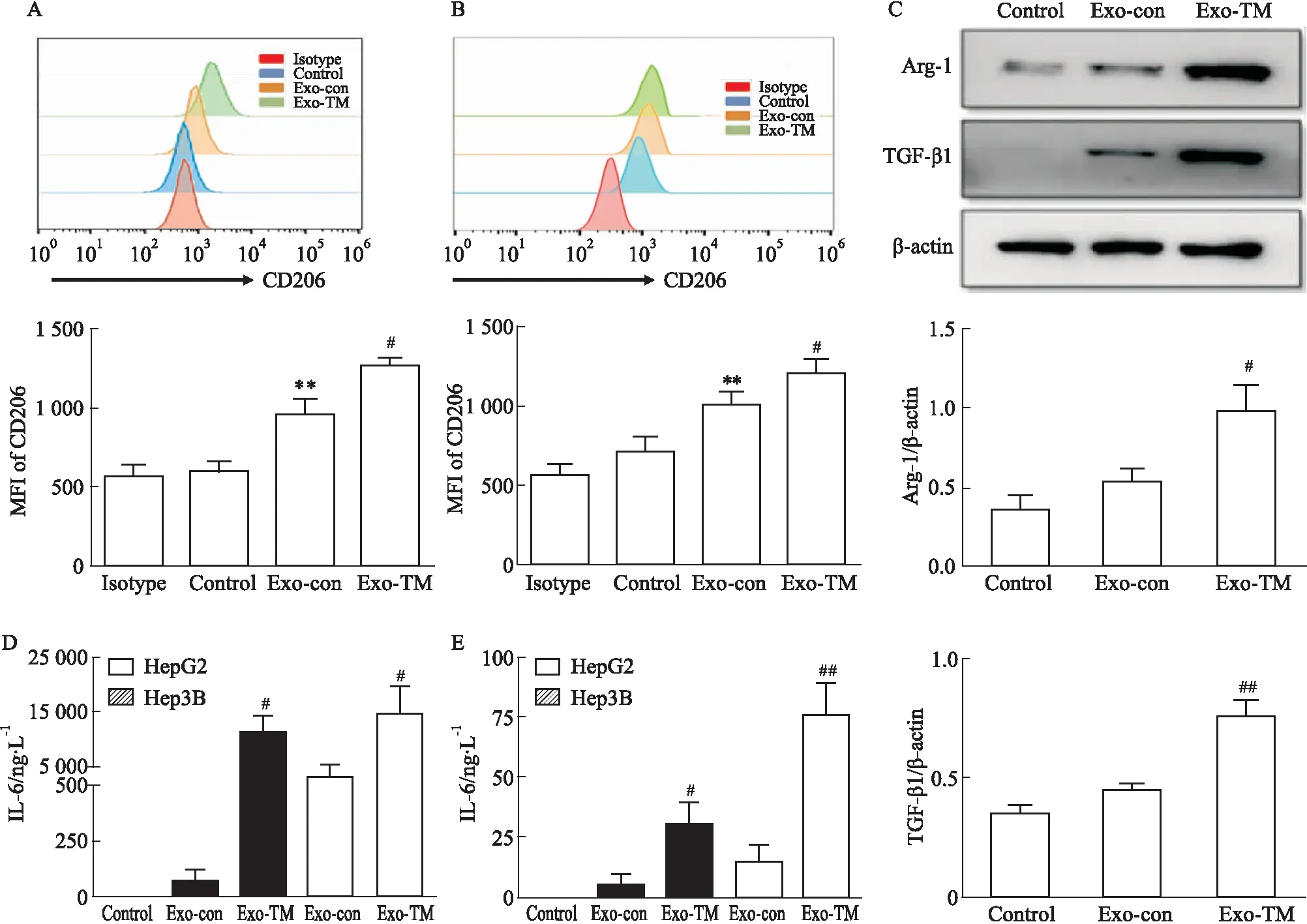
Fig 3 Macrophages transformed to M2 phenotype promoted by Exo-TM
4 讨论
内质网应激在多种肿瘤中激活,并与基因组不稳定性、血管生成和细胞化学抵抗等多种恶性生物学行为有关。内质网应激的树突状细胞上调促炎因子和免疫抑制酶的产生,并抑制其将抗原交叉呈递给CD8+T细胞的能力[12],且内质网应激的乳腺癌细胞培养基可促进巨噬细胞向促肿瘤表型转化[13]。因此,靶向ERS有望成为肿瘤免疫治疗的新策略。本研究中我们发现,内质网应激的HCC细胞释放的外泌体可促进巨噬细胞向M2表型转化(Fig 3)。此外,我们还发现内质网应激的HCC细胞可以释放出更多的富含HSP70的外泌体,蛋白质谱分析也发现相似的结果(未发表)。HSP70被认为是哺乳动物细胞中最重要的HSPs,也是研究最深入的HSPs家族,在协同免疫中起着重要的作用。一些研究者在黑色素瘤小鼠模型使用结核分枝杆菌衍生的细胞外DnaK(哺乳动物Hsp70的细菌直系同源物),发现它可以通过IL-10/IL-10R信号通路促进小鼠巨噬细胞的极化[14],表明内质网应激相关外泌体中携带的HSP70可能与巨噬细胞极化密切相关。
TLR4的表达与肝癌的预后不良和患者的整体生存有关。有研究报道,肿瘤微环境可以通过TLR4依赖性的方式诱导巨噬细胞向M2型转化,TLR4可能是巨噬细胞中内质网应激的一种传感器[15]。因此,推测ERS相关的外泌体通过激活巨噬细胞TLR4途径促进巨噬细胞极化。本研究中我们发现,巨噬细胞可有效地摄取外泌体,并明显增加巨噬细胞上TLR4的表达,促进巨噬细胞向M2型转化(Fig 3、4)。紫杉醇可通过TLR4依赖性途径将M2型肿瘤相关巨噬细胞重新编程为M1型,调节肿瘤相关巨噬细胞的分布。我们的研究表明,肝癌细胞来源的外泌体可上调巨噬细胞表面TLR4水平并促进巨噬细胞向M2极化,这与Toll 样受体的激活可以促进结肠癌移植瘤小鼠巨噬细胞M1转化以及抑制肿瘤等文献报道结果相反,表明TLR4在不同环境下可能发挥不同的作用[16]。正因为TLR4受体的双重免疫调控作用,越来越多的制药公司正在开发TLR4拮抗剂如类似于脂多糖结构的厄里特兰[17],其通过抑制Toll样受体活性,调控炎症反应和免疫效应。此外,vega等[18]发现,与重组HSP70相比,外泌体中HSP70在激活巨噬细胞的过程中表现出强而特异性的特征,这与我们在实验中发现的结果相似,见Fig 3。然而ERS相关外泌体被巨噬细胞摄取后,能否提供其携带的HSP70,上调巨噬细胞表面TLR4受体,促进巨噬细胞M2极化,还需要进一步探讨。

Fig 4 TLR4 expression in macrophages up-regulated by Exo-TM
综上所述,本研究结果表明,内质网应激肝癌细胞分泌的外泌体富含HSP70,这些外泌体可能通过激活巨噬细胞中的TLR4途径来增强炎症因子的分泌并促进巨噬细胞向M2型的转化,但具体机制仍需要进一步研究。我们的结果丰富了内质网应激促进肝癌细胞免疫逃逸的认识,并为通过靶向内质网应激、外泌体和巨噬细胞治疗肝细胞癌提供了实验依据。
