灯盏花素促进缺血/再灌注损伤的微血管内皮细胞自噬、抑制氧化损伤及凋亡
2021-07-09王娓娓鲍天昊
王娓娓,叶 宏,孙 林,鲍天昊,3
(1.昆明医科大学第二附属医院心内科,云南 昆明 650101;2.昆明医科大学病理教研室,云南 昆明 650101;3.云南省精神病医院老年科,云南 昆明 650101)
心肌梗死后快速恢复梗死区域供血、供氧会进一步诱发心血管损伤,这种恢复血液供应而导致的组织损伤加重现象称心肌缺血/再灌注损伤(myocardial ischemia-reperfusion injury,MIR)[1]。在缺血/再灌注(ischemia/reperfusion injury,I/R)损伤过程中,内皮细胞比心肌细胞更容易发生损伤,内皮损伤引发炎性细胞浸润,微血栓形成等级联效应,加速心肌细胞的I/R损伤,最终导致心肌坏死,功能失调[2-3]。
灯盏花素又名野黄芩苷(scutellarin,Scu)可以促进神经营养因子的合成和释放从而缓解缺氧/复氧对星形胶质细胞的损害[4]。灯盏花素通过抑制小胶质细胞的过度激活,减少活性氧(reactive oxygen species,ROS)的产生,抑制核易位和DNA 结合核因子κB(nuclear factor κB,NF-κB)活性,对脑损伤具有治疗作用[5]。研究者的既往研究表明,灯盏花素能够减小I/R损伤小鼠心肌梗死面积,增加心脏射血分数,降低血清心肌酶肌钙蛋白I水平,抑制心肌细胞和脑细胞凋亡,抑制炎症因子损伤,增加细胞活力。在此基础上我们进一步研究灯盏花素对I/R损伤内皮细胞的保护作用。
1 材料与方法
1.1 材料人微血管内皮细胞(microvascular endothelium cell,MEC)购于上海康朗生物科技有限公司。内皮细胞培养基(endothelial cell culture medium,ECM),胎牛血清(fetal bovine serum,FBS),L-谷氨酰胺的衍生物(L-glutamine derivative,Glut MAX),β-巯基乙醇(β-mercaptoethanol),0.05% 胰酶-乙二胺四乙酸(pancreatin-ethylenediaminetetraacetic acid,trypsin-EDTA),二甲基亚砜(dimethyl sulfoxide,DMSO)均购买于Gibco公司。噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT),表皮细胞生长因子(epidermal growth factor,EGF),碱性纤维生长因子(basic fibroblast growth factor,bFGF)购买于Millipore公司。聚合酶链反应(polymerase chain reaction,PCR)逆转录试剂盒为天根生物公司产品。KG-501、超氧化物歧化酶(superoxide dismutase,SOD,货号19160)、丙二醛(malondialdehyd,MDA,货号MAK085),乳酸脱氢酶(lactate dehydrogenase,LDH,货号MAK066),购自Sigma公司。脂多糖(lipopolysaccharide,LPS)为碧云天生物公司产品。SYBR Green Master 购买于ABI公司。灯盏花素为北京原叶生物科技有限公司(HPLC≥95%)产品。环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB,货号9197)及Toll样受体4(Toll-like receptor-4,TLR4,货号14358)购于Cell Signaling 公司。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3,货号ab192890)购买于Abcam生物公司。辣根过氧化物酶(horseradish peroxidase,HRP,货号CW0103)购买于北京康为试剂公司。LC3,半胱天冬蛋白酶3(caspase-3),细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1),血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)及GAPDH基因引物由Invitrogen公司合成。ICAM-1 :F:5′-GGCGTCCATTTACACCTATTA-3′; R:5′-TTCCTTTTCTTCTCTTGCTTG-3′。VCAM-1:F:5′-CGGTCATGGTCAAGTGTTTG-3′; R:5′-GAG ATCCAGGGGAGATGTCA-3′。LC3:F:5′-AGCTCTG AAGGCAACAGCAACA-3′; R:5′-GCTCCATGCAGGT AGCAGGAA-3′。caspase-3:F:5′-ACCGATGTCGAT GCAGCTAA-3′; R:5′-GGTGCGGTAGAGTAAGCA TA-3′。GAPDH:F:5′-GCTTCGGCAGCACATATACTAAAAT-3′; R:5′-TTGGCTCCACCCTTCAAGTG-3′。
1.2 MEC细胞培养及缺血/再灌注损伤模型制作
1.2.1细胞培养 使用6孔板培养MEC细胞(2×105/孔),(MEC培养基成分:ECM,5% FBS,10 μg·L-1EGF,10 μg·L-1bFGF,2 mmol·L-1L-Glut MAX和0.1 mmol·L-1β-巯基乙醇),24 h后换液。实验细胞分为对照组(vehicle)、缺血/再灌注损伤组(I/R)、灯盏花素治疗组(Scu+I/R)。
1.2.2I/R模型制作 6孔板培养的细胞在缺氧状态下(条件为37 ℃,90% N2,5% O2,5% CO2的缺氧培养箱)中培养8 h,然后继续复氧(置于正常培养箱)培养16 h。正常对照组MEC细胞始终在正常细胞培养箱中培养。灯盏花素治疗组于缺血/再灌注开始前6 h将灯盏花素加入6孔板。
1.2.3KG-501及LPS配置 将KG-501 配制成储存液(20 mmol·L-1)4 ℃储存。将终浓度20 μmol·L-1的KG-501加入到MEC培养基。培养24 h后进行模型制作(灯盏花素治疗模型及I/R模型)。
将LPS 配制成储存液(1 mg·L-1)4 ℃储存。使用时将其稀释,终浓度100 μg·L-1。LPS加入培养基作用24 h后进行灯盏花素治疗及I/R模型制作。
1.2.4MTT测定 使用96孔板培养MEC细胞(0.1×105细胞/孔),体外培养56 h,加入5 g·L-1的MTT在37 ℃作用4 h,去除培养基,加入DMSO 150 μL/孔,室温下摇床上孵育15 min,使用酶标仪(Turner BioSystems公司)450 nm测定吸光度。细胞活力/%=(吸光度/溶剂空白对照组吸光度)×100%。灯盏花素处理浓度为0、10、30、50、100 μmol·L-1。
1.2.5LDH活性测定 按照LDH测试盒说明书对MEC细胞培养液中LDH活性进行检测。微孔法测量,设置标准孔(ODs)、空白孔(ODb)和测定孔(ODu)、对照孔(ODc),使用酶标仪在450 mn测吸光度值,计算LDH值。
1.3 生化法测定MDA、SOD的表达PBS清洗MEC细胞后先加PBS(0.1 mol·L-1)和EDTA(0.05 mmol·L-1,pH 8.0),再加入1%的Triton-X 100 50 μL,孵育1 min,加入25%的H3PO4100 μL,4 ℃离心1 h,取上清液,按说明书测定SOD及MDA水平。
1.4 RT-PCR测定使用TRIzol裂解液提取总内皮细胞RNA。根据试剂盒的操作步骤进行逆转录(RNA逆转为cDNA)。依RT-PCR试剂盒指南进行cDNA扩增。
1.5 Western blot 分析细胞加入RIPA裂解液提取总蛋白经电泳、转膜、封闭后加入一抗置于4 ℃冰箱孵育12 h,然后经HRP二抗(兔抗,使用浓度1 ∶2 000)孵育1 h。ECL显影、成像,经过使用Image J软件测定。一抗使用浓度为LC3(兔抗,使用浓度1 ∶1 500),TLR4(兔抗,使用浓度1 ∶2 000),CREB(兔抗,使用浓度1 ∶2 000)。
2 结果
2.1 灯盏花素修复I/R损伤内皮细胞的活力MTT测定发现:与对照组相比,I/R组细胞活力显著降低(P<0.01)。在细胞I/R损伤前分别加入10、30、50、100 μmol·L-1的灯盏花素均有一定程度恢复MEC细胞活力,结果表明50 μmol·L-1灯盏花素具有最好的改善细胞活力的作用,见Fig 1。结果提示:灯盏花素使I/R损伤的MEC的细胞活力得到修复,活细胞数量增多,由于50 μmol·L-1效果最好,后续实验灯盏花素剂量均使用50 μmol·L-1。

Fig 1 Changes in microvascular endothelial cell viability(n=5)
2.2 灯盏花素使I/R损伤微血管内皮细胞SOD表达增加,MDA、LDH表达减少对照组SOD水平高于I/R组(P<0.01),MDA和LDH表达低于I/R组(P<0.01)。灯盏花素治疗后,SOD表达显著增加(与I/R组比较P<0.01),同时MDA及LDH表达降低(与I/R组比较P<0.05),见Tab 1。结果提示:对于I/R损伤的微血管内皮细胞,灯盏花素具有对抗氧化损伤的保护作用。
2.3 灯盏花素使I/R损伤的微血管内皮细胞ICAM-1及VCAM-1表达减少研究发现,I/R组ICAM-1mRNA及VCAM-1mRNA明显增加(同对照组比较P<0.01)。与I/R组比较,灯盏花素治疗组ICAM-1mRNA(P<0.01)及VCAM-1mRNA(P<0.05)表达减少,见Tab 1。结果提示:对于I/R损伤的微血管内皮细胞,灯盏花素具有缓解内皮损伤的作用。
2.4 灯盏花素使I/R细胞caspase-3 mRNA表达减少研究发现I/R组caspase-3 mRNA表达增加(同对照组比较P<0.01)。与I/R组比较,灯盏花素治疗使caspase-3 mRNA表达减少,二者比较差异有统计学意义(P<0.01),见Tab 2。结果提示,灯盏花素具有对抗I/R损伤的微血管内皮细胞凋亡的作用。
2.5 灯盏花素使I/R损伤的微血管内皮细胞自噬标准蛋白LC3表达增加与对照组相比,I/R组LC3 mRNA及蛋白表达均降低(P<0.05和P<0.01)。与I/R组比较,灯盏花素治疗组LC3 mRNA及蛋白表达均增高(P<0.05),见Tab 2,Fig 2。结果提示:I/R损伤模型组细胞自噬减少,细胞修复能力受到破坏,灯盏花素促进微血管内皮细胞自噬及细胞自我修复。

Fig 2 Protein expression of LC3
Tab 1 Changes of SOD,MDA,LDH,ICAM-1 mRNA and VCAM-1mRNA in MEC

Tab 2 Changes of caspase-3,LC3,CREB and TLR4 in MEC
2.6 灯盏花素抑制I/R损伤的微血管内皮细胞TLR4表达,增加CREB表达与对照组相比,I/R组TLR4表达增加(P<0.01),CREB表达降低(P<0.01)。灯盏花素治疗使TLR4表达减少(与I/R组比较P<0.05),CREB表达增高(与I/R组比较P<0.05),见Tab 2,Fig 3。结果提示:灯盏花素可能通过CREB及TLR4通路对I/R损伤的微血管内皮细胞发挥促进自噬,抑制凋亡作用
2.7 抑制CREB表达使灯盏花素治疗的I/R微血管内皮细胞LC3表达减少,抑制自噬与Scu+I/R组相比,Scu+I/R组加入CREB抑制剂(KG-501)后CREB表达减少(P<0.05);LC3mRNA及蛋白表达减少(P<0.05),见Tab 2,Fig 2,3。结果显示:KG-501有效抑制CREB表达,CREB表达减少后使自噬减少,进一步印证灯盏花素可能通过调控CREB表达对I/R损伤的微血管内皮细胞发挥促进自噬作用。
2.8 激动TLR4表达使灯盏花素治疗的I/R微血管内皮细胞凋亡增加与Scu+I/R组比较,将TLR4激动剂(LPS)加入Scu+I/R组后,TLR4表达增加(P<0.05),caspase-3 mRNA表达增加(P<0.05),见Tab 2,Fig 3。进一步印证灯盏花素可能通过TLR4通路对I/R损伤的微血管内皮细胞发挥抑制凋亡作用。
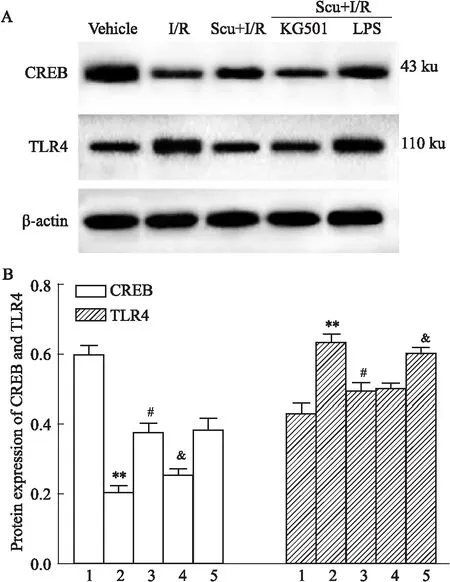
Fig 3 Protein expression of CREB and TLR4
3 讨论
通过血运重建恢复缺血或梗死区域的血液灌注是治疗心肌梗死首要方法,然而冠状动脉阻塞区域血管的再通并不意味着恢复了心脏组织的有效灌注。微血管内皮细胞是微循环系统的最基本单位,微血管内皮细胞与心肌细胞之间的最小距离约1-2 μm。内皮细胞舒缩能够调节微血管直径,进而调节周围心肌组织血流分配,通过旁分泌和自分泌方式调节心肌代谢及功能。心肌缺血/再灌注损伤的病理特点之一是微循环损伤,氧自由基在I/R诱导的微循环损伤中起主要作用,I/R会导致氧自由堆积。细胞膜及胞内DNA、蛋白质、脂肪均会受到氧自由基攻击,导致内皮细胞结构和功能受损[6-7],进一步发生细胞凋亡或坏死。
MTT通过测定活细胞的线粒体代谢水平来反映细胞活力。本研究发现I/R损伤导致MEC活力减低,灯盏花素治疗使MEC活力恢复,其中50 μmol·L-1灯盏花素剂量为最优选择。本结果说明灯盏花素修复MEC线粒体,增加活细胞数量,提高细胞活力。
SOD作为抗氧化酶具有清除氧自由基,缓解氧化损伤的作用。MDA是脂类物质发生过氧化反应产生的代谢产物,是反映组织过氧化损伤程度的客观指标。LDH主要参与无氧酵解,对细胞受损敏感,可以作为反映细胞损伤程度的指标。本研究指出I/R损伤引起MEC抗氧化能力降低,易发生过氧化反应,诱发细胞氧化损伤发生。灯盏花素使I/R损伤的MEC的SOD表达增加,MDA及LDH表达减少,提示灯盏花素能够对抗过氧化反应,缓解过氧化损伤。
I/R损伤导致白细胞向血管内皮细胞迁移,黏附于血管内皮并释放活性氧产物和蛋白酶,诱发心肌损伤。继而白细胞渗出到再灌注区域,通过炎症级联效应诱发缺血区再损伤。大量的白细胞黏附于内皮细胞造成微血管堵塞,进一步加重心肌损伤。细胞黏附糖蛋白主要包含ICAM-1和VCAM-1。ICAM-1介导中性粒细胞与内皮细胞黏附,VCAM-1与单核细胞与内皮的黏附有关。生理状态下,血管内皮细胞较少表达ICAM-1和VCAM-1。脑缺血时内皮细胞大量分泌ICAM-1和VCAM-1,诱导单核细胞及中性粒细胞迁移,渗出,导致缺血区域发生再损伤[8]。I/R产生的活性氧导致内皮细胞损伤,ICAM-1和VCAM-1分泌增多使内皮屏障功能障碍,微血管通透性增加,白细胞黏附,血管炎症及粥样斑块破碎形成血栓[9-10]。活化的中性粒细胞透过内皮细胞向心肌组织浸润,使心肌损伤加重。本研究发现灯盏花素使I/R损伤的MEC产生的ICAM-1和VCAM-1减少,有助于减轻白细胞黏附及炎性损伤,可能会避免毛细血管狭窄及血栓形成。
自噬是细胞内“自我平衡的动态循环”过程,通过吞噬、分解损伤物质为细胞提供合成新物质的原料及能源,促进细胞在“能源不足”状态下保持存活。损伤性刺激会导致自噬通路活化,形成自噬溶酶体,清除受损DNA、蛋白质、细胞器,增加细胞抵抗损伤的能力[11]。本研究发现灯盏花素使I/R损伤的MEC的自噬标准蛋白LC3表达增高。在哺乳动物中,LC3是自噬的标志性蛋白。当LC3与其配体蛋白p62结合后形成自噬体,诱发自噬级联反应。本研究发现灯盏花素能够修复损伤的线粒体,恢复线粒体功能,使细胞活力增加,同时使LC3增加,启动自噬程序,修复受损细胞对抗氧化损伤。
CREB属于DNA结合转录因子,与顺式作用元件结合,调控多种下游基因转录。研究证实,转录因子CREB通路在细胞增殖、神经元再生、突触形成及学习记忆,损伤修复等多方面起重要作用[12-13],自噬相关基因亦受CREB调控[14]。本研究亦发现I/R使MEC的CREB表达减少,灯盏花素治疗CREB得到提高。为了验证灯盏花素是否通过调节CREB表达促进MEC自噬,我们将CREB抑制剂加入灯盏花素治疗的I/R细胞发现LC3表达减少,抑制了自噬。因此本研究提出灯盏花素可能通过促进CREB表达抑制I/R损伤的微血管内皮细胞自噬。
caspase-3处于凋亡有序级联通路的下游,线粒体途径和死亡受体途径均激活caspase-3。caspase-3激活标志着凋亡不可逆转。我们研究结果发现灯盏花素治疗可以使caspase-3 mRNA表达减少,抑制I/R导致的MEC凋亡。
Toll样受体4(Toll-like receptor 4,TLR4)在心脏中表达水平最高,主要参与心肌组织损伤及凋亡[15]。敲除TLR4 基因可以减少大鼠心肌梗死面积,抑制TLRs下游分子表达具有减轻心肌I/R损伤的作用,TLR4信号通路在心肌I/R损伤中起关键调控作用[16]。研究者的既往研究表明,灯盏花素能够减小缺血/再灌注损伤小鼠心肌梗死面积,增加心脏射血分数,降低血清心肌酶肌钙蛋白I水平,抑制心脑细胞凋亡,抑制炎症因子损伤,增加细胞活力。灯盏花素可能是通过调控TLR4 基因抑制I/R损伤的心肌细胞凋亡。本研究测定了TLR4在MEC的表达变化,发现I/R损伤使TLR4表达增加,灯盏花素治疗后TLR4表达减少。为了验证灯盏花素是否通过调控TLR4表达抑制I/R损伤的MEC凋亡,研究者在灯盏花素治疗的I/R细胞中加入TLR4激动剂,发现caspase-3表达增加。因此推测灯盏花素可能是通过抑制TLR4表达发挥抗凋亡作用。
既往研究发现,灯盏花素可以增加大鼠脑微血管内皮细胞糖氧剥夺模型的组织纤溶酶原激活物和扩血管物质释放,抑制组织纤溶酶原激活剂抑制物和缩血管物质内皮素的生成,使炎症指标TNF-α、IL-1β、IL-6下降[17]。灯盏花素能够对抗原代培养的新生大鼠心肌细胞的缺氧/复氧损伤,降低LDH和MDA的 含量,增加SOD和 GSH-PX 的活性,以起到心肌保护作用[18]。本研究发现灯盏花素可以提高缺血/再灌注损伤的微血管内皮细胞活力、使氧化损伤指标LDH、MDA减少,抗氧化指标SOD增加,与既往研究具有部分一致性,但二者研究对象不同。同时,首次提出灯盏花素可以减少内皮细胞I/R损伤模型ICAM-1和VCAM-1的释放,有助于减轻白细胞黏附及炎性损伤,可能会避免毛细血管狭窄及血栓形成、减轻微血管炎性损伤。并且指出灯盏花素是通过促进CREB表达促进自噬,通过抑制TLR4表达抑制凋亡,从而发挥对内皮细胞I/R损伤模型的保护作用。
