苯达莫司汀的药理机制及药动学研究进展
2021-07-09杜超卓秋琪罗舟刘相男李伟
杜超 卓秋琪 罗舟 刘相男 李伟
苯达莫司汀是一种氮芥类抗肿瘤药物,具有烷基化和抗代谢活性双重作用。由于其安全性、耐受性和有效性,常被用于滤泡性淋巴瘤和其他低级别淋巴瘤的一线治疗[1]。该药与其他烷基化剂相比,更易使DNA键断裂,治疗作用更加持久;而且,因其苯并咪唑环结构在其化学结构框架中占据很大比例,故而也兼具嘌呤类药物的抗代谢功能[2]。苯达莫司汀在20世纪60年代出现,它既不是新药,也不是新的生物靶向性药物。然而,其对于淋巴增生性疾病的临床治疗,具有突出的治疗效果,与其他烷基化剂联合使用显示出更好的反应率和生存率[3]。目前,苯达莫司汀在国外已经得到广泛的应用,如2008年苯达莫司汀在美国被准予作为白血病的一线医治药物,它对CLL的医治效果非常突出。同时,对淋巴瘤的治疗也疗效突出,如利妥昔单抗(RTX)难治性滤泡性淋巴瘤[4]。CLL作为一种恶性疾病,多发生于老年患者,且男性发病率较高。因此,相关领域的分析师预测,该药年销售值可达在3~5亿美元[5]。虽然,国内多家医药公司已经对苯达莫司汀进行仿制与研究,但其使用与推广的程度却远远不够。相对于其他化疗药物,苯达莫司汀及其制剂产品价格更加低廉,在医药市场的竞争下更具优势。
1 结构特征
苯达莫司汀,结构式为4-{5-[双-(2-氯乙基)氨基]-1-甲基-2-苯并咪唑基}-丁酸,是水溶性双功能烷化药物,可诱导更持久的DNA双链断裂。其合成思想是20世纪60年代一位德国科学家提出,在苯丁酸氮芥基础上改造得到的,其一开始设计的思路是研制出一种兼具抗代谢和烷化剂作用的低毒性的氮芥类抗肿瘤药物。但把氮芥群移到苯并咪唑环的5位上后,治疗效果增加,并命名为IMET3393,后来被重命名为苯达莫司汀[6]。盐酸苯达莫司汀结构式如图1。

图1 盐酸苯达莫司汀结构式
苯达莫司汀有3个活性基团,分别是烷化基团、丁酸侧链和苯并咪唑环。结构中丁酸侧链的引入,使苯达莫司汀具有酸碱两性的特质;烷基化基团使其具备氮芥家族的优势特点;苯并咪唑环使其具有抗代谢作用。其独特的结构使其具有烷基化和抗代谢双重治疗作用[7]。
2 药理作用
盐酸苯达莫司汀是一种双功能烷基化剂,具有独特的药效学特性。在体外时,能够使肿瘤抑制因子p53磷酸化,导致细胞凋亡;在体内时,通过EXO1基因上调,促进DNA修复,完成碱基切除修复途径反应。并诱导有丝分裂变化,导致有丝分裂的相关检查点基因下调,最终造成多核、微核或染色质凝聚现象[8]。
其机制是通过烷基化,使DNA的单链与双链交联,干扰DNA的功能与合成,发挥抗肿瘤作用。它具有更高的响应率和更长的无病生存时间,并且与嘌呤衍生物和(或)单克隆抗体结合用于临床研究CLL苯达莫司汀在不同浓度时,治疗效果不一。例如,在高浓度时,其烷基化主导,导致DNA 交联,使DNA 修复、复制与转录受到阻碍。而等毒性浓度时,较于其他经典的烷基化剂(美法仑、环磷酰胺、卡莫司汀),会使DNA双链交联破坏的数量增多和程度加大[9,10]。作用机制见图2。
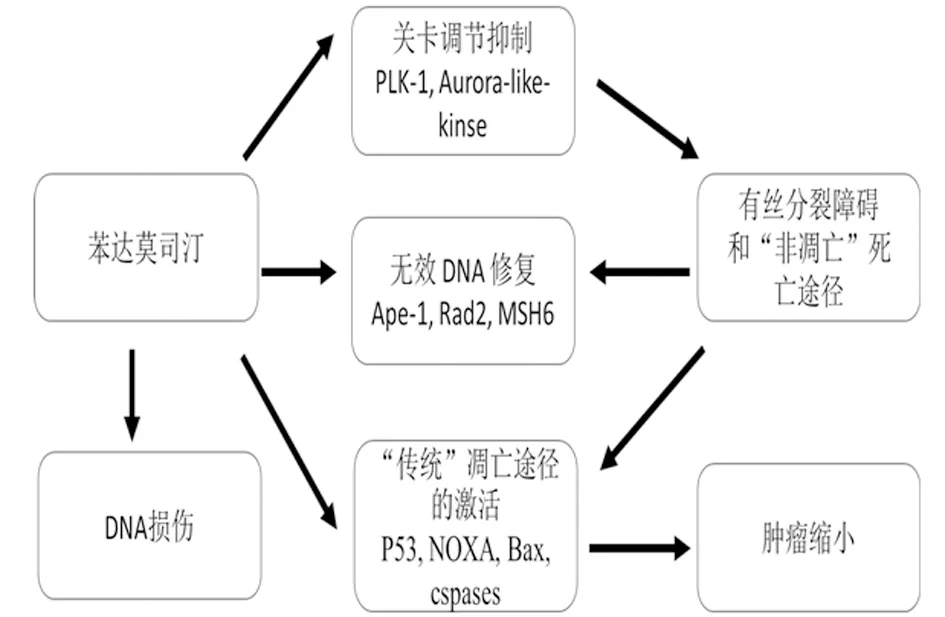
图2 苯达莫司汀作用机制
苯达莫司汀的治疗作用机制目前尚不明确,但对多种途径分裂细胞具有活性。与其他烷化剂相比,其可通过更广泛和持久的方式诱导DNA损伤,链间和链内断裂。通过共济失调性毛细血管扩张突变(ATM)依赖性方式,激活DNA损伤检查点,从而诱导细胞凋亡。苯达莫司汀还可以触发几种不同的凋亡途径,如以p53独立的方式诱导有丝分裂来触发细胞死亡。其中,内在凋亡的活化和其他细胞死亡途径都与其有关。这也导致了,苯达莫司汀在大量的B细胞和T细胞淋巴瘤细胞系中表现出高细胞毒性活性[11-13]。
在使用重组人转录激活因子3(STAT3)的生化分析中,STAT3-Src同源物2(SH2)与磷酸化酪氨酸(pTyr,Py)的结合会被苯达莫司汀抑制,但不被非活性代谢物二羟基苯达莫司汀(HP2)所抑制;而在重组人STAT3中引入C550A或C712A单点突变后,其对苯达莫司汀的敏感性显著降低,提示这些半胱氨酸残基对苯达莫司汀抑制STAT3有重要作用[14]。因此,苯达莫司汀的抗癌机制,可能与其对STAT3的SH2结构域的抑制作用有关。
此外,其作为烷基化剂,其诱导DNA断裂数量,是环磷酰胺和卡莫司汀等药物无法比及的,良好的耐受性,使治疗过程更加顺利。有证据表明,苯达莫司汀诱导的DNA相较其他烷基化剂诱导的DNA更难修复,修复也较慢,这种大范围的破坏导致DNA修复机制功能下降[15,16]。其抑制了修复点的控制,并且所产生的细胞周期变化会导致有丝分裂和细胞凋亡的溃败。同时,苯达莫司汀可以激活阻断DNA修复途径的程序,而不是像其他烷基化剂一样改变DNA修复机制,这也是其他烷化剂不易治疗CLL患者的主要原因。
3 药效学
体外药效学研究表明,苯达莫司汀对多种癌症(如:乳腺癌,卵巢癌等),具有明显的细胞毒活性。而且,苯达莫司汀可耐受其他烷基化剂,包括环磷酰胺,美法仑和卡莫司汀。体内药效学研究表明,苯达莫司汀给药浓度在25 mg/kg,37.5 mg/kg和50 mg/kg (在d1、d2静脉内分别给药一次) 能延迟人乳腺癌异种移植物中的肿瘤MDA-MB231的生长或抑制其生长,并对人肺癌异种移植物LX-1呈现出不同水平的抑制功能[17-19]。
文献查阅可知,其在临床上单用,对HL和NHL的缓解率为61%~97%,而联合用药则为41%~48%[20]。在治疗其他肿瘤患者时(如:MM),苯达莫司汀/泼尼松治疗的完全缓解率(CRR)会更高,且在体内的作用时间比美法仑/泼尼松更长。
在治疗肿瘤的设计方案中,用苯达莫司汀取代原方案中的组合药物,治疗效果突出。如,NHL治疗方法(环磷酰胺+长春新碱+泼尼松)中,其取代环磷酰胺,与低毒性NHL的发生率很接近。同时,医治转移性乳腺癌方案(环磷酰胺+甲氨蝶呤+氟尿嘧啶)中,其替代环磷酰胺后,患者缓解期增至15.2个月,相比原方案仅有6个月,苯达莫司汀的效果显得尤为突出[21]。
4 药动学
苯达莫司汀通过多种途径代谢,具有短的有效的t1/2(约40 min),最大血浆浓度(Cmax)一般在输液结束时(约1 h)达到,并且在12 h至最大浓度(平均1∶25 000)的低浓度比。如果连续2 d的标准给药计划,则预计不会出现剂量累积[22]。
体外研究数据表明,CLL细胞的半数致死剂量是4.3~7.4 μg/ml。其还暗示,延长CLL细胞与苯达莫司汀接触时间不如较高的血药浓度更有效,且接触苯达莫司汀的肿瘤细胞足以启动凋亡程序。临床试验表明,以120 mg·m-2·d-1,60 min完成静脉滴注,静脉给药后的中心分布容积为11.8~27.5 L,给药剂量的95%与血浆蛋白交联,符合人体中血药浓度遵循三相模型[23,24]。
在给予苯达莫司汀的小鼠中,组织水平肝脏和肾脏中的放射性水平明显高于其他组织。在成人中,两项研究估计苯达莫司汀的稳态分布容积为25 L和20 L,这与小鼠的放射性发现一致,表明该药物主要局限于细胞外液,而不是广泛分布于组织。这种分布模式也与苯达莫司汀在异种移植模型中抑制淋巴瘤肿瘤生长的有效性一致[25]。
苯达莫司汀在人血红细胞中自由分布。血浆蛋白质浓度低,年龄超过70岁和恶性肿瘤均不影响苯达莫司汀和蛋白质交联的行为。国外、台湾的临床试验数据表明,120 mg·m-2·d-1时,中国台湾人的PK参数(Cmax,AUC0-∞)低于日本和北美人群[23,25]。但临床试验结果表明,中国台湾人最终ORR(总缓解率)、PFS(无进展生存期)水平较低于日本人[26-28]。究其原因,Cmax差异可能性较大。
5 不良反应
苯达莫司汀在治疗肿瘤和白血病(如:CLL,NHL)表现出较好的效果以及价格符合患者预期。但是,其细胞毒的属性对人体健康影响较大,安全性仍一个需要特别考虑的问题。并且,该药物通常建议用于患有某些合并症的老年患者,所以,其不良反应的监控显得尤为重要。
苯达莫汀常见的不良反应很多,血液学不良反应发生率甚至高达40%左右[29]。据报告,有93例大于3级的不良事件,其中53例是血液学的。这与其他报告确定血液毒性是与苯达莫司汀治疗相关的主要不良反应是一致的。其常见的ADR分为血液系统毒性和非血液系统毒性。如:血红蛋白减少,白细胞、中性粒细胞降低,血小板较低等症侯均是由于血液系统毒性导致;而呕吐、感染、头痛等症状则是非血液系统毒性造成的。同时,苯达莫司汀的血药水平与呕吐有关,其他不良反应与血药水平之间的关系,还需进一步探究[30,31]。
其他不良反应(原因不明的发烧,呼吸道感染,肾功能不全,腹泻,皮肤病变和肿瘤溶解综合征)很少见,发生于<10%的患者中。例如,皮肤反应,可以从氮芥苯达莫司汀的特性中预料到。但是,皮肤反应的复杂病因,苯达莫司汀与其他化合物的使用,患者共病和疾病状况是评估这些病例的混杂因素[32]。因此,在应对潜在的风险的同时,应更新TLS的预防措施,包括密切监测血液化学,特别是钾和尿酸水平。
调查发现,苯达莫司汀单用或者联合使用,其不良反应的表现各异[33]。例如,苯达莫司汀单用常引起血小板和白细胞降低。而且,在一项中国台湾人群的实验数据显示,42%受试者至少经受了一项不良反应,其中有一个患者因为败血症休克而死亡;同样的,当苯达莫司汀/泼尼松合用时,发生恶心和呕吐机率为50%;而美法仑/泼尼松合用,发生几率却为25%[23]。对非霍奇金患者引起中等皮肤过敏反应发生几率为30%,明显多于环磷酰胺的14%。值得注意的是,它的3级脱发发生率仅为3.6%,明显少于环磷酰胺的48%。
同时,必须指出的是,感染并发症是在治疗期间死亡的患者的主要原因。苯达莫司汀已被证明可引起骨髓抑制,并对T细胞影响最大,可导致持续2年的感染易感性增加[34]。因此,在苯达莫司汀治疗期间必须高度重视对感染的适当预防和治疗。
总之,在禁忌使用CD20抗体的CLL患者中,至少在早期反应方面,苯达莫司汀是具有良好的风险-效益曲线和较高的客观缓解率,并且具有可接受的毒性。故必须努力确保药物给药的适当时机和适当剂量,并避免过早终止治疗。
6 适应症与临床评价
在临床单一使用该药物时,其最佳有效率为50%,毒性可接受,具有回顾性性质,且反应相对较短。苯达莫司汀多用于治疗:(1)苯丁酸氮芥医治效果不满意的CLL;(2)单用RTX或合用救治后,6个月发生疾病进展的NHL[35]。同时,其对MM、BC等肿瘤疗效也显著。
6.1 惰性B细胞非霍奇金淋巴瘤 苯达莫司汀,无论是作为单药还是联合治疗,在对惰性B细胞非霍奇金淋巴瘤具有优异的治疗效果。研究结果显示,58例患者进行每3周d1、d2(120 mg/m2)的医治,总有效率为73%,CR为11%。而且,在另一项使用替代方案的欧洲试验中也获得了类似的结果。在这项研究中,76例惰性非霍奇金淋巴瘤患者接受相同方案治疗,总有效率为77%,CR为15%[36]。同时,近期临床研究显示,102名难治性非霍奇金淋巴瘤患者在28个机构按照相同的时间表接受治疗,ORR为75%;滤泡性淋巴瘤(FL)ORR为74%,小淋巴细胞性淋巴瘤(SLL)ORR为71%[37]。值得注意的是,苯达莫司汀治疗1 473例黏膜相关淋巴组织(MALT)淋巴瘤,CR率为43。基于这些结果,可见其疗效极佳。
6.2 霍奇金淋巴瘤 相关病例报告表明,单一药物苯达莫司汀在医治霍奇金淋巴瘤患者中,具有诱导CRS(先天性风疹综合征)的能力[38,39]。即使,在接受过ASCT或异基因干细胞移植(allo-SCT)之后也是如此。通过数据调查显示,36名患者服用苯达莫司汀120 mg/m2(1 d/2 d),每28天1次或2次,约75%的患者以前接受过ASCT。ORR为53%,CR率为33%。目的观察大剂量治疗和异基因造血干细胞移植(allo-SCT)患者以及原发性化疗耐药患者的疗效。虽然反应往往是短暂的,但一些患者能够成功地接受干细胞移植。而且,毒性轻微,3~4级不良事件少见。
通过一项以意大利患者命名的计划,评估了10个机构中41名接受单一药物苯达莫司汀(有三种不同的时间表,90、100和120 mg/m2)的患者;在这项研究中,85%的患者以前接受过ASCT,10年随访显示,5年和10年无复发生存率分别为82%和70%,总生存率分别为83%和73%,仅2例复发,且均在复发后接受了强化治疗[40]。
首次疗效评估(经过2~4个周期)的ORR为78%,CR为29%。完成6~8个疗程后,最终ORR为58%,CR为31%。8名ASCT后复发的患者在苯达莫司汀治疗后接受了allo-SCT。这些研究证实了单药苯达莫司汀在部分严重预处理患者中的重要性和用药的安全性。
6.3 外周T细胞淋巴瘤 复发/难治性PTCL是一种极具挑战性的疾病,到目前为止,除了罗米地辛和普拉曲辛外,用于这些患者的有效方案或药物很少。即使采用大剂量治疗和干细胞支持,预后也很差。很少有研究涉及苯达莫司汀在PTCL中的作用。少数临床前资料显示,单药苯达莫司汀对T细胞淋巴瘤细胞株的体外效应。在T淋巴细胞白血病中也观察到与阿仑图珠单抗的协同作用。在单药苯达莫司汀治疗复发性/难治性PTCL的Ⅱ期多中心前瞻性研究(本特利试验)的研究中,得出了令人振奋的结果,这项研究包括60例复发/难治性PTCL患者,用苯达莫司汀120 m/m2,第1天和第2天,共治疗6个周期;值得注意的是,ORR为50%,CR率为28%。对苯达莫司汀的反应不受既往化疗敏感性、组织学、国际预后指数(IPI)评分或肿瘤体积的影响。PFS为3.6个月,但30%的患者有效时间超过6个月;56%和38%的患者出现3~4级中性粒细胞减少和血小板减少,仅25%完成所有周期,33%的患者接受的周期少于3个周期[41]。虽然这些数据很具优势,但还需要更大规模的验证性研究。
6.4 慢性淋巴细胞性白血病 苯达莫司汀在治疗慢性淋巴细胞性白血病时,复发背景下最早的试验是在15名复发或难治性慢性淋巴细胞性白血病患者中进行的剂量筛选试验,治疗的最大耐受量为110 mg/m2,推荐剂量为每4周d1、d2(100 mg/m2),共6个周期。就总体缓解率(ORR)(67%对30%)和无进展生存期(21.5个月对8.3个月);就效果为而言,该方案优于苯丁酸氮芥单药治疗;同时,治疗结果显示,有9名患者对治疗有反应,其中包括4名心肾综合征(CRS)患者,治疗前景看好[42]。
联合治疗CLL的方案中,FDA推荐的是FCR(氟达拉滨+环磷酰胺+利妥昔单抗),但BR(苯达莫司汀+利妥昔单抗)不比FCR差,且更低毒[37]。而RCOPR(美罗华+环磷酰胺+长春新碱+强的松+利妥昔单抗)是治疗NHL的前沿方案,若将该方案修改为 RBR(美罗华+苯达莫司汀+利妥昔单抗)。其医药支出则分别为(单位欧元)8310、8014,这也表明它能为NHL患者减少一定的医药负担。
查阅文献可,FCR治疗伴随着多种不良事件,主要是血液毒性,导致更高的感染率(77%对65%)知[43]。此外,FCR会导致长期的骨髓抑制,有可能在完成治疗后出现晚期感染。FCR的另一个安全信号是继发性恶性肿瘤的发生,有较高风险导致急性骨髓性白血病或骨髓增生异常综合征。在一项研究中,在安全性方面,B-R方案的ADR相对较少,多表现为白细胞与淋巴细胞降低。同时,2组之间的感染率相似。然而,B-R很少引起脱发,并且,B-R组出现药物过敏反应,主要表现为皮肤反应,但毒性可控。B-R已显示出与治疗标准相当或更好的效果,改善了无进展生存期(PFS)的预后,显著改善了膝内侧副韧带(MCL)的组织学,显示出明显但有利的毒性,并具有更好的耐受性。在B-R方案中,苯达莫司汀的剂量在首周为d1、d2(90 mg/m2),RTX的剂量为375 mg/m2,后续周期,RTX剂量为500 mg/m2,最多6个周期。ORR为88%,完全缓解率(CR)为23.1%,PFS为33.9个月。同时,与FCR的比较,尽管BR在CR方面逊于FCR(FCR为39.7%,BR为30.8%)和中位PFS(FCR为55.2个月,BR 为41.7个月),中位观察时间为37.1个月;两种疗法的ORR(FCR为95.4%,BR为95.7%)和总生存期(OS)在36个月时(FCR为90.6%;BR为92.2%)相似。重要的是,两种治疗方案之间在>65岁患者的PFS并无显着差异。毒性,特别是对于严重感染,对于65岁的患者,B-R方案效果更好[44,45]。
尽管B-R方案不如FCR,但应将B-R方案引入临床治疗中。治疗的依据应根据具体的目标和患者的合并症,即B-R方案的选择应在CLL的一线设置中个体化。
7 药物相互作用
苯达莫司汀主要通过体内的HOCT1转运蛋白转运到细胞中。代谢酶CYP1A2和GSTA1催化代谢并最终将其排泄。苯达莫司汀在体内Ⅰ相代谢主要通过水解代谢,水解产物是两种没有活性的代谢产物(一羟基和二羟基苯达莫司汀)。另一途径是经 CYP1A2 酶代谢生成γ-羟基苯达莫司汀(M3)和N-去甲基苯达莫司汀(M4),M3和M4血浆浓度分别相当于苯达莫司汀的10%和1%,M3的细胞毒活性类似于苯达莫司汀,M4的活性比苯达莫司汀低5~10倍[46]。CYP1A2抑制剂,可增加苯达莫司汀的血药浓度并降低其活性代谢物的血药浓度,如氟伏沙明,环丙沙星等。CYP1A2诱导剂,可降低苯达莫司汀血浓度并增加其活性代谢产物的血浓度,如奥美拉唑, 吸烟等。故联合用药应谨慎,特殊情况时可并用CYP1A2抑制剂以增加治疗效果。
而在Ⅱ相反应中,与谷胱甘肽形成共轭物是重要的途径之一。消除主要通过肾脏(约50%)和粪便(约25%)。同时,其药代动力学并不会因性别、年龄、中度肝损伤和中度至轻度肾损伤而改变[47]。
8 总结与展望
表苯达莫司汀作为新时期抗癌药物代表之一,其疗效和安全性等优势尤为明显。苯达莫司汀单药或者联合治疗方案的推出,被医药领域广泛接受和运用,在一些发达国家甚至作为一线抗癌药物。
2018年12月17日,其在中国获批上市,获批适应症为在RTX或含RTX方案治疗后,发生病情进展的NHL。2019年5月26日,苯达莫司汀在中国举办上市会,正式在中国推出这款重磅产品。同年12月11日,中国生物制药发布公告,正大天晴的新3类仿制药注射用盐酸苯达莫司汀获批上市,并视同通过仿制药质量和疗效一致性评价,系国内首仿。丁香园Insight 中标数据库显示,其国内最新中标价为6 000元/支(规格:100 mg)。同时,目前国内共有14家企业在研发注射用盐酸苯达莫司汀,其中4家提出了上市申请,3家在临床试验阶段,另有7家获批临床但尚未启动临床试验。大量医药企业的投入,使其在国内大范围上市时,将可降低病人医疗费用,从而降低医药负担[48]。
综上所述可知,因其安全,低毒,效果突出,针对性强,作用时间长,活性高,患者易耐受等优势,受到国内外医药行业的广泛关注与研究,预计该药在未来会成为一个重要的抗肿瘤药。同时,其治疗结果的低复发率与低死亡率,以及价格相对低廉,使其在国内具有广泛医疗需求,市场推广前景非常好。
