基于肠道菌群介导的炎性反应研究黄芪多糖对结肠炎相关癌症的作用
2021-07-08刘雷蕾马淑然
刘雷蕾 马淑然

摘要 目的:探討黄芪多糖(APS)对结肠炎相关癌(CAC)小鼠和结肠癌细胞中肠道细菌诱导的Toll样受体-4/核因子-κB(TLR4/NF-κB)信号通路的影响。方法:将40只C57BL/6J雄性小鼠随机分为对照组(n=10),模型组(n=15)和APS组(n=15)。模型组和APS组由氧化偶氮甲烷和葡聚糖硫酸钠制成CAC模型。对照组和模型组给予0.9%氯化钠注射液,APS组给予100 mg/kg APS灌胃14 d。动物研究中,通过HE染色方法检测小鼠中结肠直肠的病理状况;通过16S rDNA测序分析肠道菌群的特征;通过酶联免疫吸附试验测定脂多糖浓度;免疫组化法检测结肠组织中TLR4和NF-κBp65蛋白的表达。体外研究中,进一步验证了APS对人结肠癌细胞增殖和迁移的影响,运用MTT测定和划痕实验用于评估细胞活力测定;通过免疫荧光检测NF-κBp65的核转位;Western blot检测E-cadherin和N-cadherin蛋白的表达。结果:测序结果表明,模型组以革兰氏阴性菌拟杆菌属为主,APS组肠道菌群多为革兰氏阳性菌乳球菌属和双歧杆菌属;APS组LPS、TLR4和NF-κBp65蛋白的表达水平明显低于模型组;APS可以抑制LoVo细胞和HCT116细胞的增殖和迁移能力;APS(40 μg/mL)可抑制NF-κB的核转位,降低N-cadherin蛋白的表达,增加E-cadherin蛋白的表达。结论:APS通过抑制革兰氏阴性病原体,减少LPS的释放,抑制TLR4/NF-κB信号通路,阻止CAC的发生,且APS可有效抑制人结肠癌细胞的EMT过程,有效控制肿瘤的增殖和迁移。
关键词 结直肠癌;肠道菌群;脂多糖;黄芪多糖;核因子κB
Study on the Mechanism of Astragalus Polysaccharide on Colitis-Related Cancer Based
on the Inflammatory Response Mediated By Intestinal Flora
LIU Leilei,MA Shuran
(Beijing University of Chinese Medicine,Beijing 10029,China)
Abstract Objective:To explore the effects of Astragalus polysaccharide(APS)on intestinal bacteria induced Toll-like reeeptor-4 / nuclear factor-κB(TLR4/NF-κB)signaling pathway in colitis-associated cancer(CAC)mice and colon cancer cells.Methods:A total of 40 C57BL/6J male mice were randomLy divided into a control group(10 mice),a model group(15 mice),and an APS group(15 mice).The model group and APS group were made CAC model by azoxymethane and sodium dextran sulfate.The control group and model group were given 0.9% sodium chloride injection,and the APS group was given 100 mg/kg APS by gavage for 14 days.In this study,the Histopathological Examination method was used to detect the pathological conditions of colorectal in mice.Characteristics of intestinal flora were analyzed by 16S rDNA sequencing.Lipopolysaccharide concentrations were determined by enzyme 1inked immunosorbent assay.Expressions of TLR4 and NF-κB p65 proteins in colon tissue were detected by immunohistochemistry.In the in vitro study,we further validated the effects of APS on proliferation and migration of human colon cancer cells.The MTT assay and Scratch test were used to evaluate cell viability assays.The nuclear translocation of NF-κB p65 was detected by immunofluorescence.Western blot was used to detect the expression of E-cadherin and N-cadherin proteins.Results:Sequencing results showed that Gram-negative bacteria(Bacteroides)were commonly detected in the model group,and intestinal flora in APS group were mostly Gram-positive bacteria(Lactococcus and Bifidobacterium).Expression levels of LPS,TLR4,and NF-κB p65 proteins in APS group were significantly lower than those in the model group.APS can inhibit the proliferation and migration of LoVo cells and HCT116 cells; APS(40 μg/mL)can inhibit the nuclear translocation of NF-κB,reduce the expression of N-cadherin protein,and increase the expression of E-cadherin protein.Conclusion:APS can prevent CAC by inhibiting Gram-negative pathogens,reducing the release of LPS and inhibiting TLR4/NF-κB signaling pathway.And APS can effectively inhibit the EMT process of human colon cancer cells and effectively control tumor proliferation and migration.
Keywords Colorectal carcinoma; Intestinal flora; Lipopolysaccharide; Astragalus polysaccharide; Nuclear factor κB
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.02.008
最新全球癌症统计数据《全球癌症报告》显示2018年结肠直肠癌(Colorectal Carcinoma,CRC)新增180万例患者,占比10.2%,位居癌症发病率的排行榜第3名。从死亡病例数字来看,结肠癌死亡率仅次于肺癌,位居第2,有88.1万人死于结直肠癌,占比9.2%[1]。最近10年来,伴随着饮食、肥胖和生活方式的改变,中国CRC的发病率和死亡率呈现上升趋势[2]。目前对结直肠癌的治疗主要是通过手术、放化疗以及免疫治疗等手段,然而仍有将近40%~50%的CRC患者在确诊后5年内死亡[3]。最新临床研究显示,在用抑制负性免疫调节治疗癌症的药物PD-1或PD-L1治疗时,部分患者对药物反应降低,主要因为患者存在肠道菌群失调情况,需要治疗时配合调节肠道菌群才能提高药物应答率[4]。因此,促使我们寻求有效的辅助治疗办法,以改善CRC的治疗。
目前一些中药已经被证实具有多靶点,多通道,低不良反应,延长生存期,减轻疼痛,改善生命质量的广谱抗肿瘤作用。例如由黄芪和女贞子(2∶1,w/w)组成的贞芪扶正胶囊常作为外科手术的辅助用药,以提高免疫力,促进癌症患者免疫功能的恢复[5]。药理研究表明,黄芪水提取物具有多种生物学功能。黄芪多糖(Astragalus Polysaccharide,APS)是黄芪的主要成分,在控制炎性反应和氧化应激,维持和调节肠内稳态中起到关键作用[6]。APS已被广泛用于抑制肿瘤生长,细胞侵袭和血管生成,以及诱导细胞凋亡的研究中[7]。APS可以调节Wnt,p53和NF-κB各种癌症信号通路,并与特定的转录分子相互作用,发挥抗肿瘤作用[8]。在临床联合治疗中,APS联合鼻咽癌一线化疗药顺铂可通过调节Bax/Bcl-2比值和半胱天冬酶增强鼻咽癌细胞的化疗敏感性[9]。
长期存在的慢性炎性反应是炎性反应性肠病中结直肠癌的关键诱发因素,由炎性反应性肠病发展成的结直肠癌叫作结肠炎相关癌症(Colitis-associated Cancer,CAC)。在CRC中CAC占到15%~20%的比例[10]。在CAC进展中,包括NF-κB,IL-6/STAT3,COX-2/PGE2和IL-23/Th17在内的多种促炎途径被激活,通过诱导产生炎性反应递质而促进肿瘤发生,上调抗细胞凋亡基因的表达,刺激肿瘤细胞增殖以及血管生成[11]。作为肠黏膜生物屏障的重要组成,肠道菌群与受损肠道黏膜之间的相互作用同样在CAC的发生和发展中起到了重要作用[12]。上皮间充质转化(Epithelial-Mesenchymal Transition,EMT)是一种上皮细胞失去上皮特性而获得间质细胞表型的生物学过程,主要与细胞间的黏附中断、细胞极性丧失和细胞离散导致的恶性肿瘤的侵袭和转移相关[13]。肿瘤微环境可促使癌细胞之间相互作用,通过自分泌和/或旁分泌生长因子、细胞因子和细胞外基质蛋白等诱导EMT的发生[14]。EMT的发生受多种信号通路和细胞因子的调控,其中NF-κB信号通路对肿瘤细胞发生EMT有重要影响。
因此,我们假设天然药物APS可通过调节肠道菌群,抑制菌群介导的炎性反应和EMT,而发挥抗癌作用。在目前的工作中,为了检验这个假设,我们建立了AOM/DSS诱导的CAC小鼠模型,并证明了APS在调节肠道菌群和抑制炎性反应方面有积极作用。同时,APS在体外抗肿瘤活性检测中,已被证实具有抗人结肠癌细胞LoVo增殖和迁移的作用,且对EMT的发生有抑制作用。我们的发现表明APS具有治疗CAC的潜力并就其可能的机制提供新的有用线索。
1 材料与方法
1.1 材料
1.1.1 动物与细胞 人结肠癌细胞LoVo细胞和HCT116细胞,购自美国模式培養物研究所(American Type Culture Collection,ATCC)。所有细胞用含10%胎牛血清和1%双抗(100 U/mL青霉素和100 μg/mL链霉素)的RPMI1640完全培养液于37 ℃、5% CO2细胞培养箱中常规培养,24 h贴壁后更换新的培养液,继续培养,隔日换液,待细胞铺满培养瓶底面积的90%时进行传代。SPF级C57BL/6J小鼠,雄性,6周龄,18~20 g,购自北京华阜康生物科技股份有限公司,许可证号SCXK(京)2014-0004;饲养于中国医学科学院放射医学研究所,饲养环境为SPF级[温度(20±2)℃,相对湿度60%,气流速度≤0.18 m/s]。
1.1.2 药物 黄芪多糖(上海吉至生化科技有限公司,货号:C54200-25 g)
1.1.3 试剂与仪器 青霉素-链霉素双抗溶液(HyClone公司,美国,货号:SV30010);胎牛血清(HyClone公司,美国,货号:SV30087.01);RPMI1640培基(HyClone公司,美国,货号:SH30203.05);氧化偶氮甲烷AOM(sigma公司,美国,货号:A5486);葡聚糖硫酸钠DSS(MP公司,美国,货号:02160110-CF);E.Z.N.A. Stool DNA Kit(Omega公司,美国,货号:M4015-02);小鼠脂多糖ELISA试剂盒(天津贝尔格莱科技有限公司,货号:A-2631);小鼠NF-κB抗体(CST公司,美国,货号:6956);小鼠TLR4抗体(武汉博士德生物工程有限公司,货号:BA1717);小鼠E-cadherin抗体(CST公司,美国,货号:14472);小鼠N-cadherin抗体(CST公司,美国,货号:14215);DyLight488-羊抗兔IgG荧光二抗(武汉博士德生物工程有限公司,货号:BA1127);光学显微镜(Olympus公司,日本,型号:BX51T-PHD-J11);离心机(Eppendorf公司,德国,型号:5430);菌群测序平台(北京诺禾致源科技股份有限公司,型号:HiSeq2500 PE250);多功能板读板机(Thermo公司,德国,型号:Multiskan FC);凝胶成像系统(Bio Rad公司,美国,型号:MP5000)。
1.2 方法
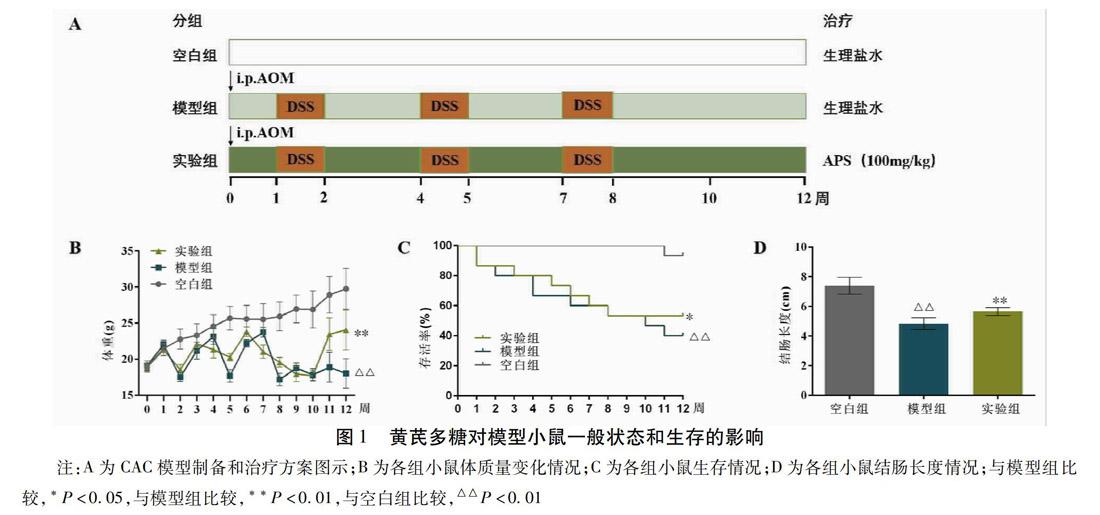
1.2.1 分组与模型制备 CAC小鼠模型采用AOM联合DSS周期性诱导建模法(图1A)。本次实验共分为3组,共计40只小鼠,空白组(n=10),模型组(n=15)和观察组(n=15)。除空白组外,其余小鼠先予10 mg/kg的AOM腹腔注射,再以蒸馏水和普通饲料喂养1周,第2周将饮水换为浓度2%的DSS溶液自由饮用,第3、4周撤去DSS溶液,仍恢复蒸馏水喂养;如此1周DSS加2周蒸馏水喂养为1个致炎周期,总共重复3个致炎周期完成建模。
1.2.2 给药方法 根据人与小鼠之间药物剂量换算方法,观察组组小鼠以100 mg/kg的黄芪多糖APS灌胃。模型组和空白组予以0.2 mL生理盐水灌胃。连续灌胃给药14 d。
1.2.3 检测指标与方法
1.2.3.1 组织病理学评价 治疗结束后处死全部小鼠,取结肠组织并固定于中性福尔马林液中,固定24 h以后,执行常规脱水及石蜡包埋,使用石蜡切片机4 μm切片。将待染色的切片于65 ℃烘箱中放置0.5 h后,常规HE染色,用适当浓度的中性树胶封片,用于显微镜拍摄分析。根据结肠标本组织学病变评分标准[15-17]进行光镜下评价。见表1。
1.2.3.2 肠道菌群基因测序 取100 mg粪便样本加入2 mL离心管中,按照E.Z.N.A.TMStool DNA Kit操作步骤进行提取,得到纯化的基因组DNA后,釆用紫外分光光度计分别检测总DNA在260 nm和280 nm两处的吸光度,观测总DNA的浓度和OD 260/OD280的比值。纯化的基因组存放-20 ℃保存待测。使用TruSeq DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用HiSeq2500 PE250进行上机测序。
1.2.3.3 酶联免疫吸附试验检测血清LPS浓度 治疗结束后首先用10%水合氯醛麻醉剂麻醉小鼠,随后从小鼠眼眶采取全血,室温自然凝固10 min,用低温高速离心机以4 ℃,3 000 r/min,离心半径10 cm,离心10 min,提取上清液,按照ELISA试剂盒操作规程测定血清LPS水平。图3A展示了本次检测的标准曲线及计算方程,R2=0.981 9提示线性良好。
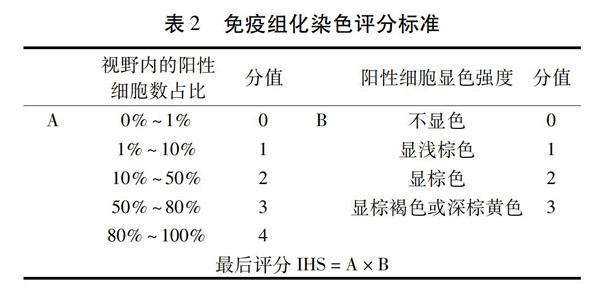
1.2.3.4 免疫组织化学染色检测TLR4和NF-κB蛋白表达 实验束后解剖小鼠腹腔,于距肛门2.5 cm处取0.5 cm×0.5 cm×0.1 cm结肠组织块浸泡于中性甲醛溶液中固定。结肠组织脱水和包埋后切片。把切片后的组织放入1%甲醇双氧水中,室温浸泡10 min后洗净,再用pH为6.0的0.01 mmol/L柠檬酸盐缓冲液浸泡。山羊血清室温封闭20 min。一抗TLR4(1∶200)和NF-κB p65(1∶100)4 ℃孵育过夜。PBS洗净后滴加二抗IgG(1∶200)37 ℃孵育20 min。加辣根酶标记链霉卵白素工作液(S-A/HRP),37 ℃孵育20 min。使用二氨基联苯胺(DAB)显色,用苏木素复染细胞核1 min后在光学显微镜下觀察。按照免疫组化染色评分标准[18]评分。见表2。
1.2.3.5 细胞活力检测 分别取对数生长期的LoVo细胞和HCT116细胞,于96孔板上每孔加入200 μL 2.5×104个/mL的细胞。待细胞贴壁后,弃去旧培养液,每孔分别加入200 μL用RPMI 1640培基配制的160 μg/mL、80 μg/mL、40 μg/mL、20 μg/mL、10 μg/mL和5 μg/mL浓度的APS溶液和终浓度为1 μg/mL LPS,空白对照组加200 μL的RPMI1640培基。分别于加药干预24 h、48 h和72 h后弃去培养液,加入100 μL 0.5 mg/mL的MTT溶液,置于细胞培养箱中孵育4 h,弃去MTT溶液,每孔加入150 μL的DMSO溶液,避光摇匀后放入多功能酶标仪测定溶液在570 nm处的吸光度,得到OD值,计算细胞增殖抑制率。取对数生长期的LoVo细胞和HCT116细胞,消化后离心,以完全培养基重悬细胞,以2×105个/mL的浓度,每孔2.5 mL接种于六孔板中,待细胞铺满孔底后,用枪头沿着直尺垂直于六孔板划痕。继续加药培养24 h和48 h,观察80 μg/mL的APS对HCT116细胞转移的影响,以及40 μg/mL的APS对LoVo细胞迁移的影响。
1.2.3.6 细胞免疫荧光检测NF-κB p65分布 将对数生长期的LoVo细胞种于六孔板并分组。加40 μg/mL的APS干预48 h后吸去培基,每孔加入2 mL的4%多聚甲醛固定15 min,吸除多聚甲醛,每孔加入1 mL 0.1%TritonX-100室温通透5 min,再用PBS清洗3次,每孔加入1 mL 3%BSA室温封闭30 min,弃去封闭液,每孔加入适量用3%BSA稀释过的NF-Κb p65抗体(1∶500),置于冰上摇匀后存放于4 ℃冰箱过夜,孵育一抗。从冰箱中取出后于37 ℃恒温箱中复温45 min,用PBS清洗3次,每孔加入用1%BSA稀释过的DyLight488-羊抗兔IgG荧光二抗(1∶400),室温避光孵育1 h。于暗处吸除二抗,以PBS洗涤3次,每孔加入1 mL细胞核染液DAPI(5 μg/mL),室温孵育,吸除DAPI后,加入1滴(50 μL)的抗荧光淬灭封片液,于荧光显微镜下观察NF-κB p65在细胞质和细胞核中的分布。
1.2.3.7 蛋白质印迹分析检测NF-κB、E-cad、N-cad蛋白表达 将对数生长期的LoVo细胞种于六孔板并分组。加40 μg/mL的APS干预48 h后吸去培基,加入300 μL预冷的RIPA裂解液(已加入蛋白酶抑制剂PMSF),充分裂解后,13 000×g 4 ℃离心10 min,取上清液即蛋白提取物。按照BCA试剂盒说明测定蛋白浓度。来自每个样品的20 μg蛋白质通过8%的SDS-PAGE电泳分离胶,并转移到PVDF膜上。在室温下用含5%BSA的TBST(0.1%)封闭2 h,将PVDF膜与一抗(NF-κB p65 1∶1 000;E-cad 1∶1 000;N-cad 1∶1 000;β-Actin 1∶500)在4 ℃下孵育过夜。取出PVDF膜,用TBST冲洗3次,5 min/次。之后加入相应的二抗(用5%的BSA按照1∶10 000稀释),置于摇床上室温孵育1.5 h,结束后用TBST冲洗PVDF膜5次,于凝胶成像系统,曝光成像,导出条带图片,采用Image J软件分析条带的灰度值,计算出不同条带的相对灰度值。
1.3 统计学方法 采用SPSS 20.0统计软件进行数据分析,符合正态分布的数据采用均数±标准差(±s)表示,2组间分析用Unpaired T test,多组间分析用one-way ANOVA分析。不符合正太分布的数据采用中位数(percent25,percent75)和平均秩进行统计描述,用Mann-Whitney检验分析不同组之间的差异性。所有检验均以双侧检验为显著性水准,以P<0.05为差异有统计学意义。
2 结果
2.1 APS改善了CAC模型鼠健康状况和生存指数 空白组小鼠在整个造模期以及后续治疗期皆表现出良好的生长状态,体质量稳定增长,粪便情况正常。在AOM/DSS造模过程中,小鼠在DSS致炎刺激后表现出明显的体质量下降,活动状态减缓,部分小鼠出现稀便或便血;在停止DSS刺激后的双蒸水喂养阶段,小鼠体质量逐渐恢复增长,便血减少;经过反复的致炎刺激小鼠最终体质量降为(17.83±0.86)g。见图1B。在整个治疗期(第11、12周),模型组小鼠精神状态萎靡,便质稀,毛发杂乱,活动少,进食和饮水相对较少,治疗终点体质量维持在(18.02±2.05)g。观察组小鼠表现出较好的活动和精神状态,进食和饮水相对增加,稀便减少,治疗终点体质量恢复到(24.05±2.74)g,明显高于模型组(P<0.01)。根据Log-rank(Mantel-Cox)存活曲线。见图1C。从第11周到实验结束,APS的治疗提高了经AOM/DSS造模处理的小鼠的存活率(P<0.05)。此外,经AOM/DSS刺激后,模型组与空白组比较,结肠长度明显缩短(P<0.01)。与模型组比较,观察组的结肠长度明显增长(P<0.01),提示APS能够缓解由DSS致炎刺激导致的结肠短缩。见图1D。
2.2 APS减少结肠肿瘤和改善非典型增生 实验结束后纵向剖开结肠,统计分析各组小鼠结肠肿瘤个数和肿瘤大小差异。肿瘤大小以Load值表示,即单只小鼠全部肿瘤的长径乘短径之和。AOM/DSS周期性诱导小鼠形成结肠肿瘤的发病率为100%。如图2A所示,模型组小鼠结肠肿瘤个数为(13.50±3.10)个。见图2B。模型组单只小鼠肿瘤大小Load值为(50.17±22.84)mm2。治疗结束后,观察组肿瘤个数为(4.33±1.63)个,Load值为(19.00±28.32)mm2。APS(100 mg/kg)虽然没有阻止肿瘤的发生,但是明显降低了肿瘤个数(P<0.01)和大小(P<0.05)。HE染色病理结果图2E可见,空白组肠黏膜各层结构清晰,形态正常,局部黏膜下层未见增生和肿瘤。模型组肠黏膜各层结构欠清晰,可见重度异型增生,细胞异型性明显,层次增多,极像紊乱,腺管结构紊乱,部分腺体有融合,异型腺体限于黏膜层,全部隐窝缺损,广泛的粒细胞分布伴显著浸润。观察组肠黏膜各层結构清晰,肠绒毛形态欠规整,可见低或中度异型增生。图2C描述了各组非典型增生评分情况。模型组结肠组织非典型增生评分中位数为3,percent25为2.75,percent75为3,与空白组比较显著增高(P<0.01)。观察组肠组织非典型增生评分中位数为1,percent25为1,percent75为2,与模型组比较明显降低(P<0.01)。
2.3 APS抑制CAC小鼠肠道炎性反应 病理结果见图2E(HE染色,×400),空白组肠黏膜未见明显炎性细胞浸润。模型组全部隐窝缺损,广泛的粒细胞分布伴显著浸润,炎性反应评分中位数为4,percent25为3,percent75为4。经APS治疗后,结肠组织中部分隐窝缺损,偶有粒细胞浸润,呈轻度炎性反应,炎性反应评分中位数为1.5,percent25为1,percent75为2,与模型组比较明显降低(P<0.01)。见图2D。实验进一步用ELISA法检测了各组小鼠血清中致炎物质LPS的浓度。见图3B。空白组小鼠血清LPS浓度为(9.25±1.30)U/L,模型组LPS平均水平为(18.99±2.86)U/L,显著升高(P<0.01)。与模型组比较,APS治疗后LPS平均水平为(8.99±1.44)U/L,显著降低(P<0.01)。
研究已经证实在CAC发展中,肠道微生物屏障损伤,菌群移位,肿瘤细胞表达的TLR4可感知到革兰氏阴性菌裂解后释放出的内毒素LPS,进而向下通过激活MyD88/TRAF6通路活化NF-κB,进一步扩大炎性反应[19]。本研究在接下来的实验中,用免疫组化的方法检测了各组小鼠结肠组织中TLR4蛋白(图3C)和NF-κB p65蛋白(图3D)的表达情况。空白组TLR4蛋白和NF-κB p65蛋白着色浅棕色呈弱阳性,IHS评分为(1.17±0.75)分和(1.00±0.63)分。与空白组比较,模型组TLR4和NF-κB p65的IHS评分为(12.83±2.71)分和(9.33±2.34)分,蛋白着色呈深棕色或棕褐色,表达水平显著提高(P<0.01)。与模型组比较,观察组TLR4和NF-κB p65的IHS评分为(3.67±2.07)分和(3.83±2.04)分,蛋白着色呈浅棕色,表达水平降低(P<0.05)。见图3E。
2.4 APS改善CAC小鼠肠道菌群 本研究以97%的一致性将测序所得序列聚类成为OTUs(Operational Taxonomic Units),并对OTUs的代表序列进行物种注释。图4A中,物种累积箱形图(Species Accumulation Boxplot)描述了随着样本量的增加物种多样性增加的分析,提示此环境中的物种并不会随样本量的增加而显著增多。如图4B所示,用shannon指数反映样品内的微生物群落的多样性,并通过组间比较发现模型组shannon指数为(5.40±0.25)低于空白组(6.35±0.27)(P<0.05),经APS处理后,shannon指数升高到(6.09±0.32),高于模型组(P<0.05)。提示APS可以改善菌群多样性。
根据属水平的物种注释及丰度信息,选取丰度排名前25的菌属,根据其在每个组中的丰度信息,从物种和分组2个层面进行聚类,绘制出热图。如图4C所示,空白组以Akkermansia、Alloprevotella、Allobaculum、Desulfovibrio和Lachnospiraceae为主。而模型组中Bacteroides、Erysipelatoclostridium和Prevotellaceae聚集较多,Akkermansia、Alloprevotella、Allobaculum和Lachnospiraceae的含量较低。经APS处理后,Lactococcus、Parasutterella、Bifidobacterium和Lachnospiraceae聚集较多。为了寻找Species分类水平,3组样本之间优势物种的差异,选取种分类水平上平均丰度排名前10的物种,生成三元相图[20],可以直观看出模型组优势物种为Bacteroides_acidifaciens,空白组优势物种为Helicobacter_ganmani,观察组优势物种为Lactobacillus_animalis和Lactococcus_piscium(图4D)。研究进一步用LEfSe分析组与组之间差异有统计学意义Biomarker[21],即组间差异显著的物种。如图4E所示,空白组和模型组比较,模型组的Biomarker为Bacteroides和Prevotellaceae;空白组的Biomarker为Alloprevotella和Allobaculum。如图4F所示,模型组和APS组比较,模型组的Biomarker为Bacteroidales_bacterium_ph8。
2.5 APS抑制LoVo细胞和HCT116细胞增殖和迁移 研究已经证实1 μg/mL LPS作用48 h时可明显促进结肠癌细胞LoVo和HCT116的增殖。本研究先用LPS(1 μg/mL)刺激结肠癌细胞LoVo和HCT116,再给予不同浓度APS干预,用MTT测定法测定了APS对这2种细胞活力的影响。如图5A,B所示,160 μg/mL、80 μg/mL、40 μg/mL、20 μg/mL、10 μg/mL和5 μg/mL浓度的APS对结肠癌细胞LoVo和HCT116有不同的抑制作用,其中40 μg/mL的APS对LoVo细胞的抑制作用明显,浓度80 μg/mL的APS对HCT116抑制作用明显。这些发现表明,适宜浓度的APS可以抑制CRC细胞增殖。
本研究还通过划痕实验证实了40 μg/mL的APS作用于LoVo细胞48 h可以抑制其迁移能力,而80 μg/mL的APS作用于HCT116细胞48 h也可以抑制其迁移能力。如图5C,D所示,LPS(1 μg/mL)刺激结肠癌LoVo细胞和HCT116细胞24 h和48 h后皆明显增强了肿瘤细胞的增殖和迁移能力,在加入适宜浓度APS后,划痕面积未见明显缩小,证实APS对结肠癌LoVo细胞和HCT116细胞的迁移能力有抑制作用。
2.6 APS抑制LPS诱导的LoVo细胞NF-κB p65核转位 已经有同类研究证实LPS可经TLR4/NF-κb信号通路活化NF-κB[22]。实验利用免疫荧光法直观地观察到APS对NF-κB p65的影响。见图6。NF-κB p65在LoVo细胞中呈现出低表达。LPS(1 μg/mL)刺激结肠癌LoVo细胞48 h后,NF-κB p65在LoVo细胞的细胞核和细胞质中表达皆升高。再予以40 μg/mL的APS处理后,NF-κB p65在细胞中的表达减少,且主要集中在细胞质中,入核情况减少,说明APS可以抑制NF-κB的活化。本研究还用WB的方法检测了细胞中总NF-κB p65蛋白的含量,相对于空白组而言,LPS处理的模型组细胞中NF-κB p65蛋白灰度值有所升高(1.25±0.49),而经APS(40 μg/mL)处理后,灰度值明显下降(0.63±0.17)(P<0.01)。见图7。
2.7 APS抑制LPS诱导的LoVo细胞EMT 研究表明NF-κB激活后进入细胞核后可与特定基因结合,抑制E-cadherin(E-cad)的表达,促进N-cadherin(N-cad)的表达,从而促使EMT发生[23]。本研究进一步用WB的方法测定了EMT发生的相关蛋白E-cadherin和N-cadherin的相对灰度值。见图7。观察组相对空白组的E-cadherin蛋白表达量为(1.39±0.22),显著高于模型组(0.54±0.15)(P<0.01)。观察组相对空白组的N-cadherin蛋白表达量为(0.62±0.16),显著低于模型组(1.76±0.73)(P<0.01)。这样的结果说明APS(40 μg/mL)可以通过抑制NF-κB活化,减少N-cadherin蛋白的表达,增加E-cadherin蛋白的表达,而达到抑制肿瘤细胞迁移的效果。
3 讨论
由肠道炎性反应,到不典型增生,再到癌变的途径是目前比较公认的结直肠癌发生发展的病理进程[24]。本研究建立的AOM/DSS模型[25],即是将肠上皮细胞暴露于慢性炎性反应环境中,造成细胞中各种突变接连发生累积,并且在長期的炎性刺激中产生免疫耐受,逃脱免疫清除,发生隐窝细胞增生,进而使结肠上皮发生瘤变,最终导致肿瘤形成。在这一过程初期,肠黏膜屏障损伤,菌群移位,致病物质造成的炎性刺激可使免疫细胞如巨噬细胞被募集到病灶处,并分泌细胞因子,发挥抗感染作用和修复受损组织作用[26]。但在菌群失调持续存在的情况下,肠黏膜长期被炎性因子和趋化因子包围,形成炎性微环境,进一步导致抗感染-修复平衡失衡,激活了肠上皮细胞原癌基因,最终导致恶化[27]。本研究造模结束后小鼠呈现出消瘦、精神萎靡、毛发杂乱无光泽以及活动度差等一般表现。解剖后发现于结直肠缩短,且远端出现明显肿瘤,成瘤率100%。经HE染色病理提示细胞异型性明显,层次增多,极像紊乱,腺管结构紊乱,部分腺体有融合,异型腺体限于黏膜层,伴有广泛的炎性细胞浸润,符合结直肠癌病理评判标准。且进一步检测模型小鼠血清中LPS水平,2倍高于正常小鼠血清LPS浓度。LPS可以继续扩大炎性反应程度,加速肿瘤的形成和发展,符合实验需求。
炎性反應与肿瘤的发生发展之间还需要借助肿瘤微环境中的细胞因子和转录因子产生一些促癌因子,诱导细胞增殖和存活因子的生成,从而促进肿瘤发生发展。LPS可由肠道中革兰氏阴性菌裂解死亡后释放出来。也就是说在CAC模型鼠中血清LPS的升高与肠道中革兰氏阴性菌裂解死亡相关[28]。本研究通过菌群测序发现CAC模型小鼠肠道菌群丰度与正常小鼠比较明显减小,结构多样性和复杂性降低。在菌属水平,CAC小鼠肠道中拟杆菌属所占比例最大。拟杆菌属是一类革兰氏染色呈阴性、无芽孢、专性厌氧的小杆菌。拟杆菌正常寄居于人和动物的肠道、口腔、上呼吸道和生殖道。因长期应用广谱抗生素、激素、免疫抑制剂等,而使机体免疫功能紊乱或菌群失调时,能导致内源性感染。比较重要的拟杆菌包括脆弱拟杆菌和产黑色素拟杆菌。脆弱拟杆菌主要存在于肠道,比肠内的大肠杆菌多100~1 000倍,在临床标本中,为阑尾炎和败血症的常见菌。Dejea C M等[29]研究发现脆弱拟杆菌还可以和一种大肠杆菌psk+Escherichia coli通过相互作用形成一种生物膜,进而损坏结肠黏膜,引发结直肠癌。
革兰氏阴性菌细胞壁主成分LPS可与TLR4结合形成复合物。这个复合物会激活MyD88/TRAF6信号通路[30],进而使IκB蛋白的上游激酶IKK复合物磷酸化激活。被激活的IKK可磷酸化下游的IκB-α。IκB-α是NF-κB抑制蛋白,被磷酸化后又可发生泛素化而降解,从而释放出NF-κB p65/p50二聚体。没有了IκB-α的束缚,p50会拽着NF-κB p65入核。NF-κB p65可识别特定的DNA序列,并与之结合,调控靶基因而发挥生物学效应[31]。研究指出在CAC小鼠模型中,敲除上皮细胞中的特异性IκB激酶β(Inhibitor of Nuclear Factor κ-βkinase,IKK-β),干预NF-κB激活的经典途径,可使小鼠体内的肿瘤数量明显下降[32]。
EMT是上皮细胞在转移过程中获得运动和入侵能力的基本程序。在此过程中,细胞失去其上皮细胞特征,如E-cadherin和Zonula Occludens-1等细胞-细胞黏附蛋白,并获得间充质性状,如N-cadherin和波形蛋白(Vimentin)等前体细胞骨架蛋白。E-cadherin下调,N-cadherin蛋白上调,可使细胞形成伪足,获得侵袭能力,对肿瘤的浸润和转移起到促进作用。具有EMT表型的细胞甚至可以作为单个细胞侵入,因此,探索EMT发生的机制对于提高患者的生存至关重要。有研究指出NF-κB能够与基因上的转录因子Snail和ZEB基因位点结合,促进相应转录因子表达,进而抑制E-钙黏蛋白(E-cadherin,E-cad)和桥粒斑蛋白的表达,同时上调N-钙黏蛋白(N-cadherin,N-cad)的表达,以促进EMT的发生[33]。本研究在体外实验部分已经证实,LPS可以通过NF-κB途径诱导人结肠癌细胞发生EMT。
同领域研究者已证实黄芪多糖可减少炎性细胞浸润,降低NF-κBp65 mRNA及其蛋白质的表达水平,从而发挥免疫保护作用[34]。在本研究中,通过CAC模型小鼠体内实验可见,灌服黄芪多糖后小鼠体质量升高,一般状态好转,有利于恢复小鼠的体质量和精神活动状态。解剖后观察成瘤情况,黄芪多糖虽然没有完全抑制肿瘤生长,但是在减少成瘤数目和大小上有积极作用。在病理诊断上,炎性反应程度和不典型增生程度也可被黄芪多糖改善。本在研究还证实了黄芪多糖可以改善CAC模型小鼠肠道菌群丰度和多样性。研究中发现黄芪多糖可以上调Lactobacillus和Lactococcus的丰度。Grimoud J等[35]根据抗炎和抗人结肠癌HT-29细胞增殖作用体外筛选出有效的益生菌和合生元,其中短双歧杆菌,乳球菌和Oligoalternan可以显著抑制增殖。而这种增殖抑制的作用机制同样是通过调控HT-29细胞对LPS诱发的炎性反应应答而实现的,LPS增加了其生物传感器TLR4的表达,而益生菌或合生元的介入,可以降低这种炎性反应传导。本研究经体外实验发现黄芪多糖对LPS诱导的人结肠癌LoVo细胞NF-κB活化有抑制作用,并且通过划痕实验直观的观察到黄芪多糖可以抑制LPS诱导的细胞迁移。由此可以推断黄芪多糖对人结肠癌LoVo细胞EMT的发生也有一定影响。因此,本研究进一步研究了黄芪多糖对人结肠癌LoVo细胞的迁移的影响。在EMT的发生中,E-cad下调,N-cad蛋白上调,使细胞形成伪足,获得侵袭能力,对肿瘤的浸润和转移起到促进作用。本实验对EMT发生的相关蛋白NF-κB p65、E-cad和N-cad作了测定,发现黄芪多糖可以降低NF-κB p65和N-cad蛋白的含量,升高E-cad蛋白的含量。因此,可以初步认为APS在抑制人结直肠癌细胞的迁移上也有明显效果,并且这种效果的产生是由于TLR4/NF-κB信号通路被抑制。
参考文献
[1]Bray F,Ferlay J,Soerjomataram I,et al.Global Cancer Statistics 2018:GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J].CA:A Cancer Journal for Clinicians,2018,68(6):394-424.
[2]Fang JY,Zheng S,Jiang B,et al.Consensus on the Prevention,Screening,Early Diagnosis and Treatment of Colorectal Tumors in China:Chinese Society of Gastroenterology,October 14-15,2011,Shanghai,China[J].Gastrointest Tumors,2014,1(2):53-75.
[3]Lin X,Xu W,Shao M,et al.Shenling Baizhu San supresses colitis associated colorectal cancer through inhibition of epithelial-mesenchymal transition and myeloid-derived suppressor infiltration[J].BMC Complement Altern Med,2015,15:126.
[4]Sivan A,Corrales L,Hubert N,et al.Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy[J].Science,2015,350(6264):1084-1089.
[5]Liu XH,Guo L,Yang YL,et al.Development and Validation of a Rapid and Simple UPLC-ESI-MS Method for Pharmacokinetics and Tissue Distribution of Astragaloside Ⅲ in Rats[J].J Chromatogr Sci,2016,54(5):811-818.
[6]Adesso S,Russo R,Quaroni A,et al.Astragalus membranaceus Extract Attenuates Inflammation and Oxidative Stress in Intestinal Epithelial Cells via NF-κB Activation and Nrf2 Response[J].Int J Mol Sci,2018,19(3):800.
[7]Tian QE,Li HD,Yan M,et al.Astragalus polysaccharides can regulate cytokine and P-glycoprotein expression in H22 tumor-bearing mice[J].World J Gastroenterol,2012,18(47):7079-7086.
[8]Jiao R,Liu Y,Gao H,et al.The Anti-Oxidant and Antitumor Properties of Plant Polysaccharides[J].Am J Chin Med,2016,44(3):463-488.
[9]Zhou Z,Meng M,Ni H.Chemosensitizing Effect of Astragalus Polysaccharides on Nasopharyngeal Carcinoma Cells by Inducing Apoptosis and Modulating Expression of Bax/Bcl-2 Ratio and Caspases[J].Med Sci Monit,2017,23:462-469.
[10]Kangwan N,Kim YJ,Han YM,et al.Concerted actions of ameliorated colitis,aberrant crypt foci inhibition and 15-hydroxyprostaglandin dehydrogenase induction by sonic hedgehog inhibitor led to prevention of colitis-associated cancer[J].Int J Cancer,2016,138(6):1482-1493.
[11]Luo C,Zhang H.The Role of Proinflammatory Pathways in the Pathogenesis of Colitis-Associated Colorectal Cancer[J].Mediators Inflamm,2017,2017:5126048.
[12]Han S,Gao J,Zhou Q,et al.Role of intestinal flora in colorectal cancer from the metabolite perspective:a systematic review[J].Cancer Manag Res,2018,10:199-206.
[13]Vu T,Jin L,Datta PK.Effect of Cigarette Smoking on Epithelial to Mesenchymal Transition(EMT)in Lung Cancer[J].J Clin Med,2016,5(4):44.
[14]Zhang H,Yang W,Yan J,et al.Loss of profilin 2 contributes to enhanced epithelial-mesenchymal transition and metastasis of colorectal cancer[J].Int J Oncol,2018,53(3):1118-1128.
[15]Hyun YS,Han DS,Lee AR,et al.Role of IL-17A in the development of colitis-associated cancer[J].Carcinogenesis,2012,33(4):931-936.
[16]Saleiro D,Murillo G,Benya RV,et al.Estrogen receptor-β protects against colitis-associated neoplasia in mice[J].Int J Cancer,2012,131(11):2553-2561.
[17]Wu S,Rhee KJ,Albesiano E,et al.A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses[J].Nat Med,2009,15(9):1016-1022.
[18]Soslow RA,Dannenberg AJ,Rush D,et al.COX-2 is expressed in human pulmonary,colonic,and mammary tumors[J].Cancer,2000,89(12):2637-2645.
[19]Puar YR,Shanmugam MK,Fan L,et al.Evidence for the Involvement of the Master Transcription Factor NF-κB in Cancer Initiation and Progression[J].Biomedicines,2018,6(3):82.
[20]Bulgarelli D,Garrido-Oter R,Münch PC,et al.Structure and function of the bacterial root microbiota in wild and domesticated barley[J].Cell Host Microbe,2015,17(3):392-403.
[21]Segata N,Izard J,Waldron L,et al.Metagenomic biomarker discovery and explanation[J].Genome Biol,2011,12(6):R60.
[22]Brandi G,Pantaleo MA,Biasco G,et al.Activated NF-kB in colorectal cancer:predictive or prognostic factor?[J].J Clin Oncol,2008,26(8):1388-1390.
[23]Liu B,Ding F,Hu D,et al.Human umbilical cord mesenchymal stem cell conditioned medium attenuates renal fibrosis by reducing inflammation and epithelial-to-mesenchymal transition via the TLR4/NF-κB signaling pathway in vivo and in vitro[J].Stem Cell Res Ther,2018,9(1):7.
[24]Kaltenbach T,Sandborn WJ.Endoscopy in inflammatory bowel disease:advances in dysplasia detection and management[J].Gastrointest Endosc,2017,86(6):962-971.
[25]Bader JE,Enos RT,Velázquez KT,et al.Macrophage depletion using clodronate liposomes decreases tumorigenesis and alters gut microbiota in the AOM/DSS mouse model of colon cancer[J].Am J Physiol Gastrointest Liver Physiol,2018,314(1):G22-G31.
[26]Kucharzik T,Maaser C,Lügering A,et al.Recent understanding of IBD pathogenesis:implications for future therapies[J].Inflamm Bowel Dis,2006,12(11):1068-1083.
[27]McLean MH,Murray GI,Stewart KN,et al.The inflammatory microenvironment in colorectal neoplasia[J].PLoS One,2011,6(1):e15366.
[28]Ye K,Chen QW,Sun YF,et al.Loss of BMI-1 dampens migration and EMT of colorectal cancer in inflammatory microenvironment through TLR4/MD-2/MyD88-mediated NF-κB signaling[J].J Cell Biochem,2018,119(2):1922-1930.
[29]Dejea CM,Fathi P,Craig JM,et al.Patients with familial adenomatous polyposis harbor colonic biofilms containing tumorigenic bacteria[J].Science,2018,359(6375):592-597.
[30]Cascio S,Faylo JL,Sciurba JC,et al.Abnormally glycosylated MUC1 establishes a positive feedback circuit of inflammatory cytokines,mediated by NF-κB p65 and EzH2,in colitis-associated cancer[J].Oncotarget,2017,8(62):105284-105298.
[31]Chen T,Li J,Xu M,et al.PKCε phosphorylates MIIP and promotes colorectal cancer metastasis through inhibition of RelA deacetylation[J].Nat Commun,2017,8(1):939.
[32]Yang SS,Li XM,Yang M,et al.FMNL2 destabilises COMMD10 to activate NF-κB pathway in invasion and metastasis of colorectal cancer[J].Br J Cancer,2017,117(8):1164-1175.
[33]Wang XH,Jia HL,Deng L,et al.Astragalus polysaccharides mediated preventive effects on bronchopulmonary dysplasia in rats[J].Pediatr Res,2014,76(4):347-354.
[34]Feng M,Feng J,Chen W,et al.Lipocalin2 suppresses metastasis of colorectal cancer by attenuating NF-κB-dependent activation of snail and epithelial mesenchymal transition[J].Mol Cancer,2016,15(1):77.
[35]Liu B,Ding F,Hu D,et al.Correction to:Human umbilical cord mesenchymal stem cell conditioned medium attenuates renal fibrosis by reducing inflammation and epithelial-to-mesenchymal transition via the TLR4/NF-κB signaling pathway in vivo and in vitro[J].Stem Cell Res Ther,2018,9(1):76.
(2019-09-16收稿 責任编辑:王明)
基金项目:中国博士后科学基金面上项目(2019M650596)
作者简介:刘雷蕾(1989.10—),男,博士后,助理研究员,研究方向:中医基础理论和中医药治疗脾胃病基础研究,E-mail:lightlong@126.com
通信作者:马淑然(1964.11—),女,博士,教授,博士研究生导师,研究方向:天人相应中医理论临床与实验研究,E-mail:mashuran64@sina.com
