基于网络效应的薯蓣皂苷类成分调控糖代谢作用机制研究
2021-07-08张晶李冰冰黄敏仪肖雪张贵民郭姣
张晶 李冰冰 黄敏仪 肖雪 张贵民 郭姣
摘要 目的:基于網络药理学方探讨薯蓣皂苷类成分调控糖代谢的潜在作用机制。方法:利用文献挖掘及数据库检索获得薯蓣皂苷类成分调控糖代谢的活性成分、作用靶点及与糖代谢相关的疾病靶点,利用STRING、Cytoscape3.5.1中的BiNGO、MCODE及CluGO插件对潜在靶点分别进行GO生物过程、聚类模块及KEGG信号通路富集分析,构建薯蓣皂苷类“成分-靶点-通路-疾病”网络。结果:本研究筛选得到11种薯蓣皂苷类活性成分,协同作用于AKT1、STAT3、VEGFA等22个关键靶点,主要参与蛋白激酶级联调控、免疫反应、白细胞趋化性调控等7类生物过程及HIF-1信号通路、糖尿病并发症的AGE-RAGE信号通路、长寿信号通路、脂肪细胞脂解调控、肾素-血管紧张素系统等25条信号通路综合调控糖代谢。结论:本研究初步揭示了薯蓣皂苷类成分的潜在活性成分及其可能的降糖机制,薯蓣皂苷类成分调控糖代谢作用是多靶点、多层次,多途径的,并且可以推测HIF-1信号通路可能是其发挥作用最为重要的信号通路,为薯蓣皂苷类成分进一步的开发和临床应用提供了理论依据。
关键词 薯蓣皂苷类成分;糖代谢调控作用;网络药理学;HIF-1信号通路
Study on the Mechanism of Glycometabolism Regulation of the Dioscins Based on Network Effect
ZHANG Jing1,2,LI Bingbing3,HUANG Minyi1,2,XIAO Xue1,2,ZHANG Guimin3,GUO Jiao1,2
(1 Guangdong Metabolic Disease Research Center of Integrated Chinese and Western Medicine,Guangdong Pharmaceutical
University,Guangzhou 510006,China; 2 Guangdong Key Laboratory of Metabolic Disease Prevention and Treatment of
Traditional Chinese Medicine,Guangzhou 510006,China; 3 State Key Laboratory of Generic Manufacture Technology
of Chinese Traditional Medicine,Lunan Pharmaceutical Group Co.,Ltd.,Linyi 276000,China)
Abstract Objective:To discover the potential mechanism of the Dioscin in regulating blood glucose based on the network pharmacology method.Methods:Literature mining and database retrieval were used to obtain the active components,action targets and related disease targets of the Dioscin in regulating glucose metabolism.GO biological process,clustering module and KEGG signal pathway enrichment analysis were carried out by using STRING and Cytoscape,including BiNGO,MCODE and CluGO plug-ins,respectively.Finally,the “component-target-pathway-disease” network of the Dioscin was constructed.Results:In this study,11 active components of the Dioscin were selected and applied to 22 key targets such as AKT1,STAT3,VEGFA,which involved 7 biological processes,such as regulation of intracellular protein kinase cascade,immune response,regulation of leukocyte chemotaxis etc.Meanwhile,they were involved in AGE-RAGE signal pathway,HIF-1 signal pathway,longevity regulating pathway,regulation of lipolysis in adipocytes,renin secretion,renin-angiotensin system and other 25 signal pathways for comprehensive glycometabolism regulation.Conclusion:This study preliminary reveals the potential active ingredient of the Dioscin and its possible hypoglycemic mechanism.Dioscin on glucose metabolism is multi-target,multi-layer and multi-pathway,and it can be speculated that the HIF-1 signaling pathway may be the most important one.Additionally,it provides a theoretical basis for Dioscin′s further development and clinical application.
Keywords Dioscin; Glycometabolism regulation; Network pharmacology; HIF-1 signaling pathway
中图分类号:R285.6文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.02.004
薯蓣皂苷(dioscin)类成分具有抗炎、抗肿瘤、抗血栓、降血脂、免疫调节等作用,用于治疗心脑血管疾病疗效显著[1-5]。近年来,针对薯蓣皂苷类成分的研究多集中在工艺提取[6]、生物活性[7]和药理作用[8]等方面。在糖脂代谢病创新理论的指导下,糖、脂代谢网络交织,病理机制具有共通性[9]。同时已有文献报告含有薯蓣皂苷类成分的中药如山药具有较好的降血糖作用[10],但其作用机制尚不明确。因此,本文拟从网络效应的角度[11],基于文献数据库,探讨薯蓣皂苷类成分降血糖调控糖代谢作用机制,筛选调节血糖代谢的潜在药效成分、潜在作用靶点及作用机制。
1 材料与方法
1.1 薯蓣皂苷类活性成分库构建 以“薯蓣皂苷”“Dioscin”为关键词从PubMed、中国知网及万方数据服务平台获得所有已经报道的薯蓣皂苷类化学成分,通过Scifinder数据库(https://scifinder.cas.org/scifinder/)及有机小分子生物活性数据库PubChem(https://pubchem.ncbi.nlm.nih.gov/search/)[12]查询所得成分的CAS号和Canonical SMILES字符串。
1.2 活性成分潜在靶点反向预测 Swiss Target Prediction(http://www.swisstargetprediction.ch/)[13]服务器是一个基于反向分子对接技术能精确预测生物活性分子靶点的服务器,将查询到的Canonical SMILES字符串输入Swiss Target Prediction网站进行靶点对接,获得薯蓣皂苷类成分潜在的靶点基因,即为活性成分潜在作用靶点。
1.3 糖代谢相关疾病靶点预测 通过GeneCards数据库(http://www.genecards.org/)[14]检索糖代谢调控作用相关疾病靶点,检索词分别为“Diabetes(DM)”“Diabetic cerebrovascular disease(DCD)”“Diabetic nephropathy(DN)”“Diabetes retinopathy(DRP)”“Diabetic cardiopathy(DC)”“Diabetic polyneuropathy(DPN)”“Diabetic foot(DF)”,以相关性分数(Relevance score≥30)作为筛选条件,筛选结果作为与糖代谢作用相关疾病的候选靶点基因。
1.4 薯蓣皂苷类“成分-疾病-靶点”网络构建 将筛选的疾病靶点输入STRING(https://string-db.org/cgi/input.pl)[15]生物分子功能性蛋白质关联网络平台中,限定物种为人,获取蛋白相互作用关系。应用Cytoscape3.5.1[16]软件及Merge功能,依次导入1.2中整理的成分-靶点关系对及蛋白互作关系,分别构建“成分-靶点”网络、疾病靶点相互作用(PPI)网络及薯蓣皂苷类“成分-疾病-靶点”网络图。并运用Cytoscape3.5.1中的插件Network Analyzer分析网络拓扑参数:节点度(Degree)。
1.5 网络分析 利用Cytoscape软件中的“BiNGO”插件对所有靶基因进行基因本位论(Gene Ontology,GO)生物过程富集,并运用“MCODE”插件对所有具有统计学意义的GO生物过程聚类分析。MCODE是一种基于图论的聚类算法,它能快速的在大规模蛋白网络中检测到稠密连通区域并依据关联程度打分,K-Core值即为决定模块大小的参数[17]。利用CluGO插件对薯蓣皂苷类成分潜在靶点进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,参数设置为P<0.05。
2 结果
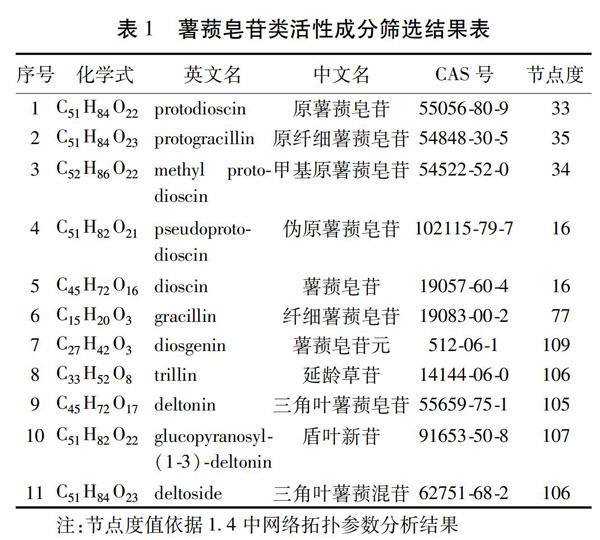
2.1 活性成分筛选结果 通过PubMed、中国知网、万方数据服务等平台共获得已报道的薯蓣皂苷类成分51个,经查询51个成分的CAS号和Canonical SMILES字符串,去除查询没有结果的成分,共汇总得到11个活性成分。见表1。
2.2 活性成分靶点预测结果 通过Swiss Target Prediction服务器虚拟筛选,共得到潜在靶点基因331个,经UniProt统一为基因名。进而得到成分-靶点关系744对,用Excel表格整理。
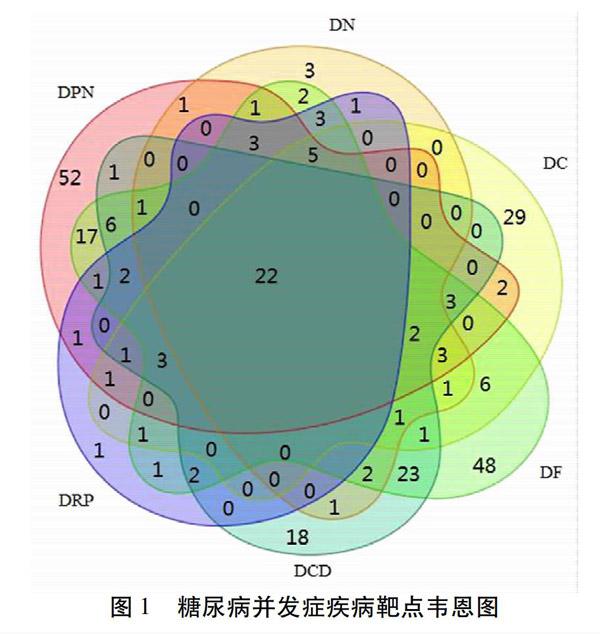
2.3 疾病靶点预测结果 通过GeneCards数据库依次检索DM、DCD、DN、DRP、DC、DPN、DF疾病靶点,经筛选后分别得到疾病基因靶点数目为109、90、54、50、83、128、162。其中,6种糖尿病并发症之间既存在共性靶点,又存在特有靶点。见图1。提示糖尿病并发症可能基于共同的发病机制,又因个体而出现差异,从而诱导不同并发症的出现。
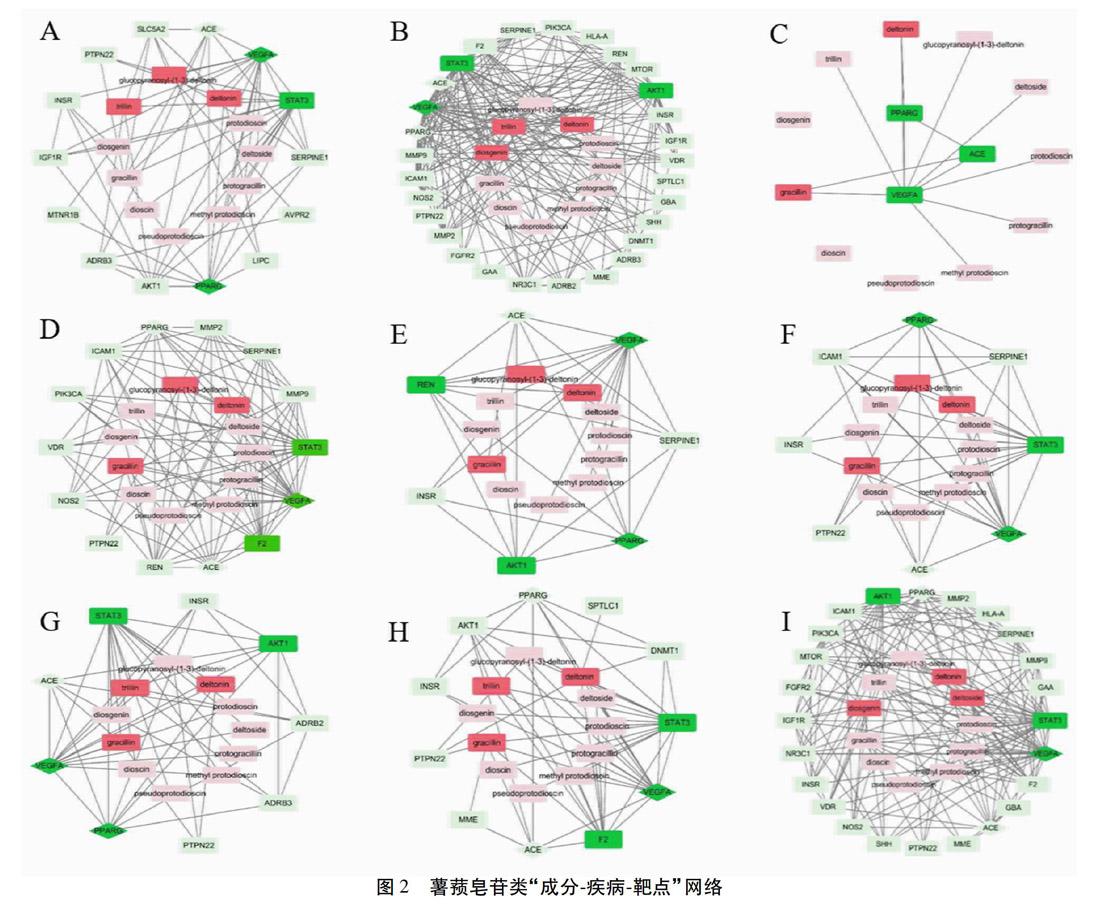
2.4 成分-疾病-靶点网络构建 利用Cytoscape3.5.1软件风格化显示薯蓣皂苷类“成分-疾病-靶点”网络图。见图2。共包含9个子网络图,33个潜在靶点基因,各网络平均邻居节点数依次为:5.2、9.75、1.857、7.92、3.778、4.526、4.8、5.273、9.029。节点度Degree值表示网络中节点通过边的个数,Degree值越大,该节点与其他节点联系就更密切。在本网络图中,Degree值较大的成分包含glucopyranosyl-(1-3)-deltonin(盾叶新苷)、deltonin(三角叶薯蓣皂苷)、trillin(延龄草苷)、diosgenin(薯蓣皂苷元)、deltoside(纤细薯蓣皂苷)和deltoside(三角叶薯蓣混苷);靶点包含VEGFA(血管内皮生长因子A)、STAT3(信号传导及转录激活因子3)、PPARγ(过氧化物酶体增生激活受体γ)、AKT1(丝氨酸/苏氨酸蛋白激酶)、F2(凝血因子Ⅱ)和REN(腎素),提示这些成分及靶点可能是薯蓣皂苷类成分调控糖代谢的关键。
2.5 GO生物过程与模块分析 以P<0.05为标准,将薯蓣皂苷类成分调控糖代谢作用的所有潜在靶点进行GO生物过程富集,结果33个靶点能参与1 313个GO生物过程,包含2 333条层级关系连线。随着系统生物学研究的深入,生物分子不再以单体作为主要表现形式,而是由相互作用的模块构成分子网络发挥作用[18]。按照MCODE聚类分析算法将1 313个GO生物过程进行模块分析,筛选得到K-Core≥3的7个聚类模块。见图3。依次涉及细胞内蛋白激酶级联调控、毛发/囊生长成熟、生物间相互作用、T细胞/淋巴细胞/白细胞/血小板活化分化调节、免疫系统及效应过程、RNA聚合酶Ⅱ启动子对基因特异性转录调控及白细胞趋化性调控等生物过程。
2.6 KEGG信号通路富集分析 将薯蓣皂苷类成分作用各疾病的潜在靶点分别导入CluGO插件进行KEGG通路富集,按照P值(P<0.05)分别筛选出糖尿病(6条)、糖尿病脑血管病变(12条)、糖尿病肾病(4条)、糖尿病视网膜病变(2条)、糖尿病性心脏病(6条)、糖尿病周围神经病变(4条)、糖尿病足(24条),涉及氧化应激、糖脂代谢、内分泌调节、炎性反应、免疫等多方面的共25条信号通路。见表2。其中HIF-1信号通路和糖尿病并发症的AGE-RAGE信号通路在7种疾病中均有富集,且HIF-1信号通路在所有通路中占比最大。见图4。提示HIF-1信号通路可能是薯蓣皂苷类成分调控糖代谢的核心通路之一。
2.7 薯蓣皂苷类成分调控糖代谢作用机制分析
采用Cytoscape软件构建“成分-靶点-通路-疾病”网络模型。见图5。该模型中共66个节点,303条边,11种薯蓣皂苷类成分作用于22个糖代谢调控作用相关靶点,通过参与糖尿病并发症的AGE-RAGE信号通路、HIF-1信号通路、长寿信号通路、脂肪细胞脂解调控、肾素分泌、肾素-血管紧张素系统等25条信号通路防治糖尿病及其并发症,表明薯蓣皂苷类成分糖代谢调控机制是通过多成分、多靶点、多通路共同作用的结果。本网络平均邻居节点数为:9.292。
3 讨论
糖尿病作为全球健康负担,主要是由于胰岛素分泌绝对或相对的不足,从而导致血糖升高及反复波动,致使后期发生糖尿病脑血管病变、糖尿病肾病、糖尿病视网膜病变、糖尿病性心脏病、糖尿病周圍神经病变、糖尿病足等多种并发症,严重降低糖尿病患者的生命质量。有文献报道薯蓣皂苷类成分具有增敏胰岛素、降血糖作用[10],但其具体作用机制尚不明确。因此,为推动薯蓣皂苷类成分调控糖代谢的作用机制研究,本研究基于生物信息网络效应对其进行解释和探讨。
1型糖尿病属于自身免疫性疾病,其通过自身抗体破坏胰岛β细胞致使胰岛素分泌绝对不足。2型糖尿病则与后天环境饮食更密切相关,其主要产生胰岛素抵抗及胰岛β细胞功能减退而影响胰岛素分泌。糖尿病并发症的发病机制更为复杂,至今未能完全阐明,主要包括代谢因素(氧化应激,胰岛素抵抗及血脂异常)、基因调控、血流动力学(肾素-血管紧张素-醛固酮系统异常、微循环障碍)、炎性反应免疫等[19-22]。
3.1 氧化应激 HIF-1信号通路在糖尿病及其并发症中均有富集且占比最大提示其在薯蓣皂苷类成分调控糖代谢中的重要作用。见图4、图5。当机体发生缺氧反应时,体内会形成以HIF-1为核心,联合其上下游基因及产物形成复杂的缺氧调控网络。HIF-1为缺氧诱导因子,由对氧敏感的HIF-1α亚基和组成型表达的HIF-1β亚基共同构成,在调节葡萄糖代谢、脂质代谢、血管生成、炎性反应中起着重要作用[23-24]。HIF1可与缺氧反应元件(HRE)结合激活缺氧介导反应,从而调节糖酵解过程。HIF-1表达的失活会使葡萄糖激酶的催化作用减弱,从而导致葡萄糖不耐受及更严重的胰岛素抵抗反应。缺氧条件下HIF1参与调节脂质代谢,可诱导与中性脂质形成相关的低氧可诱导蛋白2(HIG2)的表达,还可通过同时激活PPARγ和糖酵解途径从而促进脂肪酸合成[25-26]。糖尿病环境中细胞对缺氧反应迟钝,HIF-1α表达降低,VEGF和VEGFR2含量降低,从而能够减弱血管生成及修复作用,最终导致心肌损伤、足细胞死亡。此外,炎性反应刺激因子等可通过调节NF-κB依赖的炎性反应信号通路来增强HIF-1基因及蛋白水平的表达,比如延龄草苷具有抗氧化和抗炎作用的机制之一可能就是通过抑制NF-κB p65的乙酰化水平,从而降低了TNF-α等炎性反应因子的产生[27-29]。
3.2 糖代谢异常 糖尿病并发症的AGE-RAGE信号通路是另外一条在糖尿病及其并发症中均有富集的信号通路。晚期糖基化终产物(AGEs)是还原糖或糖衍生产物上的碳基与蛋白质、脂类或核酸的氨基发生一系列非酶反应的产物,在糖尿病及其并发症发生发展中起着关键作用[30]。AGEs与其受体RAGE(一种由内皮、炎性反应、血管平滑肌和心肌细胞表达的多配体受体)相互作用,可上调MAPK信号通路、触发NF-κB和AP-1激活从而诱导炎性反应和氧化应激,最终导致糖尿病及其并发症的发生[31]。此外,AGEs能够抑制抗凋亡基因Bcl-2的表达,进而引起线粒体功能障碍,导致胰岛β细胞凋亡受损[32]。AGEs还可诱导溶酶体功能障碍,通过自噬的改变导致肾小管损伤,同时AGEs引起的血管与心肌胶原的交联可降低血管弹性和心肌弹性,进一步导致血管壁柔韧性下降,血管和心肌僵硬,从而导致糖尿病患者舒张功能障碍[33]。研究发现二甲双胍、阿卡波糖等临床药物及槲皮素、白藜芦醇等天然产物对AGEs具有一定的抑制作用[30],本研究发现薯蓣皂苷类成分通过作用于AKT1、PIK3CA、VEGFA等潜在靶点影响AGEs-RAGE信号通路,值得进一步研究。
3.3 脂代谢异常 脂肪细胞脂解调控在DM、DC、DF中出现富集,相关基因包括AKT1、INSR、PIK3CA、ADRB2和ADRB3。见表2。脂肪细胞脂解是白色脂肪组织的一种独特功能,主要为身体各器官供给能量。需能时儿茶酚胺与β-肾上腺素能受体结合,激活蛋白激酶A(PKA),PKA进一步磷酸化激素敏感性脂肪酶(HSL)和脂滴表面蛋白(Perilipin A),进而与脂肪滴中的TG和DG底物结合最终水解为甘油和FA[34]。ADRB2基因编码β2-肾上腺素能受体,主要影响血管扩张及平滑肌舒张。ADRB3基因编码β3-肾上腺素能受体,该基因突变有助于降低白色脂肪的脂解作用,增加棕色脂肪产热,从而引起糖脂代谢的紊乱[35-36]。大量研究显示,高水平的游离脂肪酸(FFA)能够引起胰岛素抵抗和胰岛β细胞障碍,即脂毒性。而长期高水平FFA会减少骨骼肌和脂肪组织细胞膜上GLUT4的数量,降低GLUT4表达和活性,从而抑制葡萄糖的氧化和代谢,导致胰岛素抵抗。薯蓣皂苷元能通过减少脂肪组织炎性反应和刺激脂肪细胞分化,激活肌肉细胞葡萄糖转运蛋白GLUT4,抑制脂质过氧化,从而使血糖水平降低并改善胰岛素抵抗[37-38]。
3.4 基因调控 长寿信号通路[39]是包括IGF-1/胰岛素信号通路、sirtuin信号通路、AMPK信号通路和mTOR信号通路的一条综合信号通路,AKT1、IGF1R、INSR、MTOR、PIK3CA、PPARγ是薯蓣皂苷类成分涉及长寿信号通路的潜在靶点。见表2。正常的胰岛素信号转导是调控血糖水平正常的关键,胰岛素样生长因子1(IGF-1)与其受体IGF1R结合将信息转移到细胞内,触发胰岛素受体(INSR)酪氨酸激酶磷酸化胰岛素受体底物(IRS),从而激活磷脂酰肌醇3激酶(PI3K),产生磷脂酰肌醇3,4,5三磷酸盐,并激活苏氨酸激酶(AKT)。AKT1表达和活性的改变与胰岛素抵抗的形成和发展密切相关,在胰岛素刺激下,它可以被磷酸化,进而促进葡萄糖转运蛋白GLUT4的上膜转运,从而增加葡萄糖摄取。PIK3CA为Ⅰ型PI3K,Li H等发现薯蓣皂苷可通过显著增加IRS-1/PI3K/Akt通路的表达减轻脂肪组织中的胰岛素抵抗[40-42]。活化后的Akt与其底物帕霉素靶体蛋白(mTOR)结合并使其发生磷酸化,形成信号级联反应,从而调控内皮细胞的生存、增殖进而调节血管的生成。AGC蛋白激酶家族(PKC、PKA与PKG)是mTOR的主要下游信号,PKC对DKD发生发展起关键性作用,活化的PKC可增强丝裂原活化蛋白激酶(MAPK)信号转导,从而改善肾小球滤过功能障碍。Chen L等[43-45]发现薯蓣皂苷通过抑制MAPK和Akt/GSK 3β/mTORx信号通路而减轻心肌肥厚。
3.5 肾素-血管紧张素-醛固酮系统异常 在图5网络中,DC和DN除上述讨论的共有通路外,还分别富集到了肾素分泌及肾素-血管紧张素系统。血管紧张素和醛固酮是肾素-血管紧张素-醛固酮系统(RAAS)主要效应器,由于胰岛素增敏作用,抑制RAAS的治疗对糖尿病微血管及大血管病变有着极其重要的临床意义。肾素作为蛋白水解酶,可使血管紧张素原分解生成血管紧张素Ⅰ(AngⅠ),再通过血管紧张素转换酶(ACE)的作用形成血管紧张素Ⅱ(AngⅡ)而發挥收缩血管和刺激醛固酮分泌的生理效应。局部AngⅡ的增多会增加肾小球压力,抑制足突细胞表达,从而引起持续性蛋白尿、肾小球硬化及进行性肾功能恶化。同时影响ROS、NF-κB、IL-6、TNF-α等炎性因子表达,从而导致炎性反应细胞浸润及成纤维细胞分化,逐步表现为慢性肾衰竭[46]。心血管中也存在局部的RAAS,AngⅡ的升高会引起心肌细胞增生及纤维化,从而导致心肌的舒张功能障碍[21]。此外,AngⅡ通过激活AT1受体,抑制胰岛素通过PI3K途径介导的葡萄糖的转运、糖原合成等,从而影响胰岛素代谢[47]。
3.6 炎性反应及免疫反应 图3GO生物过程的模块分析结果及上述通路基本均与炎性反应及免疫反应密切相关。淋巴细胞增殖是免疫活化的一个重要指标,而薯蓣皂苷元可以通过激活淋巴细胞、NK细胞等效应细胞进而发挥免疫作用[48-49]。慢性炎性反应是各种代谢障碍的关键机制之一,其能通过促进血糖过多的生成或抑制机体组织对血糖的摄取导致高血糖症。小胶质细胞作为一种固有免疫效应细胞,在抗炎和神经保护上发挥重要作用,而延龄草苷能抑制LPS诱导的小胶质细胞NO的产生,且显著抑制促炎因子TNF-α、IL-6、iNOS等mRNA的表达[50-52]。
综上所述,本研究通过阐述薯蓣皂苷类成分、糖代谢调控作用靶点、通路之间的网状关系,筛选出11个薯蓣皂苷类活性成分,作用于AKT1、MTOR、STAT3、VEGFA等22个关键靶点,通过调节氧化应激、糖脂代谢、基因、肾素-血管紧张素-醛固酮系统、炎性反应免疫等6方面综合干预糖尿病及其并发症,从而更加系统全面地揭示了薯蓣皂苷类成分调控糖代谢作用的机制。然而,由于数据库的完整性、实时性,分析软件与体内环境的差异等网络分析的局限,本研究仍需进一步的实验验证,结合质量标志物体系、多组学、分子生物学等现代技术明确薯蓣皂苷类成分的物质基础及作用机制,从而为其进一步的精准型开发利用提供充足的理论依据及指导。
参考文献
[1]尚海花,郑雅楠,王淼,等.HPLC法测定不同产地穿山龙中原薯蓣皂苷、原纤细薯蓣皂苷、甲基原薯蓣皂苷、伪原薯蓣皂苷、薯蓣皂苷和纤细薯蓣皂苷[J].现代药物与临床,2018,33(8):1879-1883.
[2]何焱,王继双,张鹏,等.薯蓣皂苷元药理作用及其机制研究进展[J].中草药,2013,44(19):2759-2765.
[3]赵叶,王维皓,荆文光,等.黄山药化学成分、药理作用及临床应用研究进展[J].中国实验方剂学杂志,2014,20(18):235-242.
[4]付晓丽.薯蓣皂苷元衍生物合成及抗血栓形成作用研究.天津:天津大学硕士研究生学位论文,2009.
[5]马海英,周秋丽,王本祥.黄山药总皂苷和薯蓣皂苷元抗高脂血症及体外抗血小板聚集的比较[J].中国医院药学杂志,2002,22(6):323-325.
[6]蔡华,雷攀,杨光义,等.薯蓣皂苷类化学成分提取方法研究进展[J].中国药师,2016,19(7):1366-1369.
[7]Zhu H,Xu JD,Mao Q,et al.Metabolic profiles of dioscin in rats revealed by ultra-performance liquid chromatography quadrupole time-of-flight mass spectrometry[J].Biomed Chromatogr,2015,29(9):1415-1421.
[8]李德成,刘庆燕,刘春燕.穿山龙的化学成分和药理作用研究进展[J].山西中医学院学报,2016,17(2):69-70.
[9]郭姣,肖雪,荣向路,等.糖脂代谢病与精准医学[J].世界科学技术-中医药现代化,2017,19(1):50-54.
[10]龚凌霄,池静雯,王静,等.山药中主要功能性成分及其作用机制研究进展[J].食品工业科技,2019,40(16):312-319.
[11]解静,高杉,李琳,等.网络药理学在中药领域中的研究进展与应用策略[J].中草药,2019,50(10):2257-2265.
[12]Wang Y,Cheng T,Bryant SH.PubChem BioAssay:A Decade′s Development toward Open High-Throughput Screening Data Sharing[J].SLAS Discov,2017,22(6):655-666.
[13]Gfeller D,Michielin O,Zoete V.Shaping the interaction landscape of bioactive molecules[J].Bioinformatics,2013,29(23):3073-3079.
[14]Rebhan M,Chalifa-Caspi V,Prilusky J,et al.GeneCards:integrating information about genes,proteins and diseases[J].Trends Genet,1997,13(4):163.
[15]Szklarczyk D,Franceschini A,Wyder S,et al.STRING v10:protein-protein interaction networks,integrated over the tree of life[J].Nucleic Acids Res,2015,43(Database issue):D447-452.
[16]Shannon P,Markiel A,Ozier O,et al.Cytoscape:a software environment for integrated models of biomolecular interaction networks[J].Genome Res,2003,13(11):2498-2504.
[17]任真真,張燕玲,王星,等.三七皂苷类成分的蛋白质相互作用网络分析[J].中国中药杂志,2014,39(11):2097-2101.
[18]李延恩.蛋白质相互作用网络的模块结构辨识[D].武汉:华中科技大学,2006.
[19]Xiao Y,Zheng L,Zou X,et al.Extracellular vesicles in type 2 diabetes mellitus:key roles in pathogenesis,complications,and therapy[J].J Extracell Vesicles,2019,8(1):1625677.
[20]桑小溪.糖尿病肾病发病机制的研究进展[J].当代医学,2019,25(17):193-194.
[21]徐娜,白淑芝.糖尿病心肌病发病机制的研究进展[J].医学综述,2019,25(3):520-524.
[22]李旖旎,柳铖棋,郑禕婧,等.5-羟色胺对糖尿病糖代谢及其并发症调控作用的研究进展[J].医学综述,2019,25(13):2648-2653.
[23]滑雅娜,鲁芙爱,王永福.HIF-1相关信号通路及其在自身免疫性疾病中作用[J].中国免疫学杂志,2019,35(8):1013-1017.
[24]Majmundar AJ,Wong WJ,Simon MC.Hypoxia-inducible factors and the response to hypoxic stress[J].Mol Cell,2010,40(2):294-309.
[25]Gordan JD,Thompson CB,Simon MC.HIF and c-Myc:sibling rivals for control of cancer cell metabolism and proliferation[J].Cancer Cell,2007,12(2):108-113.
[26]柳宇.缺氧诱导因子在细胞能量代谢中的作用[J].医学研究生学报,2014,27(5):542-545.
[27]任玥衡,郝传明.缺氧诱导因子及其研究进展[J].中国血液净化,2014,13(5):397-400,404.
[28]侯天亮,杨龙,郑宏.糖尿病对心肌低氧诱导因子-1的影响及研究进展[J].医学综述,2019,25(13):2660-2664.
[29]高健美,徐凡,雷鸣,等.延龄草苷对过氧化氢诱导的PC12细胞氧化损伤和炎性反应因子表达的影响[J].天然产物研究与开发,2017,29(3):449-453,531.
[30]郑晓茂,茹琴,陈琳.晚期糖基化终产物对糖尿病及其并发症的影响和干预的研究进展[J].重庆医学,2019,48(13):2292-2296.
[31]Kosmopoulos M,Drekolias D,Zavras PD,et al.Impact of advanced glycation end products(AGEs)signaling in coronary artery disease[J].Biochim Biophys Acta Mol Basis Dis,2019,1865(3):611-619.
[32]游嘉,张文健,娄晋宁.糖基化终末产物对胰岛β细胞的损伤及作用机制研究进展[J].医学研究杂志,2015,44(7):174-176,179.
[33]Inagi R.RAGE and glyoxalase in kidney disease[J].Glycoconj J,2016,33(4):619-626.
[34]Frühbeck G,Méndez-Giménez L,Fernández-Formoso JA,et al.Regulation of adipocyte lipolysis[J].Nutr Res Rev,2014,27(1):63-93.
[35]Pearce A,Sanders L,Brighton PJ,et al.Reciprocal regulation of β2-adrenoceptor-activated cAMP response-element binding protein signalling by arrestin2 and arrestin3[J].Cell Signal,2017,38:182-191.
[36]张峻恺,段思彰,缪俊,等.β3肾上腺素能受体与肥胖的研究进展[J].医学综述,2019,25(10):1916-1920,1925.
[37]馬校芬.T2DM合并脂代谢紊乱与胰岛素抵抗及胰岛分泌功能的相关性分析[D].唐山:华北理工大学,2016.
[38]张玲,冷锦红.薯蓣皂苷元对代谢系统疾病治疗作用及机制研究[J].辽宁中医药大学学报,2019,21(6):161-165.
[39]沈义栋.浅谈长寿信号通路及它们在不同组织间的传递[J].中国细胞生物学学报,2015,37(8):1067-1073.
[40]余星,郑坚奕,蔡腾飞,等.胰岛素样生长因子1在心力衰竭中的研究进展[J].中国动脉硬化杂志,2019,27(9):819-822.
[41]胡海军,田维锋,逯艳婷,等.促葡萄糖摄取细胞模型的构建及应用[J].植物分类与资源学报,2015,37(6):821-827.
[42]Li H,Yu L,Zhao C.Dioscin attenuates high fat diet induced insulin resistance of adipose tissue through the IRS 1/PI3K/Akt signaling pathway[J].Mol Med Rep,2019,19(2):1230-1237.
[43]Sun X,Meng L,Qiao W,et al.Vascular endothelial growth factor A/Vascular endothelial growth factor receptor 2 axis promotes human dental pulp stem cell migration via the FAK/PI3K/Akt and p38 MAPK signalling pathways[J].Int Endod J,2019,52(12):1691-1703.
[44]黎池健,黄玉香,许伟成,等.mTOR信号通路在糖尿病肾病发病机制中作用的研究进展[J].生命科学,2019,31(3):284-288.
[45]Chen L,Li Q,Lei L,et al.Dioscin ameliorates cardiac hypertrophy through inhibition of the MAPK and Akt/GSK3β/mTOR pathways[J].Life Sci,2018,209:420-429.
[46]潘道延,沈洁.肾素-血管紧张素-醛固酮系统与糖尿病肾病[J].中华临床医师杂志,2015,9(4):523-527.
[47]Velloso LA,Folli F,Sun XJ,et al.Cross-talk between the insulin and angiotensin signaling systems[J].Proc Natl Acad Sci U S A,1996,93(22):12490-12495.
[48]Dong M,Meng Z,Kuerban K,et al.Diosgenin promotes antitumor immunity and PD-1 antibody efficacy against melanoma by regulating intestinal microbiota[J].Cell Death Dis,2018,9(10):1039.
[49]徐冰芳.薯蓣皂苷元免疫调节活性及抗肿瘤转移机制研究[D].长春:吉林农业大学,2015.
[50]韦之富,雷自立,郭姣.高血糖症的炎性反应机制研究进展[J].今日药学,2017,27(5):358-360.
[51]Kim SS,Kong PJ,Kim BS,et al.Inhibitory action of minocycline on lipopolysaccharide-induced release of nitric oxide and prostaglandin E2 in BV2 microglial cells[J].Arch Pharm Res,2004,27(3):314-318.
[52]杨红云,郭虹,柴丽娟,等.延龄草苷对脂多糖刺激的小胶质细胞炎性反应抑制作用[J].药物评价研究,2014,37(3):218-221.
(2019-11-20收稿 责任编辑:王明)
基金项目:国家重点研发计划项目(2018YFC1704200,2018YFC1704205);国家自然科学基金重点项目(81530102,81830113)
作者简介:张晶(1995.08—),女,硕士研究生在读,研究方向:中西医结合防治糖脂代谢病研究,Tel:(020)39353115,E-mail:zjsjh@foxmail.com
通信作者:郭姣(1961.11—),女,博士研究生,教授,主任医师,博士研究生导师,研究方向:中西医结合防治糖脂代谢病研究,E-mail:gyguoyz@163.com;张贵民(1969.10—),男,硕士研究生,研究员,博士研究生导师,研究方向:药物研发,E-mail:lunanzhangguimin@163.com
